Что такое секвенирование по сэнгеру
Секвенирование геномов для «чайников»
 Геномика: постановка задачи и методы секвенирования
Геномика: постановка задачи и методы секвенирования
Сергей Николенко, кандидат физико-математических наук, старший научный сотрудник лаборатории вычислительной биологии Санкт-Петербургского Академического Университета в серии статей говорит о некоторых задачах биоинформатики, связанных со сборкой и анализом геномов, делая акцент на математической, комбинаторной постановке задачи. В данном, вводном, тексте речь идет о том, как выглядят входные данные для сборки геномов и как их получают.
Как выглядит молекула ДНК?
Начнем с того, как выглядит молекула ДНК. Молекулы полимеров характеризуются первичной структурой, под которой понимается просто состав молекулы (в данном случае – последовательность букв A, C, G и T, которые и составляют геном), вторичной структурой, т.е. тем, какие именно химические связи устанавливаются между этими компонентами и какие в результате получаются базовые пространственные структуры (в данном случае – двойная спираль), и третичной структурой, т.е. тем, как вторичная структура «уложена» в пространстве. Вторичная структура ДНК представляет собой двойную спираль, состоящую из четырёх разных нуклеотидов.

Рисунок из Википедии
Нуклеотиды обозначаются по содержащимся в них азотистым основаниям: аденину (A), цитозину (C), гуанину (G) и тимину (T) (есть ещё урацил, который в РНК заменяет тимин), и в дальнейшем мы всегда будем пользоваться этими буквами. В двойной спирали эти нуклеотиды связаны друг с другом водородными связями, и связь устанавливается по принципу комплементарности: если в одной нити ДНК стоит A, то в комплементарной нити будет T, а если в одной нити C, то в другой будет G. Именно это позволяет относительно просто проводить репликацию (копирование) ДНК, например, при делении клетки: для этого достаточно просто разорвать водородные связи, разделив двойную спираль на нити, после чего парная нить для каждого «потомка» автоматически соберётся правильно. Важно понять, что ДНК – это две копии одного и того же «текста» из четырёх «букв»; «буквы» в копиях не идентичны, но однозначно соответствуют друг другу. Например:
Было бы, конечно, удобно, если бы нам удалось аккуратно «вытянуть» одну нить ДНК и спокойно, нуклеотид за нуклеотидом, «прочесть» эту нить от начала до конца. При таком, идеальном, методе секвенирования (чтения ДНК) никаких хитрых алгоритмов не понадобилось бы. К сожалению, на данном этапе такое невозможно, и приходится довольствоваться результатами того секвенирования, которое есть.
Что такое секвенирование?
Секвенирование (sequencing) – это общее название методов, которые позволяют установить последовательность нуклеотидов в молекуле ДНК. В настоящее время нет ни одного метода секвенирования, который бы работал для молекулы ДНК целиком; все они устроены так: сначала готовится большое число небольших участков ДНК (клонируется молекула ДНК многократно и «разрезается» в случайных местах), а потом читается каждый участок по отдельности.
Клонирование происходит либо просто выращиванием клеток в чашке Петри, либо (в случаях, когда это было бы слишком медленно или по каким-то причинам не получилось бы) при помощи так называемой полимеразной цепной реакции. В кратком и неточном изложении работает она примерно так: сначала ДНК денатурируют, т.е. разрушают водородные связи, получая отдельные нити. Затем к ДНК присоединяют так называемые праймеры; это короткие участки ДНК, к которым может присоединиться ДНК-полимераза – соединение, которое, собственно, и занимается копированием (репликацией) нити ДНК.

Рисунок из Википедии
На следующем этапе полимераза копирует ДНК, после чего процесс можно повторять: после новой денатурации отдельных нитей будет уже вдвое больше, на третьем цикле – вчетверо, и так далее.
Все эти эффекты достигаются в основном с помощью изменений температуры смеси из ДНК, праймеров и полимеразы; для наших целей важно, что это достаточно точный процесс, и ошибки в нём редки, а на выходе получается большое число копий участков одной и той же ДНК. Разные методы секвенирования отличаются друг от друга не методами клонирования, а тем, как потом прочесть получившийся «суп» из многочисленных копий одной и той же ДНК.
Секвенирование по Сэнгеру
Первым методом секвенирования, который учёные сумели применить для обработки целых геномов (в том числе генома человека), стало секвенирование по Сэнгеру (Sanger sequencing). Смысл таков: участок ДНК клонируется, после чего полученная смесь делится на четыре части. Каждая часть помещается в активную среду, где присутствуют:
Собственно, процесс практически идентичен клонированию ДНК, с которым мы встретились в предыдущем разделе. Разница только в том, что теперь в один из нуклеотидов подмешаны «ложные» нуклеотиды; они могут образовать точно такую же водородную связь, но не могут продолжить свою нить дальше.
В результате в каждой части образуется большое число копий префиксов исследуемого участка ДНК, которые имеют разную длину, но всегда заканчиваются на одну и ту же букву – в зависимости от того, когда повезёт взять в процесс клонирования «ложный» нуклеотид. Например, в пробирке, где все последовательности заканчиваются на Т, из нашего примера выше получилась бы смесь из следующих префиксов:
ATGCAGAACAGACGATCAGCGACACTTTA (образец)
AT
ATGCAGAACAGACGAT
ATGCAGAACAGACGATCAGCGACACT
ATGCAGAACAGACGATCAGCGACACTT
ATGCAGAACAGACGATCAGCGACACTTT
Как теперь, получив такую смесь, «прочесть» геномную последовательность? Заметим, что в сумме в четырёх пробирках мы получили все возможные префиксы интересующего нас участка. Это значит, что если мы сможем просто измерить длину каждого префикса (точнее говоря, даже не измерить, а просто упорядочить, узнав, кто из них длиннее), то мы сможем узнать и последовательность тоже. Предположим, что мы увидели, что в пробирках лежат префиксы вот такой длины (по порядку, от самого лёгкого 1 до самого тяжёлого 10):A C G T
1, 5, 7, 8, 10 4, 9 3, 6 2
Очевидно, что эта последовательность начинается с А (т.к. самый лёгкий префикс, из одной буквы, заканчивается на A); дальше идёт C, дальше опять A, и так далее. В результате можно прочесть исходный участок: ATGCAGAACA.
А чтобы измерить длину, можно, например, измерить массу всех префиксов во всех пробирках. Чтобы измерить массу, можно, например (разные секвенаторы использовали разные процедуры, но суть от этого не меняется), ионизировать эти молекулы и отправить их наперегонки к заряженному электроду в специальном геле, который создаст трение и замедлит продвижение молекул – этот метод называется электрофорезом. При одинаковом заряде более тяжёлые молекулы будут двигаться медленнее, и в результате получится примерно такая картинка.

Рисунок из Википедии
Видно, что (в идеальном случае) можно просто прочесть последовательность нуклеотидов от самого лёгкого префикса (т.е. префикса из одной буквы) к самому тяжёлому.
Результаты и ошибки сэнгеровского секвенирования
На выходе из сэнгеровского секвенатора получаются короткие участки ДНК, так называемые риды (reads). Для биоинформатики принципиальны две вещи: во-первых, какой длины получаются риды, во-вторых, какие в них могут быть ошибки и как часто (разумеется, на свете нет ничего идеального).
Сэнгеровские риды по этим критериям очень хороши: получаются риды длиной около тысячи нуклеотидов, причём качество начинает заметно падать только после 700-800 нуклеотидов. Сам процесс секвенирования по Сэнгеру, с которым мы познакомились в предыдущем разделе, предопределяет и эффект падения качества (труднее отличить молекулу массой 700 от молекулы массой 701, чем массу 5 от массы 6), и другой неприятный эффект – если в геноме встречается длинная последовательность из одной и той же буквы (…AAAAAAAA…), трудно бывает точно определить, какой она длины – все промежуточные массы попадут в одну и ту же пробирку, некоторые из них могут не встретиться, некоторые слиться друг с другом и т.д. Но всё же сэнгеровское секвенирование даёт отличные результаты с достаточно длинными ридами, которые потом относительно легко собирать. О том, как это делается, мы будем говорить в последующих текстах.
Именно при помощи сэнгеровского секвенирования был впервые расшифрован геном человека. Секвенирование по Сэнгеру применяется и сегодня, но его всё активнее вытесняют другие методы, и применяется оно всё реже. Кому же и почему оно уступило свои позиции?
Секвенаторы второго поколения: Illumina
Современные секвенаторы – это так называемые секвенаторы второго поколения (SGS, second generation sequencing). В них участки ДНК по-прежнему многократно клонируются, но процесс чтения устроен не так, как у Сэнгера. Существует много разных методов, отличающихся довольно существенно, поэтому мы рассмотрим только один из них, один из самых популярных на сегодня – секвенирование по методу Solexa (ныне Illumina; в смене названия не нужно искать глубокий смысл, просто одна компания купила другую).
Процесс секвенирования Illumina проиллюстрирован на рисунке; кроме того, можно посмотреть один из нескольких существующих видеороликов с анимацией этого процесса – в данном случае, действительно, лучше один раз увидеть, чем сто раз прочесть текст. Однако краткие комментарии тоже пригодятся; вот как происходит процесс секвенирования по методу Illumina.
В результате на каждом цикле мы прочитываем одновременно очень большое число нуклеотидов из разных последовательностей. Но за это приходится платить тем, что участки ДНК, которые мы можем прочесть, оказываются гораздо короче, чем в случае секвенирования по Сэнгеру – риды Illumina обычно получаются длиной около 100 нуклеотидов.
Парные риды и постановка задачи
Есть ещё одна важная деталь. Участки ДНК «присасываются» к подложке обоими концами, причём мы можем узнать, какие последовательности соответствуют одному и тому же участку. Это значит, что в реальности мы читаем один и тот же участок, длина которого нам приблизительно известна, сразу с двух сторон. В результате данные получаются примерно такого вида:
причём расстояние между известными строчками (число вопросительных знаков) известно не совсем точно. В зависимости от технологии, можно получить как очень длинные неизвестные фрагменты (около 1000 нуклеотидов), «обрамлённые» двумя ридами длины 100, так и короткие фрагменты, в которых неизвестны буквально два-три десятка нуклеотидов между ридами. И те, и другие могут очень помочь в сборке, и об этом мы тоже будем говорить в следующих сериях.
Итак, теперь мы можем формально поставить задачу сборки геномов. Она звучит так: по большому числу подстрок небольшой длины восстановить исходную длинную строку в алфавите из букв A, C, G, T. В случае секвенирования по методу Illumina – по большому числу пар коротких подстрок, разделённых в исходной строке приблизительно известным расстоянием. Поставив эту задачу, мы можем забыть про биологию, химию и медицину – перед нами чисто алгоритмическая задача. Однако, прежде чем перейти к математике, сделаем ещё несколько замечаний.
Ошибки и показатели качества в секвенаторах второго поколения
Как мы уже знаем, секвенирование всегда содержит ошибки. В секвенаторах Illumina и аналогичных ошибки, как правило, происходят на фазе, когда нужно распознать помеченные нуклеотиды, т.е. понять, каким цветом и с какой силой светятся кластеры из многократно клонированных участков ДНК. На рисунке – типичный пример такой фотографии, порождённой секвенатором Illumina.

Рисунок с сайта medicine.yale.edu
Проблема здесь заключается в том, что из-за неидеальности остальных этапов процесса кластеры никогда не светятся только одним цветом; это всегда смесь всех четырёх цветов с той или иной интенсивностью. Нужно выделить наиболее интенсивную компоненту и оценить, насколько вероятна ошибка в этой букве; эта задача называется base calling (распознавание нуклеотидов). Base calling – это целая наука, в подробности которой мы сейчас вдаваться не будем.
Для нас сейчас важно, что в результате каждому нуклеотиду каждого рида секвенатор ставит в соответствие вероятность того, что этот нуклеотид был распознан правильно. Эти вероятности тоже можно использовать при сборке, и секвенаторы выдают их вместе с собственно ридами.
В итоге типичный рид в так называемом fastq-формате, стандартном для секвенаторов второго поколения, выглядит примерно так:
@EAS20_8_6_1_3_25/1
GCAAAAAACTTACCCCGGAACAGGCCGAGCAGATCAAAACGCTACTGCAATACAGACCATCAAGCACCAACTCCCNNNCGTAGNNNNNNTATGTTNNNNG
+EAS20_8_6_1_3_25/1
HHHHHHHGHHHHHHHHHHHHHHHHHHHHEHHHHHHHHEGHHHHGHHGHEFD?A=A&FFBB>&::===@&@E@E>A#########################
Первая и третья строки содержат имя рида; вторая строка – сама последовательность нуклеотидов. Обратим внимание, что среди букв A, C, G, T встречаются и буквы N – это значит, что секвенатор не смог однозначно определить, какой здесь был нуклеотид, и сдался. А четвёртая строка кодирует, в логарифмическом масштабе, вероятности того, что тот или иной нуклеотид распознан правильно; например, H здесь соответствует вероятности ошибки около одной десятитысячной. Как правило, качество ухудшается к концу рида; в нашем примере, как видите, хвост рида и вовсе не удалось сколь-нибудь надёжно прочитать.
Другие методы секвенирования
Хотя мы подробнее всего рассмотрели секвенатор Illumina (Solexa), на самом деле на этом методе свет клином не сошёлся. Есть и другие секвенаторы второго поколения, с другими свойствами.
В секвенировании лигированием (sequencing by ligation) на фазе, когда уже нужно распознавать нуклеотиды, используют не ДНК-полимеразу и процесс репликации, а специальные короткие «зонды», которые присоединяются к комплементарным нуклеотидам, фиксируются, затем вымываются, и процесс повторяется снова. Так устроен секвенатор SOLiD от Applied Biosystems.
Пиросеквенирование (pyrosequencing) основано на хемилюминесцентных сигналах, которые подают специально модифицированные нуклеотиды, когда соединяются с комплементарным нуклеотидом в прочитываемой нити ДНК; на этом принципе работает, например, секвенатор 454 от 454 Life Sciences.
Принцип работы секвенатора PacBio (от Pacific Biosciences) очень похож на принцип работы Illumina, но у него по-другому устроен метод детектирования – специальные «решётки» позволяют уловить сигналы от отдельных молекул (метод получил название SMRT, single molecule real time sequencing). Это позволяет ускорить процесс, уместить больше ридов на одной подложке (нужно меньше клонировать ДНК, не нужно выращивать большие кластеры) и существенно увеличить длину надёжно прочитываемых ридов.
Недавно появившийся метод ионного полупроводникового секвенирования (на нём основан секвенатор IonTorrent) вместо всего этого просто детектирует соединения (ионы), которые выделяются при присоединении нового нуклеотида к нити ДНК. Это позволяет радикально сократить время и стоимость получаемых ридов, хотя процент ошибок становится больше, и больше становится ошибок в фрагментах из повторяющейся одной буквы.
Человеческая мысль не стоит на месте: методы секвенирования постоянно улучшаются. Однако практически все современные методы выдают относительно короткие риды, от 100 до 400 нуклеотидов; в этом цикле мы будем в основном говорить о том, как собирать именно короткие риды.
Sanger или Illumina?
Человеческий геном был впервые собран на сэнгеровских секвенаторах, причём алгоритмическая сторона того проекта была проработана гораздо меньше, чем сейчас, десять лет спустя. Алгоритмы, которыми собирали первый человеческий геном, значительно проще тех, о которых мы будем говорить в дальнейшем. Однако первый геном всё-таки собрали; может быть, весь алгоритмический прогресс – это никому не нужный миф, и вполне хватило бы старых программ?
Невероятно, но факт: «старые» секвенаторы (первого поколения, сэнгеровские) выдают значительно более подходящие для сборки данные, чем «новые» (второго поколения). Это в основном выражается в длине ридов (reads), тех участков ДНК, которые удаётся последовательно прочесть, и которые, собственно, и нужно собрать в одну большую строчку. Секвенаторы первого поколения выдавали риды длиной более пятисот нуклеотидов, обычно около тысячи. Современные секвенаторы выдают пары ридов, каждый из которых имеет длину около ста нуклеотидов.
На таком уровне становится важной и цена алгоритмической стороны вопроса. Чтобы сборка геномов не занимала дольше и не стоила дороже, чем само их секвенирование, нужно разработать очень быстрые алгоритмы для решения задачи сборки. Об этом пойдет речь в следующей статье.
Секвенирование генома. С чего все начиналось?
Предпосылками для формирования генетики как самостоятельной научной области послужило открытие законов Менделя. В дальнейшем в XX веке было сделано четыре открытия, положивших начало развитию генетики [1]:
• установлены клеточные основы наследственности — хромосомы;
• определена молекулярная основа наследственности — двойная спираль ДНК;
• открыта информационная основа наследственности, а также биологический механизм, с помощью которого клетки считывают информацию, содержащуюся в генах;
• изобретены технологии клонирования и секвенирования рекомбинантных ДНК.
Последняя четверть прошлого века была отмечена неустанным стремлением расшифровать сначала гены, а затем и целые геномы [2].
Первая рабочая концепция секвенирования — метод Сэнгера, также известный как метод обрыва цепи, — была предложена в 1977 году. За это открытие Фредерик Сэнгер был удостоен Нобелевской премии по химии в 1980 году. Этот метод секвенирования применялся в течение 40 лет, а его усовершенствование и коммерциализация привели к широкому распространению секвенирования [2].
Описание метода Сэнгера
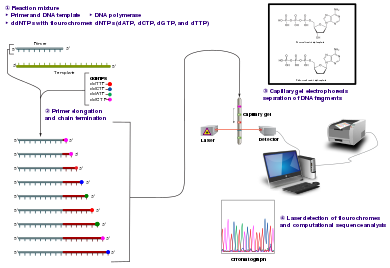
Секвенирование Сэнгера — метод, при котором используются олигонуклеотидные праймеры для поиска определенных областей ДНК. Этот процесс начинается с деспирализации двухцепочечной ДНК [5]. Одна цепочка ДНК является матрицей для синтеза комплементарной цепочки при помощи фермента ДНК-полимеразы. Реакцию с одной и той же цепочкой проводят в четырех разных пробирках, каждая из которых содержит [3]:
— праймер;
— четыре дезоксинуклеотида (дезоксиаденозинтрифосфат, дезоксигуанозинтрифосфат, дезоксицитидинтрифосфат и тимидинтрифосфат);
— небольшое количество (1 к 100) одного из радиоактивно меченных дезоксинуклеотидов (для визуализации продуктов реакции).
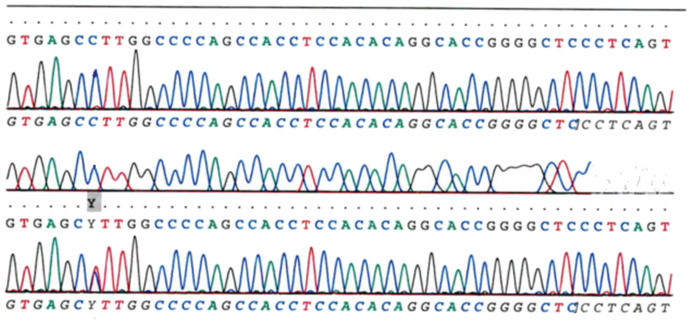
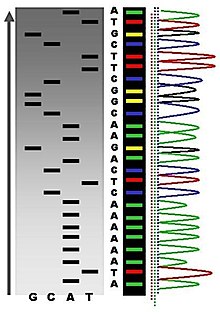
В каждой пробирке образуется набор фрагментов ДНК разной длины, заканчивающихся одним и тем же нуклеотидом. После завершения реакции содержимое пробирок разделяют электрофорезом в полиакриламидном геле в денатурирующих условиях и затем проводят авторадиографию гелей. Каждый дезоксинуклеотид отмечен флуоресцентным маркером: A — зеленый цвет, T — красный, G — черный и C — синий. Лазер в автомате, используемый для считывания последовательности, фиксирует интенсивность флуоресценции. Когда в последовательности встречается гетерозиготный вариант, локусы захватываются двумя флуоресцентными красителями одинаковой интенсивности. Если присутствует гомозиготный вариант, ожидаемый флуоресцентный цвет заменяется цветом комплементарного основания [5].
Продукты четырех реакций формируют «секвенирующую лестницу», которая позволяет «прочитать» нуклеотидную последовательность фрагмента ДНК. Метод Сэнгера позволяет также определять нуклеотидную последовательность РНК, но она предварительно должна быть «переписана» в формат ДНК с помощью обратной транскрипции [3].
Секвенирование Сэнгера — это надежный метод для определения генных мутаций, который широко использовался в течение нескольких десятилетий. Метод Сэнгера является геноспецифичным, и с его помощью анализируют небольшое подмножество генов. Секвенирование Сэнгера позволяет идентифицировать мозаичные мутации. Но метод секвенирования Сэнгера не позволяет проводить точную количественную оценку, то есть нельзя сделать вывод о том, в каком количестве клеток есть мутация [5].
Метод дробовика
Метод дробовика используется для секвенирования длинных участков ДНК. Суть метода состоит в получении случайной массированной выборки клонированных фрагментов ДНК данного организма, на основе которых восстанавливается исходная последовательность ДНК [6].
Первые методы секвенирования способны восстанавливать небольшие последовательности ДНК (порядка 1000 нуклеотидов), следовательно, для секвенирования более длинных последовательностей требовалось разработать новый подход. При секвенировании методом дробовика ДНК случайным образом фрагментируется на мелкие участки с помощью сайт-неспецифичных нуклеаз. Затем фрагменты секвенируют любым доступным методом, например, методом секвенирования по Сэнгеру. Полученные перекрывающиеся случайные фрагменты ДНК собирают с помощью специального программного обеспечения в одну целую последовательность. Данный метод оставался фундаментальным методом секвенирования генома в течение 20 лет [2]. В 1981 году метод применен на практике — полное секвенирование генома вируса мозаики цветной капусты [7].
На практике трудности возникают из-за повторяющихся последовательностей. Например, можно легко секвенировать типичные бактериальные геномы (около 1,5 % повторов) или эухроматическую часть генома мухи (около 3 % повторов). Человеческий геном содержит более чем 50 % повторяющихся последовательностей. Такие особенности усложняют сборку правильной и законченной последовательности генома [2].
В дальнейшем этот подход совершенствовался: были улучшены механизмы фрагментации и клонирования ДНК. В 1990 году был предложен метод секвенирования парных прочтений. Результаты первого применения метода секвенирования парных концов на практике были опубликованы в 1990 году в работе, посвященной секвенированию человеческого гена гипоксантин-гуанинфосфорибозилтрансферазы [4].
При секвенировании парных прочтений ДНК разрезается на случайные фрагменты, которые затем группируются по весу и клонируются в векторах. Клоны секвенируют с обоих концов с использованием метода обрыва цепи, в результате которого образуются две коротких последовательности [4].
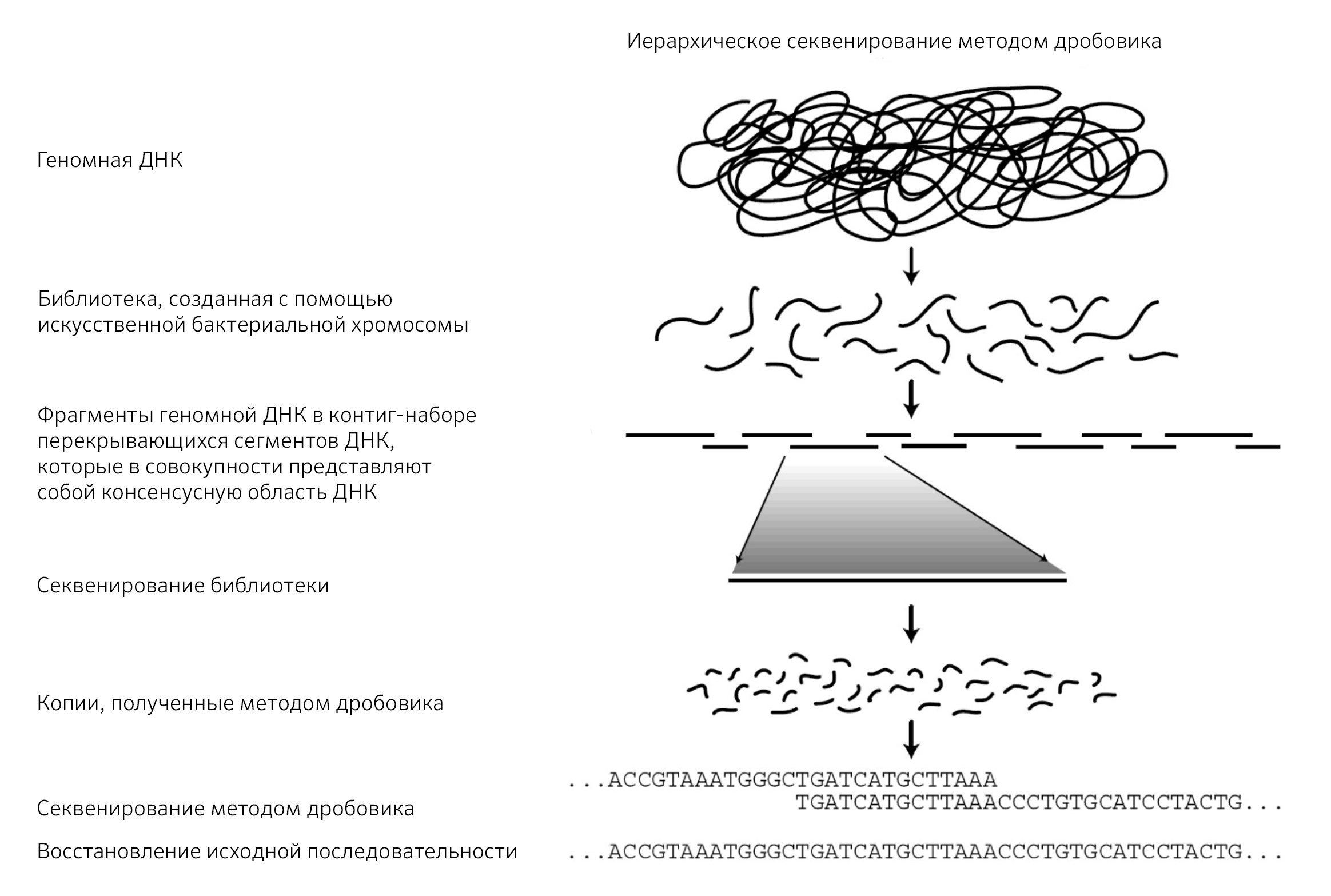
Иерархическое секвенирование методом дробовика
Для секвенирования больших геномов, содержащих повторяющиеся последовательности, используется подход «иерархического секвенирования методом дробовика» [2].
Данный метод — технически более сложный из-за необходимости обработки больших объемов данных. Это служит причиной тому, что метод иерархического секвенирования имеет более высокую стоимость [2].
Переломной точкой развития методов секвенирования стало появление и широкое распространение технологий ПЦР, автоматизация этапов «чтения» ДНК, совершенствование программного обеспечения. Все это дало начало созданию методов секвенирования следующего поколения. Секвенаторы нового поколения значительно дешевле и гораздо эффективнее своих предшественников. На сегодняшний день производительность некоторых секвенаторов измеряется уже сотнями миллиардов пар оснований, что, например, позволяет подобным приборам сканировать индивидуальный геном человека всего за несколько дней.
Источники:
СОДЕРЖАНИЕ
Метод
На изображении справа рентгеновская пленка подвергалась воздействию геля, а темные полосы соответствуют фрагментам ДНК разной длины. Темная полоса на дорожке указывает на фрагмент ДНК, который является результатом обрыва цепи после включения дидезоксинуклеотида (ddATP, ddGTP, ddCTP или ddTTP). Затем относительные положения различных полос на четырех дорожках снизу вверх используются для считывания последовательности ДНК.
Технические варианты секвенирования с окончанием цепи включают мечение нуклеотидами, содержащими радиоактивный фосфор, для нанесения радиоактивной метки или использование праймера, меченного на 5′-конце флуоресцентным красителем. Секвенирование красителей и праймеров облегчает считывание в оптической системе для более быстрого и экономичного анализа и автоматизации. Более поздняя разработка Leroy Hood и соавторов флуоресцентно меченных ddNTP и праймеров заложила основу для автоматизированного высокопроизводительного секвенирования ДНК.
Методы обрыва цепи значительно упростили секвенирование ДНК. Например, коммерчески доступны наборы на основе обрыва цепи, которые содержат реагенты, необходимые для секвенирования, предварительно разделенные на аликвоты и готовые к использованию. Ограничения включают неспецифическое связывание праймера с ДНК, влияющее на точное считывание последовательности ДНК, и вторичные структуры ДНК, влияющие на точность последовательности.
Секвенирование красителя-терминатора
Из-за большей целесообразности и скорости секвенирование терминатора красителя в настоящее время является основой автоматизированного секвенирования. Его ограничения включают эффекты красителя из-за различий во включении меченных красителем терминаторов цепи во фрагмент ДНК, что приводит к неравным высотам и формам пиков на электронной хроматограмме следа последовательности ДНК после капиллярного электрофореза (см. Рисунок слева).
Автоматизация и подготовка проб
Вызовы
Общие проблемы секвенирования ДНК с помощью метода Сэнгера включают низкое качество первых 15-40 оснований последовательности из-за связывания праймеров и ухудшение качества следов секвенирования после 700-900 оснований. Программное обеспечение для вызова базы, такое как Phred, обычно обеспечивает оценку качества, чтобы помочь в обрезке низкокачественных областей последовательностей.
Современные методы позволяют непосредственно секвенировать только относительно короткие ( длиной 300-1000 нуклеотидов ) фрагменты ДНК за одну реакцию. Основным препятствием для секвенирования фрагментов ДНК, превышающих этот предел размера, является недостаточная способность разделения для разделения больших фрагментов ДНК, которые отличаются по длине только на один нуклеотид.
Микрофлюидное секвенирование по Сэнгеру
В настоящее время высокопроизводительное секвенирование генома включает фрагментирование генома на небольшие одноцепочечные части с последующей амплификацией фрагментов с помощью полимеразной цепной реакции (ПЦР). Приняв метод Сэнгера, каждый фрагмент ДНК необратимо обрывается с включением флуоресцентно меченного дидезокси-цепи нуклеотида, обрывающего цепь, тем самым образуя «лестницу» ДНК из фрагментов, каждый из которых отличается по длине на одно основание и несет специфичную для основания флуоресцентную метку на терминальная база. Затем амплифицированные лестницы оснований разделяют электрофорезом на капиллярной матрице (CAE) с автоматическим in situ «финишным» обнаружением флуоресцентно меченных фрагментов оцДНК, что обеспечивает упорядоченную последовательность фрагментов. Эти считывания последовательностей затем собираются компьютером в перекрывающиеся или смежные последовательности (называемые «контиги»), которые напоминают полную геномную последовательность после полной сборки.
Методы Сэнгера позволяют получить длину считывания примерно 800 пар оснований (обычно 500-600 пар оснований для необогащенной ДНК). Большая длина считывания в методах Сэнгера демонстрирует значительные преимущества перед другими методами секвенирования, особенно с точки зрения секвенирования повторяющихся областей генома. Проблема данных коротко-считываемых последовательностей особенно актуальна при секвенировании новых геномов (de novo) и при секвенировании сильно перестроенных сегментов генома, обычно тех, которые наблюдаются в геномах рака или в областях хромосом, которые демонстрируют структурные вариации.
Применение технологий микрофлюидного секвенирования
Другие полезные приложения секвенирования ДНК включают в себя полиморфизм единичного нуклеотида обнаружения (СНП), однонитевой конформационный полиморфизм (SSCP) гетеродуплексный анализ и короткий тандемный повтор анализ (STR). Разрешение фрагментов ДНК в соответствии с различиями в размере и / или конформации является наиболее важным шагом в изучении этих особенностей генома.
Дизайн устройства
Чип секвенирования имеет четырехслойную конструкцию, состоящую из трех стеклянных пластин диаметром 100 мм (на которых микропроизводятся элементы устройства) и полидиметилсилоксановой (PDMS) мембраны. Реакционные камеры и каналы капиллярного электрофореза протравлены между двумя верхними стеклянными пластинами, которые термически связаны. Трехмерные межсоединения каналов и микроклапаны образованы ПДМС и стеклянной пластиной нижнего коллектора.
Устройство состоит из трех функциональных блоков, каждый из которых соответствует этапам секвенирования по Сэнгеру. Блок термоциклирования (TC) представляет собой реакционную камеру емкостью 250 нанолитров со встроенным резистивным датчиком температуры, микроклапанами и поверхностным нагревателем. Движение реагента между верхним цельностеклянным слоем и нижним слоем стекло-PDMS происходит через сквозные отверстия диаметром 500 мкм. После термоциклирования реакционная смесь проходит очистку в камере улавливания / очистки, а затем вводится в камеру капиллярного электрофореза (CE). Блок CE состоит из 30-сантиметрового капилляра, который свернут в компактную форму обратной связи с помощью витков шириной 65 мкм.
Секвенирование химии
Платформы
Платформа Apollo 100 (Microchip Biotechnologies Inc., Дублин, Калифорния) объединяет первые два этапа секвенирования по Сэнгеру (термоциклирование и очистка) в полностью автоматизированной системе. Производитель заявляет, что образцы готовы к капиллярному электрофорезу в течение трех часов после загрузки образца и реагентов в систему. Платформа Apollo 100 требует субмикролитровых объемов реагентов.
 Геномика: постановка задачи и методы секвенирования
Геномика: постановка задачи и методы секвенирования