Что такое сидеропенический синдром
Анемия: причины,симптомы и лечение.
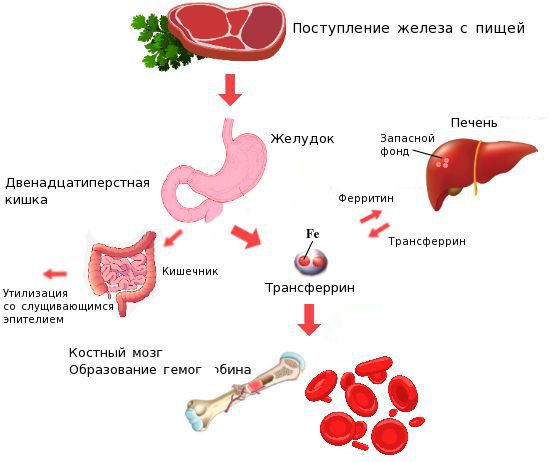
Всасывание железа
Ежедневная потребность организма в железе у женщин 1,5-2 мг. В желудочно-кишечном тракте у здорового человека всасывается только 10% от общего количества железа, съеденного с пищей (1–2 мг). Улучшают всасывание железа: аскорбиновая кислота, фруктоза, цитраты, содержащиеся в свежих фруктовых соках, бананах, красных бобах, цветной капусте. Уменьшают всасывание железа из пищи: фосфаты, дубящие вещества, комплексные полисахариды, полифенолы, оксалаты, содержащиеся в крупах, яйцах, сыре, чай. Действие чая, содержащего танин, особенно поразительно: при его употреблении усвоение железа шестикратно снижается (до 2%).
В пищевых продуктах содержится 2 типа железа — гемовое (органическое) и негемовое (неорганическое). Наиболее полно всасывается гемовое железо. Такое железо содержится в нежирных сортах мяса, рыбы, птицы. Поглощение железа из продуктов животного происхождения варьирует от 6% до 22%, в то время как из растительной пищи усваивается около 1% железа. Подавляют всасывание железа жиры (сало, масло сливочное и растительное), соевый протеин, кофе, молочные продукты.
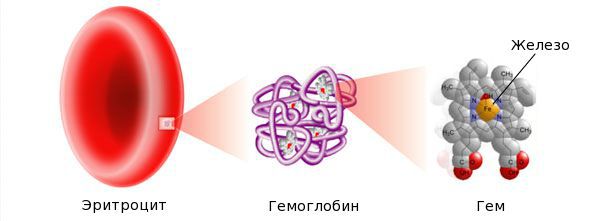
В организме человека содержится около 3-4 г железа, из которых 70% – жизненно необходимое, активное, 30% – депонированное в тканях и 0,1% – транспортное. Основная масса железа сконцентрирована в гемоглобине (около 1500-3000 мг). В депо (ферритин и гемосидерин внутренних органов) находится от 500 до 1500 мг, в миоглобине и различных дыхательных ферментах – не более 500 мг.
Причины дефицита железа:
1.Повышенная потребность организма в железе при беременности
За период беременности организм женщины тратит более 1000 мг железа.Потребность женщины в железе во время беременности может достигать 15-18 мг/сут, в то время как вне беременности ежедневная потребность составляет около 2 мг. Это приводит к уменьшению депонированного железа у всех женщин к концу беременности.
Для восстановления запасов железа, расходуемого в течение беременности, родов и грудного вскармливания, требуется не менее 2-3 лет.
2.Алиментарный дефицит железа.
Этот вид дефицита железа встречается при недостаточном его поступлении с продуктами питания: вегетарианство, увлечение диетами с низким содержанием животных белков.
При беременности вегетарианская диета недопустима.
4. Особенности течения беременности на ранних сроках
Этот вид анемии обусловлен снижением зоны всасывания железа при гастритах, дуоденитах, энтеритах, резекции желудка и обширных участков тонкой кишки.
Осложнения беременности при железодефицитной анемии
Анемия беременных является патологическим фоном, который способствует развитию целого ряда осложнений беременности и родов.
Проявления железодефицитной анемии
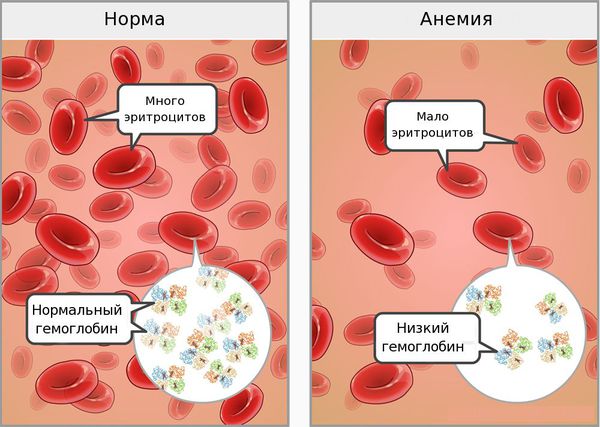
Проявления анемии складываются из 2 основных синдромов: сидеропенического и общеанемического.
Сидеропенический синдром проявляется:
Общеанемический синдром проявляется при снижении уровня гемоглобина и эритроцитов.
Его проявления:
Диета при железодефицитных состояниях
Необходимо помнить о том, что восполнение дефицита железа с помощью диетотерапии невозможно, хотя при установлении железодефицитного состояния следует соблюдать четкие рекомендации по питанию, как одного из компонентов комплексной терапии анемии.
При составлении рациона необходимо учитывать не общее содержание железа в продуктах питания, а его форму, которая определяет его всасывание. Так, абсорбция железа из мясных продуктов (содержащих гемовое железо), составляет 17-22%, из растительных продуктов (негемовое железо) – только 2-3%.
Необходимо учитывать содержание железа в продуктах питания.
Железодефицитная анемия: современное состояние проблемы
В.Ю. Сельчук, С.С. Чистяков, Б.О. Толокнов, Л.В. Манзюк, мгмсу М.П. Никулин, Т.В. Юрьева, П.В. Кононец, Г.В. Титова
МГМСУ
Всасывание железа осуществляется преимущественно в двенадцатиперстной кишке и верхних отделах тощей кишки. Степень всасывания железа зависит от потребности организма в нем. При выраженном дефиците железа всасывание его может происходить и в остальных отделах тонкого кишечника. При уменьшении потребности организма в железе происходит снижение скорости поступления его в плазму крови и увеличивается отложение в энтероцитах в виде ферритина, который элиминируется при физиологическом слущивании эпителиальных клеток кишечника. В крови железо циркулирует в комплексе с плазменным трансферрином. Этот белок синтезируется преимущественно в печени. Трансферрин захватывает железо из энтероцитов, а также из депо в печени и селезенке и переносит его к рецепторам на эритрокариоцитах костного мозга. В норме трансферрин насыщен железом приблизительно на 30%. Комплекс трансферрин-железо взаимодействует со специфическими рецепторами на мембране эритрокариоцитов и ретикулоцитов костного мозга, после чего путем эндоцитоза проникает в клетки, и железо переносится в их митохондрии, где включается в протопорфирин и таким образом участвует в образовании гема. Освободившийся от железа трансферрин неоднократно участвует в переносе железа. Количество железа, которое расходуется на эритропоэз, составляет 25 мг/сут., что значительно превышает возможности всасывания железа в кишечнике. В связи с этим для гемопоэза постоянно используется железо, освобождающееся при распаде эритроцитов в селезенке. Хранение (депонирование) железа осуществляется в депо в составе белков ферритина и гемосидерина.
Хотя среди взрослого населения анемия чаще всего развивалась у женщин во время беременности, тем не менее в популяции основную долю пациентов с анемией составляли небеременные женщины репродуктивного возраста (468 млн человек). По крайней мере в половине случаев причиной анемии служит дефицит железа [WHO, 2001], который может быть следствием хронической кровопотери (менструации, оккультные кровотечения при опухолях желудочно-кишечного тракта (ЖКТ), неспецифические и специфические воспалительные заболевания тонкой и толстой кишки, другие причины), недостаточного поступления железа с пищей или нарушения его усвояемости (например, при хроническом алкоголизме), повышенной потребности (детский и подростковый возраст, беременность, послеродовый период), нарушения всасывания.
В соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10) учитывают следующие формы анемий, связанных с абсолютным и относительным дефицитом железа:
Классификация, клиника и диагностика ЖДА
Общепризнанной классификации ЖДА не существует. Имеются клиническая классификация ЖДА и классификация по стадиям и тяжести протекания анемии.
Клиническая классификация ЖДА:
ЖДА также классифицируют по стадиям и тяжести протекания.
По степени тяжести:
Анемический синдром обусловлен снижением содержания гемоглобина и уменьшением количества эритроцитов, недостаточным обеспечением тканей кислородом и представлен неспецифическими симптомами. Больные жалуются на общую слабость, повышенную утомляемость, снижение работоспособности, головокружение, шум в ушах, мелькание мушек перед глазами, сердцебиения, одышку при физической нагрузке, появление обморочных состояний. Может появляться снижение умственной работоспособности, ухудшение памяти, сонливость. Субъективные проявления анемического синдрома вначале беспокоят больных при физической нагрузке, а затем и в покое (по мере развития анемии).
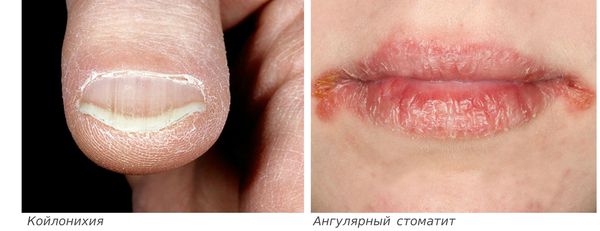
Сидеропенический синдром (синдром гипосидероза) обусловлен тканевым дефицитом железа, что приводит к снижению активности многих ферментов (цитохромоксидаза, пероксидаза, сукцинат-дегидрогеназа и др.). Сидеропенический синдром проявляется многочисленными симптомами, такими как:
Лабораторные данные
Диагностика латентного дефицита железа
Латентный дефицит железа диагностируется на основании следующих признаков:
Диагностика ЖДА
При снижении содержания гемоглобинового железа появляются характерные для ЖДА изменения общего анализа крови:
Наиболее часто используемыми в практике критериями ЖДА являются:
— низкий цветовой показатель;
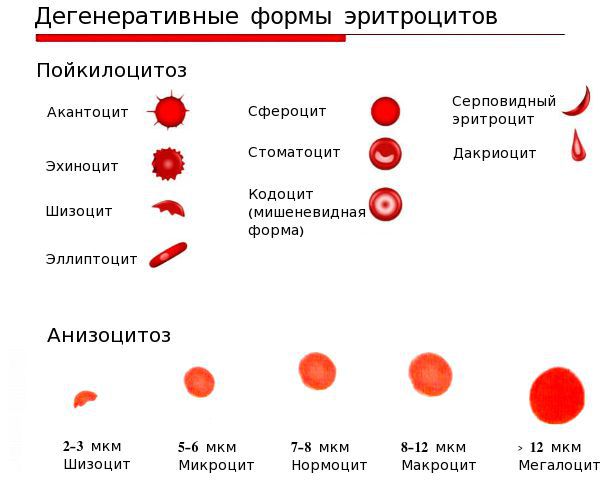
— гипохромия эритроцитов, микроцитоз;
— снижение уровня сывороточного железа;
— повышение ОЖСС;
— снижение содержания ферритина в сыворотке.
При биохимическом исследовании крови, кроме снижения уровня сывороточного железа и ферритина, выявляются также изменения, обусловленные основным онкологическим или другим заболеванием.
Лечение
В настоящее время существует следующие этапы лечения ЖДА:
Не так давно гемотрансфузия являлась одним из самых распространенных способов коррекции анемии даже легкой степени у больных после операционной кровопотери и кровопотери при других клинических ситуациях (роды, маточные кровотечения, геморрой, опухоли ЖКТ и др.). Считалось, что надо остановить кровотечение и перелить донорскую кровь или эритроцитную массу. Необходимое для переливания количество эритроцитов определяли исходя из объема кровопотери и уровня гемоглобина. Однако ориентация на достижение нормального уровня гемоглобина иногда приводила к переливанию значительных количеств (до 5-6 л) донорской крови, что сопровождалось развитием синдрома массивной трансфузии, рецидивом кровотечения, появлением признаков полиорганной недостаточности с высокой смертностью.
Лечебная программа при ЖДА включает:
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). В целом ряде случаев радикальное устранение причины ЖДА не представляется возможным, например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных и в некоторых других ситуациях. В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
Путь введения препарата больному ЖДА определяется конкретной клинической ситуацией. При проведении купирующей терапии применяются пероральное и парентеральное введение препаратов железа (ПЖ) больному.
Основными принципами лечения ПЖ для приема внутрь являются следующие:
— назначение ПЖ с достаточным содержанием трехвалентного железа;
— нецелесообразность одновременного назначения витаминов группы В (в том числе В12), фолиевой кислоты без специальных показаний;
— избегание назначения ПЖ внутрь при наличии признаков нарушения всасывания в кишечнике;
— достаточная продолжительность насыщающего курса терапии (не менее 3-5 мес.);
— необходимость проведения поддерживающей терапии ПЖ после нормализации показателей гемоглобина в соответствующих ситуациях.
Для адекватного прироста показателей гемоглобина у больных необходимо назначать от 100 до 300 мг трехвалентного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Индивидуальные колебания в количестве необходимого железа обусловлены степенью его дефицита в организме, истощения запасов, скоростью эритропоэза, всасываемостью, переносимостью и некоторыми другими факторами. С учетом этого при выборе лекарственного ПЖ следует ориентироваться не только на содержание в нем общего количества, но и, главным образом, на количество трехвалентного железа, которое только и всасывается в кишечнике.
Причины неэффективности терапии ПЖ для приема внутрь:
— отсутствие дефицита железа (неправильная трактовка природы гипохромной анемии и ошибочное назначение ПЖ);
— недостаточная дозировка ПЖ (недоучет количества трехвалентного железа в препарате);
— недостаточная длительность лечения ПЖ;
— нарушение всасывания ПЖ, назначаемых внутрь больным с соответствующей патологией;
— одновременный прием препаратов, нарушающих всасывание железа;
— наличие хронических (оккультных) кровопотерь, чаще всего из органов ЖКТ;
— сочетание ЖДА с другими анемическими синдромами (В12-дефицитной, фолиеводефицитной).
— нарушение всасывания при патологии кишечника (энтериты, синдром недостаточности всасывания, резекция тонкого кишечника, резекция желудка по методу Бильрот II с выключением двенадцатиперстной кишки);
— обострение язвенной болезни желудка или двенадцатиперстной кишки;
— непереносимость ПЖ для приема внутрь, не позволяющая дальнейшее продолжение лечения;
— необходимость более быстрого насыщения организма железом, например, у больных ЖДА, которым предстоят оперативные вмешательства (миома матки, геморрой и др.).
В отличие от ПЖ для приема внутрь в инъекционных препаратах железо всегда находится в трехвалентной форме. Лечение больных с ЖДА имеет свои особенности в зависимости от конкретной клинической ситуации с учетом многих факторов, в том числе характера основного заболевания и сопутствующей патологии, возраста больных (дети, пожилые люди), выраженности анемического синдрома, дефицита железа, переносимости ПЖ и др. Общая ориентировочная доза ПЖ для внутримышечного введения, необходимая для коррекции дефицита железа и анемии, может быть рассчитана по формуле:
При парентеральном введении ПЖ возможны развитие флебитов, инфильтратов, потемнение кожи в местах инъекций, аллергических реакций, в том числе тяжелых (анафилактический шок). Внутримышечные инъекции болезненны, в некоторых случаях они ассоциировались с развитием саркомы ягодичной мышцы [Grasso P, 1973; Greenberg G., 1976]. По мнению некоторых авторов [Auerbach M. et al., 2007], от внутримышечного введения ПЖ следует отказаться.
В последнее время особенно большой интерес вызывают ПЖ для внутривенного введения с целью терапии постгеморрагических анемий. В нескольких работах показано, что внутривенное введение ПЖ более эффективно при сравнении с приемом железа внутрь при тех же показаниях. Помимо этого, внутривенная терапия позволяет избежать возникновения как побочных эффектов со стороны ЖКТ, наблюдающихся при приеме ПЖ внутрь, так и некоторых осложнений, вызываемых при внутримышечном введении ПЖ, однако требует определенного уровня реанимационной службы учреждения, в котором вводятся препараты.
ПЖ для внутривенного введения
Для внутривенного введения в России применяют карбоксимальтозат железа (Феринжект®), сахарат железа (Венофер), глюконат железа и декстран железа, которые представляют собой сферические железоуглеводные коллоиды. Углеводная оболочка придает комплексу стабильность, замедляет высвобождение железа и поддерживает образующиеся формы в коллоидной суспензии.
Внутривенное введение декстрана железа вызывает большое число анафилактических реакций, сопровождающихся летальностью в 13,5% случаев [Faich G. еt Strobos J., 1999], и в настоящее время применяется ограниченно. Применение натриевого комплекса глюконата железа в сукрозе вызывает значительно меньше осложнений и, как правило, не сопровождается смертельными исходами. Однако токсические эффекты, связанные с поступлением свободного железа в организм, существенно ограничивают применение препарата в ежедневной практике терапии ЖДА.
Сахарат железа (III) (Венофер®) является популярным препаратом для лечения синдрома ЖДА. Это связано с безопасностью и высокой переносимостью комплекса трехвалентного железа с сахаратом в отличие от декстрана железа и глюконата железа. Данный препарат одобрен для применения, в том числе и в период беременности. Венофер следует вводить только в учреждениях, располагающих оборудованием для сердечно-легочной реанимации, так как часто могут отмечаться сердечно-сосудистые осложнения в виде гипотонии. Максимальная разовая парентеральная доза сахарата железа (III) составляет 500 мг, предпочтительно развести препарат в 100 мл 0,9% раствора NaCl для введения в форме инфузии. Продолжительность инфузии составляет приблизительно 4,5 ч с использованием внутривенного доступа (следует помнить, что высокая скорость инфузии связана с риском развития гипотензивной реакции). В зависимости от исходных значений уровня гемоглобина внутривенное введение повторяют 1-3 раза/нед. до повышения уровня гемоглобина >105 г/л. Затем пациента можно перевести на прием пероральных ПЖ для поддерживающей терапии. Оснований ожидать возможной передозировки железом не имеется.
Эффективность и безопасность внутривенного введения ПЖ зависят от их молекулярной массы, стабильности и состава. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей. Значительная часть дозы подобных препаратов выводится через почки в первые 4 ч после приема и не используется для эритропоэза. Хотя декстран железа обладает высокими молекулярной массой и стабильностью, его недостатком является повышенный риск развития аллергических реакций. Карбоксимальтозат железа сочетает в себе положительные свойства высокомолекулярных комплексов железа, но не вызывает реакции гиперчувствительности, наблюдающиеся при применении препаратов, содержащих декстран, и, в отличие от сахарата и глюконата железа, может вводиться в более высокой дозе [Geisser P., 2009]. Схема оценки риска токсических эффектов и анафилактических реакций препаратов свободного железа для внутривенного введения представлена на рисунке 1 [С.В. Моисеев, 2012].
Рис. 1. Риск токсических эффектов и анафилактических реакций при применении внутривенных препаратов железа
Применение карбоксимальтозата железа позволяет вводить за 1 инфузию до 1000 мг железа (внутривенно капельно в течение 15 мин.), в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 4,5 ч, а длительность инфузии декстрана железа достигает 6 ч. Причем в двух последних случаях перед началом инфузии необходимо ввести тестовую дозу препарата. Введение большой дозы железа позволяет сократить необходимое число инфузий и затраты на лечение. Карбоксимальтозат железа отличается не только удобством применения, но и низкой токсичностью, а также отсутствием оксидативного стресса, которые определяются медленным и физиологичным высвобождением железа из стабильного комплекса с углеводом, по структуре сходного с ферритином.
Лечение анемии
Железодефицитная анемия ЖДА — это гипохромная микроцитарная анемия, развивающаяся в результате абсолютного дефицита железа в организме.
Помимо анемического синдрома, для нее характерно нарушение функции кожи, ее придатков и слизистых оболочек — сидеропенический синдром.
ЖДА — это последняя стадия дефицита железа; до появления анемии часто при подробном расспросе и осмотре пациента можно обнаружить проявления сидеропении, что позволит своевременно выявить причину дефицита железа и предотвратить развитие ЖДА.
Эпидемиология
Впервые ЖДА описал немецкий врач Й. Ланге в 1554 г., а препараты для ее лечения впервые применил Т. Сиденгам в XVII в. Анемии, развивающиеся в результате дефицита железа в организме, наиболее широко распространены в клинической практике. По данным ВОЗ, около 2,5 млрд человек на Земле имеют скрытый дефицит железа и 1 млрд человек страдает ЖДА.
Достоверно доказано влияние ЖДА на увеличение частоты материнской и детской смертности. ЖДА встречаются у 12–13 % детей в возрасте от 6 мес. до 2 лет. В развивающихся странах этот показатель значительно выше: в Индии и странах Африки он достигает 72–76 %. В развитых странах Европы и Северной Америки ЖДА выявляется у 7,5–11 % всех женщин детородного возраста, а у 20–25 % наблюдается скрытый тканевой дефицит железа. Значительно большая частота ЖДА в странах Азии, Африки и Латинской Америки, где она достигает эпидемических величин и составляет 45–60 %. Из всех анемий, встречающихся в клинической практике, около 80 % являются железодефицитными. В Российской Федерации сведений по частоте ЖДА нет, однако, по нашим данным, в Москве ее частота составляет 30–35 % среди женщин детородного возраста, а скрытого дефицита железа — до 60 %.
Развитие анемии
Со временем дефицит железа прогрессирует, течет долгие годы латентно, а затем, после полного истощения запасов железа в депо, развивается ЖДА. Основной механизм развития анемии — нарушение гемоглобинообразования в эритрокариоцитах костного мозга. В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого гемоглобинизация эритронормобластов запаздывает по сравнению с процессом обратного развития ядерных структур. Поскольку синтез гемоглобина из-за дефицита железа страдает в большей степени, чем образование эритроцитов, для ЖДА при сравнительно умеренном снижении числа эритроцитов свойственно более выраженное падение содержания в них гемоглобина, что проявляется гипохромией эритроцитов и развитием гипохромной микроцитарной анемии.
Второй патологический механизм, который имеет место в условиях дефицита железа, — это снижение образования других важнейших белков, участвующих в накоплении и транспорте кислорода. Уменьшается содержание миоглобина в поперечнополосатой мускулатуре. Нарушение образования цитохромов и каталаз приводит к угнетению энергетического обмена всех клеток организма, при этом в основном страдают быстро делящиеся ткани (кожа и слизистые оболочки).
В зависимости от причин, вызывающих дефицит железа, выделяется пять групп ЖДА:
1) хронические постгеморрагические ЖДА;
2) ЖДА, связанные с нарушением всасывания и поступления железа с пищей;
3) ЖДА, связанные с недостаточным исходным уровнем железа в организме (чаще у детей);
4) ЖДА, обусловленные повышением потребности организма в железе (без кровопотери);
5) ЖДА, связанные с нарушением транспорта железа.
Стадии дефицита железа
В настоящее время выделяют несколько стадий дефицита железа:
1. Предрасположенность к развитию железодефицита (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических заболеваний ЖКТ или женской репродуктивной системы, связанных с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако можно определить повышение абсорбции 59Fe3+ в ЖКТ, которое может превышать 50 % (в норме 10–15 %).
3. Латентный дефицит железа. Характеризуется развитием сидеропенического синдрома, снижением запасов железа в организме по данным лабораторных исследований.
Лечение анемии
Лечение ЖДА строится на следующих принципах. До начала лечения обязательно следует выявить и по возможности устранить причину развития ЖДА
Для лечения надо использовать только лекарственные железосодержащие препараты. Вне зависимости от тяжести анемии лечение начинается с пероральных препаратов, исключая противопоказания (острая язва желудка и двенадцатиперстной кишки, эрозивный гастрит), невозможность использования пероральных препаратов (нарушение глотания, отсутствие сознания, интубация и др.).
Лечебная доза пероральных препаратов железа составляет 100– 200 мг элементарного железа в сутки (максимально 300 мг), разделенная на 2 приема. Использование парентеральных средств возможно только при доказанном абсолютном дефиците железа, лечение должно проводиться только в стационаре, вводится только расчетная доза препарата. Внутримышечное введение препаратов железа в настоящее время не применяется. Трансфузии эритроцитарной массы обычно не используются. Они показаны только пожилым людям при наличии тяжелой анемии.
Сроки лечения при использовании пероральных препаратов железа зависят от тяжести анемии, составляют 3–4 мес. при использовании препаратов Fe2+ или 4–6 мес. при использовании препаратов Fe3+.
Что такое железодефицитная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Головко О. А., терапевта со стажем в 12 лет.
Определение болезни. Причины заболевания
Основные причины развития ЖДА:
Группы риска по ЖДА:
Симптомы железодефицитной анемии
Сидеропенический синдром связан с недостатком железа в тканях и проявляется нарушениями со стороны кожи и слизистых оболочек:
Анемический синдром проявляется слабостью, быстрой утомляемостью, сонливостью днём и плохим засыпанием ночью, головокружениями, обмороками, частыми головными болями, шумом в ушах, мельканием «мушек» перед глазами, одышкой при физической нагрузке, увеличением частоты сердечных сокращений, неприятными ощущениями в области сердца, пониженным артериальным давлением.
При ЖДА может наблюдаться умеренное повышение температуры тела (до 37,5 ° С), которое исчезает после лечения железосодержащими препаратами.
Зачастую снижение содержания гемоглобина происходит постепенно, при этом многие органы адаптируются к анемии. В связи с этим жалобы больных не всегда соответствуют показателям содержания гемоглобина. Многие пациенты, особенно женщины, свыкаются с неважным самочувствием, приписывая его переутомлению, психическим и физическим перегрузкам.
Патогенез железодефицитной анемии
Железо — жизненно важный для человека микроэлемент, который входит в состав гемоглобина крови, миоглобина мышц, отвечает за транспорт кислорода в организме и протекание многих биохимических реакций.
Железо поступает в организм в виде двухвалентного (мясная пища) и трёхвалентного (растительная пища) ионов. Первый всасывается легко, второй под действием соляной кислоты в желудке должен превратиться в двухвалентный. Далее он поступает в двенадцатиперстную кишку и начальные отделы тощей кишки, затем двухвалентное железо вновь переводится в трёхвалентное. В дальнейшем часть этого железа поступает в депо слизистой оболочки тонкой кишки, а другая всасывается в кровь, где соединяется с трансферрином (белком-переносчиком железа, синтезируемым в печени). Если содержание железа в организме избыточно, то оно задерживается в клетках кишечника и в дальнейшем удаляется из организма вместе со слущивающимся эпителием.
При снижении кислотности в желудке (атрофический гастрит, резекция желудка, приём препаратов, снижающих кислотность, гиповитаминоз С) нарушается ионизация железа в желудке, что ведёт к дальнейшему нарушению всасывания железа и развитию ЖДА. При резекции и хронических заболеваниях кишечника (дуоденит, хронический энтерит, целиакия) нарушается всасывание железа, что опять же приводит к развитию ЖДА.
Ферменты, содержащие железо, принимают участие в синтезе гормонов щитовидной железы и поддержании иммунитета, поэтому при дефиците железа нарушаются защитные и адаптационные силы организма и весь обмен веществ.
Классификация и стадии развития железодефицитной анемии
Выделяют три стадии железодефицитных состояний: прелатентный дефицит железа, латентный дефицит и железодефицитную анемию (ЖДА).
Для прелатентного дефицита железа характерно снижение запасов железа в костном мозге:
На этой стадии симптомов может не быть.
Латентный (скрытый) дефицит железа влияет на тканевой обмен. На этой стадии запасы железа начинают истощаться, но организм ещё не успел отреагировать снижением гемоглобина. Возникают первые проявления заболевания — человека может беспокоить повышенная утомляемость, слабость, одышка при физической нагрузке, ломкость ногтей, сухость кожи, выпадение волос. Но эти симптомы пока выражены незначительно.
Латентный дефицит железа характеризуется:
На третьей стадии (собственно ЖДА) снижается уровень гемоглобина и эритроцитов.
Для железодефицитной анемии характерно:
Для этой стадии характерна ярко выраженная клиническая симптоматика, хотя зачастую люди списывают эти проявления на переутомление.
В норме уровень гемоглобина в крови: у женщин — 120-140 г/л, у мужчин — 130-160 г/л.
Степени тяжести ЖДА (на основании снижения уровня гемоглобина Hb):
Осложнения железодефицитной анемии
У беременных с ЖДА повышается риск преждевременных родов и задержки роста плода. У детей недостаток железа приводит к задержке роста и интеллектуального развития.
Диагностика железодефицитной анемии
Минимальный объём исследований:
Биохимический анализ крови покажет снижение уровня сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки и растворимых трансферриновых рецепторов, снижение коэффициента насыщения трансферрина железом (НТЖ).
Лечение железодефицитной анемии
Лечение проводится железосодержащими препаратами, в основном для приёма внутрь и значительно реже для внутримышечного или внутривенного введения. Препараты нельзя принимать без назначения врача, так как переизбыток железа опасен своими последствиями — поражением зубов, развитием гепатита, цирроза печени, сахарного диабета и сердечно-сосудистых заболеваний. Также возможны тяжёлые аллергические реакции.
При анемии следует изменить рацион питания и включить в него продукты, содержащие железо в наиболее усвояемой форме — телятину, говядину, баранину, мясо кролика, печень, язык. Важно помнить, что из мяса усваивается до 30 % железа, из рыбы — 10 %, а из растительной пищи — всего лишь 3-5 %.
При анемии коррекция дефицита железа не может быть достигнута только изменением питания. Причина этого в том, что усвоение железа из пищи ограничено, а в препаратах оно содержится в большей концентрации.
При анемии лёгкой и средней степени тяжести препараты железа лучше принимать внутрь вместе с аскорбиновой или фолиевой кислотой, так как они улучшают всасываемость железа.
Если препараты железа невозможно применять внутрь (например, при непереносимости или нарушении всасывания железа в кишечнике), то их вводят внутримышечно или внутривенно. Инъекционные препараты железа используют только в стационаре, так как они могут вызывать шоковые реакции. Их нельзя применять во время беременности и лактации.
При тяжёлой анемии (гемоглобин менее 70 г/л) и по жизненным показаниям в условиях стационара проводят переливание эритроцитарной массы.
В качестве лечебно-профилактического средства пациентам, у которых нет сахарного диабета, можно использовать гематоген. В его состав входят железо, связывающее белки, получаемые из крови крупного рогатого скота, а также аскорбиновая кислота и необходимый комплекс белков. Однако это достаточно калорийный продукт — в 100 г гематогена содержится 350–500 килокалорий, об этом следует помнить, включая его в рацион.
Прогноз. Профилактика
Прогноз при ЖДА благоприятный. В большинстве случаев заболевание успешно лечится амбулаторно. Но если не анемию не лечить, то она может прогрессировать, ухудшая общее самочувствие. ЖДА сложно скорректировать в следующих случаях:
Для профилактики ЖДА следует: