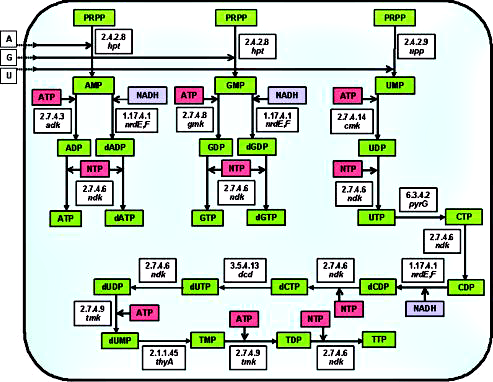
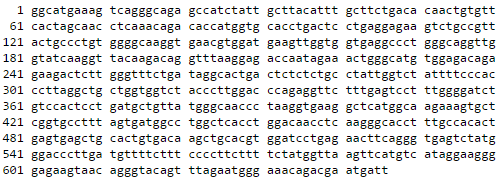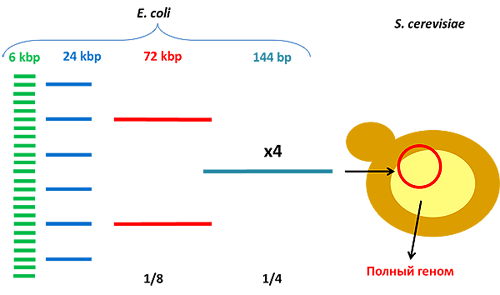Что такое синтетическая активность
Строение клеток в зависимости от синтетической активности
В зависимости от специализации и уровня дифференцировки в клетке существенно различается уровень развития органелл и других структур.
В качестве примера рассмотрим особенности организации родственных клеток в связи с выполняемой функцией.
Фибробластоцит (фибробласт) синтезирует коллагеновые и эластические волокна, полимерные комплексы аморфного вещества. В клетке хорошо развита гр. ЭПС, ядрышки, умеренно представлен комплекс Гольджи, митохондрии и миофибриллы.
Миофибробластоцит наряду с синтезом компонентов межклеточного вещества обладает сократительной активностью, поэтому в его составе много миофибрилл.
Фиброкласт (фиброкластоцит) разрушает органические элементы межклеточного вещества, в связи с этим обладает большим количеством лизосом с высокой протеолитической активностью.
Матричные (стволовые, полустволовые, бластные) клетки и клетки на стадии роста имеют крупные ядра с большим количеством диффузного хроматина (эухроматина). В цитоплазме много мелких ядрышек, а в кариолемме — ядерных пор. В таких клетках наряду с аэробным фосфорилированием активно происходит анаэробный гликолиз. В гиалоплазме много свободных полисом и рибосом, поэтому цитоплазма равномерно окрашивается базофильными красителями. Стволовые, полустволовые и бластные клетки часто отличаются высокой митотической активностью. Размеры малодифференцированных клеток обычно невелики, так как увеличение объема служит сигналом к запуску механизмов митоза.
Дифференцированные клетки, активно секретирующие белки, например аденоциты концевых отделов серозных желез, эндокриноциты, синтезирующие пептидные гормоны — это белково-продуцирующие клетки концевого отдела слюнной и экзокринного аппарата поджелудочной желез, главные клетки фундальных желез желудка, тироциты щитовидной железы и др. Подобную организацию имеют зрелые остеобласты (остеобластоциты), нейроны, энамелобласты, плазмоциты и фибробласты. В этих клетках крупные ядра, большие — одно-два (иногда больше) ядрышка, кариолемма нередко формирует инвагинации, увеличивающие ее поверхность. В ядерной оболочке имеется множество ядерных пор, обеспечивающих интенсивный обмен ядра с цитоплазмой. В цитоплазме много цистерн гр. ЭПС и комплекса Гольджи, нередко обилие секреторных белковых включений. Умеренно либо сильно развиты митохондрии.
Эта группа клеток имеет высокую потребность в аминокислотах. Недостаток аминокислот приводит к снижению секреторной активности. Часто встречается высокая зависимость от поступления микроэлементов, металлов и витаминов, особенно если эти вещества входят в состав синтезируемых клеткой белковых комплексов или в ферменты. Секреторную активность белоксинтезирующих клеток регулируют дистантные и/или тканевые гормоны, вегетативная нервная система.
Дифференцированные клетки, синтезирующие липиды, например липоциты белого и бурого жира, эндокринные клетки половых желез, эндокриноциты коры надпочечников, экзокриноциты концевых отделов сальных желез. Клетки, синтезирующие и мегаболизирующие липиды, отличаются многочисленными митохондриями больших размеров, нередко с мулыивезикулярными кристами. В цитоплазме хорошо развита глад. ЭПС, комплекс Гольджи, липидные включения (липосомы). Может быть хорошо выражена гр. ЭПС, свободные рибосомы и полисомы. Особенности строения митохондрий, имеющих трубчатые (мультивезикулярные) кристы в клетках, синтезирующих стероидные гормоны, объясняются тем, что частично синтез стероидов осуществляется именно в этих органеллах. К тому же липогенез весьма энергоемкий процесс и требует высокого энергетического обмена в клетке и обилия митохондрий.
Клетки, активно секретирующие мукополисахариды, характеризуются сморщенными ядрами с преобладанием в них гетерохроматина; ядрышки мелкие, гиперхромные. В цитоплазме развиты цистерны глад. ЭПС, комплекса Гольджи; обильные слизистые секреторные включения, часто формирующие вакуоли (в этом случае цитоплазма вакуолизирована). Умеренно развиты митохондрии. Секрет, выделяемый клетками, покрывает полости внутренних органов. Недостаточная секреция может сопровождаться повышением чувствительности слизистых к повреждающим воздействиям. Примером подобных клеток служат бокаловидные клетки, слизистые экзокриноциты (мукоциты) концевых отделов желез со слизистой или смешанной секрецией.
Клетки, обеспечивающие разрушение старых структур организма и катаболические процессы, (фагоциты) имеют множество лизосом, нередко в них видны псевдоподии, разнообразные включения, в том числе случайные, содержащие бактерии, части клеток, пыль и др. Ядра обычно крупные, ядрышки хорошо или умеренно развиты. В цитоплазме значительный объем занимает гр. ЭПС и пластинчатый комплекс. Нарушение функции клеток ведет к снижению иммунитета (моноциты и макрофаги, нейтрофилы), изменениям структур соединительной (фиброкласты) и костной (остеокласты) тканей.
Клетки, осуществляющие пристеночное переваривание и/или всасывание, имеют много микроворсинок на свободной поверхности. Эта поверхность отличается хорошо развитым гликокаликсом, на котором прикреплено множество протеолитических ферментов. В цитоплазме таких клеток (столбчатые энтероциты тонкого кишечника) гипертрофированы гр. ЭПС, комплекс Гольджи, нередко видны многочисленные митохондрии. В ядре имеются крупные ядрышки.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
активность\ синтетическая
Смотреть что такое «активность\ синтетическая» в других словарях:
Синтетическая теория эволюции — (также современный эволюционный синтез) современная эволюционная теория, которая является синтезом различных дисциплин, прежде всего, генетики и дарвинизма. СТЭ также опирается на палеонтологию, систематику, молекулярную биологию и другие.… … Википедия
СТЭ — Синтетическая теория эволюции (СТЭ) современная эволюционная теория, которая является синтезом различных дисциплин, прежде всего, генетики и дарвинизма. СТЭ также опирается на палеонтологию, систематику, молекулярную биологию и другие. Содержание … Википедия
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
СОЗНАНИЕ — многообразие различений и их различий (первичный опыт), а также предпочтений (выделение того или иного элемента различаемого в качестве переднего плана) и идентификаций различенного. В корреляции с миром как различенностью сущего С. образует… … Философская энциклопедия
Гипохлорит натрия — Общие … Википедия
Клетка — элементарная живая система, способная к самостоятельному существованию, самовоспроизведению и развитию; основа строения и жизнедеятельности всех животных и растений. К. существуют и как самостоятельные организмы (см. Простейшие), и в… … Большая советская энциклопедия
Адамантан — Адамантан … Википедия
сознание — СОЗНАНИЕ (англ. consciousness, mind; нем. Bewusstsein) состояние психической жизни индивида, выражающееся в субъективной переживаемости событий внешнего мира и жизни самого индивида, в отчете об этих событиях. С. противопоставляется… … Энциклопедия эпистемологии и философии науки
Модернизация — (Modernization) Модернизация это процесс изменения чего либо в соответствии с требованиями современности, переход к более совершенным условиям, с помощью ввода разных новых обновлений Теория модернизации, типы модернизации, органическая… … Энциклопедия инвестора
психология — (от греч. psyche душа и logos учение, наука) наука о закономерностях развития и функционирования психики как особой формы жизнедеятельности. Взаимодействие живых существ с окружающим миром реализуется посредством качественно отличных от… … Большая психологическая энциклопедия
эволюционное учение — (биол.), комплекс знаний об истории развитии живой природы. Согласно эволюционному учению, все ныне существующие виды организмов произошли от ранее существовавших путём длительного их изменения. См. Трансформизм, Ламаркизм, Дарвинизм. * * *… … Энциклопедический словарь
Что такое синтетическая активность
Важной составляющей здоровья женщины является нормальное функционирование ее репродуктивной системы. К сожалению, число бесплодных браков не имеет тенденции к снижению. В настоящее время установлено, что решающую роль в имплантации играет количество функционально полноценных рецепторов ткани эндометрия к соответствующим стероидным гормонам [5]. При этом эстрадиол повышает концентрацию рецепторов эстрадиола (РЭ) и прогестерона (РП) в цитолизе клеток, а прогестерон её снижает. В ходе нормального менструального цикла имеются широкие индивидуальные колебания содержания РЭ и РП в эндометрии. Максимальное количество РЭ и РП в эндометрии отмечается в овуляторный период, а в секреторную фазу их количество уменьшается [7, 8].
Патология синтеза рецепторов в матке может происходить под влиянием изменения количества и соотношения половых гормонов, поражения патологическим процессом матки, дисбаланса других гормонов [14].
Нарушение экспрессии рецепторов стероидных гормонов является ведущим в формировании гиперпластических процессов эндометрия и миомы матки. От состояния рецепторного аппарата матки и уровня сывороточных гормонов зависит также эффект от применяемой гормональной терапии вплоть до полной нечувствительности к ней.
Эстрогены и прогестерон обладают способностью взаимодействовать и с клетками системы макрофагов за счет присутствующих на их плазматической мембране рецепторов к стероидным гормонам [13].
Активация макрофагальных клеток сопровождается усилением экспрессии клеточных рецепторов [1, 4, 10]. В клетках при этом увеличивается количество первичных и вторичных лизосом, повышается активность лизосомных ферментов, изменяется стабильность лизосомных мембран [9].
Цель работы – определить процесс активации моноцитов крови и перитонеальных макрофагов по уровню синтеза и секреции ими лизосомного фермента лизоцима, показателю стабильности лизосомных мембран этих клеток у женщин с разной степенью экспрессии эстрогеновых и прогестероновых рецепторов на клетках эндометрия в разные фазы маточного цикла.
Материалы и методы исследования
Исследованы моноциты крови и перитонеальные макрофаги у 63-х женщин репродуктивного возраста (30,5 ± 2,5 года), находившихся на лечении в КГБУЗ «Владивостокская клиническая больница № 1» и КГБУЗ «Владивостокский клинический родильный дом № 3» с трубно-перитонеальной формой бесплодия. Всем женщинам с диагностической целью проведены гистероскопия и выскабливание полости матки на 10-й или 21-й день менструального цикла в зависимости от времени поступления в стационар. Фаза маточного цикла определялась после гистологического исследования препарата в КГБУЗ «Владивостокское патологоанатомическое бюро». На все обследования пациентками получено информированное согласие.
По данным результатов гистологического исследования женщины разделены на две группы: пациентки, у которых эндометрий находился в фазе пролиферации (первая группа – 31 женщина) и в фазе секреции (вторая группа – 32 женщины). Выделение моноцитов крови проводилось на градиенте плотности фиколл-верографина центрифугированием крови в течение 30 минут при 400 G с последующим отсасыванием микропипеткой кольца градиента [11]. Клетки прикреплялись к поверхности стекла в течение 60 минут при температуре 37 °С. Перитонеальные макрофаги получали из суспензии, взятой методом пункций заднего влагалищного свода в день проводимой гистероскопии, также выделяли прикреплением клеток к поверхности стекла.
Концентрацию клеток считали в камере Горяева и доводили стерильным физиологическим раствором до 6∙106 кл /мл. Определение стабильности лизосомных мембран моноцитов крови и перитонеальных макрофагов с расчетом показателя стабильности (ПСЛМ) проводили методом культивирования выделенных клеток в среде 199 с добавлением 0,5 % стерильного L-глутамина и 2,5 % смешанной человеческой сыворотки, прогретой в течение 30 мин при 56 °С в течение 12–15 часов при 37 °С. Микрометодом проводили определение секретированного лизоцима (Lсекр), а после 4-6-кратного замораживания-оттаивания культивируемых клеток – общего лизоцима (Lобщ = Lсекретированный + Lвнутриклеточный) [3]. На основании полученных результатов секретированного и общего лизоцима высчитывали ПСЛМ по формуле ПСЛМ = Lсекр/Lобщ∙100 %. Повышение ПСЛМ выше оптимального значения (53–58 %) расценивалось как лабилизация лизосомных мембран, снижение этого показателя – как стабилизация мембран. По результатам оценки разницы Lобщ после и до культивирования определяли количество синтезированного лизоцима (Lсинт) [12].
Определение экспрессии рецепторов к эстрогенам и прогестерону проводили иммуногистохимическим методом с использованием моноклональных антител (Dako, США) [2]. Производилась заливка фиксированных кусочков ткани эндометрия в парафин и делались тонкие срезы толщиной 4–5 мкм с помещением их по 3–4 образца на предметные стекла, покрытые поли-L-лизином. Выявление тканевых антигенов проводили авидин-биотиновым методом, в котором биотилированные вторичные антитела взаимодействуют с соответствующими молекулами пероксидазно-конъюгированного стрептавидина.
Нагревали стекла со срезами, после чего гистологические препараты обрабатывали первичными иммунными сыворотками, содержащими мышиные моноклональные антитела соответственно к рецепторам эстрогенов (Э) и прогестерону (П). На каждом стекле 1 срез (контрольный) обрабатывали неиммунной мышиной сывороткой («Dako», USA). В качестве вторичных сывороток использовали антимышиные биотилированные антитела козы (ИМТЕК, Россия) в концентрации 1:100 и конъюгированную со стрептовидином полипероксидазу (ИМТЕК, Россия) в концентрации 1:100. Анализ окрашенных пероксидазным методом ядер производили при увеличении объектива х40. Среднюю интенсивность иммуногистохимической реакции оценивали по 4-бальной шкале на 100 клеток: 0 – отсутствие реакции, 1 – слабая реакция, 2 – умеренная реакция, 3 – сильная реакция
Статистическую обработку результатов исследования проводили с использованием пакета программ «Statistica 6» с применением стандартных методов вариационной статистики и критерия Манна‒Уитни для оценки статистически значимых различий. Различие считалось достоверным при р Примечания: (достоверность различия между сравниваемыми группами):
** – различие значимо p Примечания: (достоверность различия между сравниваемыми группами)
*** – различие значимо p Примечания: (достоверность различия между сравниваемыми группами)
** – различие значимо p Примечания: (достоверность различия между сравниваемыми группами)
* – различие незначимо p > 0,05;
*** – различие значимо p 0,05). С усилением экспрессии рецепторов к прогестерону происходит значительное снижение ПСЛМ макрофагальных клеток (p Примечания: (достоверность различия между сравниваемыми группами)
Синтетическая активность делящейся клетки носит циклический характер

Мы хотели бы отметить, что такой снимок позволяет установить, какие клетки синтезировали ДНК в момент введения радиоактивной метки, а какие — нет. Эти данные имеют очень большое значение для изучения жизни клеток.
Синтетическая активность делящейся клетки носит циклический характер. В типичном случае (эпителиальные клетки тонкой кишки мыши) процесс митоза, или клеточного делении, занимает около 45минут. Последеления дочерняя клетка вступает в так называемую фазу G1, в течение которой она синтезирует РНК и белки, но не ДНК (рис. 3). Фаза G1 длится шесть часов; затем наступает следующая фаза, получившая название фазы S, во время которой клетка синтезирует ДНК, РНК и — с возрастающей скоростью — белки. Эта фаза продолжается восемь часов, после чего клетка прекращает синтез ДНК, ослабляет синтез белков и вступает в так называемую фазу G2. В продолжение этой фазы (75 минут) клетка готовится к новому митозу, во время которого она совсем не образует ДНК (а иногда и РНК) и очень слабо синтезирует белок.
Расписание цикла меняется в зависимости от типа клетки и вида организма. Однако все клетки обладают одним общим свойством, которое при этом очень полезно и с точки зрения экспериментальных радиоавтографических исследований: значительную часть своего времени делящиеся клетки проводят, синтезируя ДНК. Этот факт дает нам в руки способ измерения скорости размножении клеток и данной клеточной популяции.
Рис. 2. Радиоавтограф клеток, полученных из асцитной опухоли Эрлиха, испещрен черными точками. Каждая точка образовалась в результате распада атома трития (H3). За 8 часов до этого клетки получили дозу меченного тритием тимидина — соединения, которое используется при синтезе ДНК. Радиоактивные атомы включились в те клетки, которые синтезировали ДНК. Этот метод помогает установить локализацию ДНК в клеточных ядрах. В центре расположена делящаяся клетка; видно, что ДНК локализована в хромосомах.
Рис. 3. Жизненный цикл типичной клетки между двумя митозами, или клеточными делениями, состоит из трех фаз. Горизонтальные линии обозначают уровень синтеза PНK, ДНК и белков в каждой фазе, а также во время митоза.
Синтетическая жизнь
Синтетическая жизнь
Автор
Редактор
Статья на конкурс «био/мол/текст»: Пока одни ученые изучают геномы, другие пытаются их создавать, пользуясь искусственно синтезируемыми «деталями». Этим они напоминают инженеров, а их работа — результат многих миллионов лет эволюции. Синтетическая биология — область, где наука, изучающая живое, становится наукой, его создающей, пытаясь не только понять фундаментальные принципы организации и работы живых систем, но и решить прикладные задачи — от лечения заболеваний до биотехнологий будущего.
Обратите внимание!
Эта работа опубликована в номинации «лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Инструкция для живого
Рисунок 1. Схематическое изображение клетки. ДНК клетки — «программный код», в котором заключена вся необходимая для жизни информация, а цитоплазма (внутреннее содержимое клетки) — «способ реализации» кода (среда, которая интерпретирует зашифрованную в ДНК информацию). Зеленые точки — рибосомы; красным обозначены каналы, через которые происходит обмен с окружающей средой. Масштаб не соблюден. Рисунок автора статьи..
Поведение клетки — раздражение, деление, рост, дифференцировка — подчинено химическим реакциям, компоненты которых — белки — закодированы в ее геноме. Геном* представляет собой совокупность всей ДНК клетки, напоминая при этом «инструкцию» или «программу», в которой содержится вся наследственная информация в виде последовательности четырех символов (оснований) — A, T, G и C, — необходимая для построения и поддержания жизни. Для выполнения команд этот код должен быть интерпретирован (прочтен), а информация из последовательности оснований реализована (через РНК и белки) в наборе химических реакций в цитоплазме (рис. 1). Последние в конечном счете детерминируют все свойства живого, и это справедливо для всех организмов — от бактерий и архей до высших эукариот, что подчеркивает фундаментальность такого механизма. За многие миллионы лет эволюции организмы приобретали (и до сих пор это делают) различные гены, которые помогали им лучше приспосабливаться к условиям в своей нише. Поэтому разные живые существа имеют отличающиеся геномы, которые адаптированы к соответствующим условиям жизни, хотя некоторые элементы схожи (консервативны) у самых филогенетически удаленных организмов.
* — О масштабном проекте «Геном человека», его результатах и перспективах постгеномной эры читайте: «Геном человека: как это было и как это будет» [1]. — Ред.
Для «чтения» информации, закодированной в ДНК, ученые прибегают к различным методам секвенирования*, прочитывая каждый символ (основание) и получая в конечном итоге последовательность (на компьютере), аналогичную геному клетки (рис. 2).
Рисунок 2. Пример отображения «прочтенной» последовательности ДНК. Буквы означают азотистые основания (а — аденин, t — тимин, g — гуанин, c — цитозин). Фрагмент последовательности гена гемоглобина человека взят из GenBank (номер DQ659148.1).
Концепция синтетической биологии
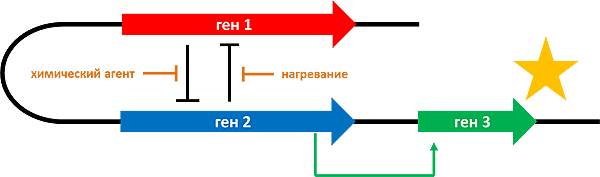
Синтетическая биология как наука появилась в начале этого века [6], когда были получены искусственные простые генно-регуляторные системы. Так, в 2000 году был сконструирован генетический триггер, который переключается между двумя стабильными состояниями в бактерии E. coli под действием термического или химического стимулов (рис. 3) [7]. Это напоминает электрическую цепь с несколькими переключателями (гены и белки) и выходным сигналом («лампочкой»), которым может быть изменение состояния клетки — например, синтез флуоресцентного белка*. Удавшийся эксперимент ознаменовал новые возможности в молекулярной и клеточной биологии и стал одним из первых шагов в создании «искусственной» жизни.
Рисунок 3. Переключатель из двух генов и гена-репортера. Оба гена (красный и синий) взаимно репрессируют друг друга (тупая стрелка), и когда экспрессия одного подавлена, второй ген активируется. В качестве инактиваторов экспрессии в этой модели используются химический агент и тепловой шок (нагревание). Второй ген активирует третий (зеленый), экспрессирующий флуоресцентный белок, свечение которого можно зарегистрировать. Рисунок автора статьи.
В настоящее время под синтетической биологией понимают создание новых биологических конструктов и систем, а также изменение природных живых систем с целью получения организма с желаемыми качествами [11]; опорой для этого служат математические модели (пример — триггер Жакоба-Моно). Первое подразумевает синтез генома de novo, второе — целенаправленное изменение уже существующего (внесение или удаление его элементов).
Минимальный геном
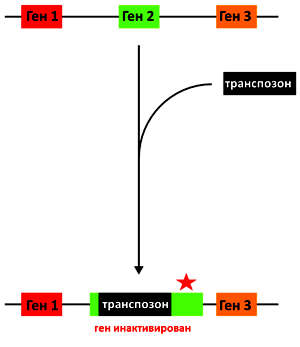
Рисунок 4. Схематичное изображение транспозонного мутагенеза. Рисунок автора статьи.
Минимальный геном — важная концепция в контексте синтетической биологии. Он представляет собой наименьшее число генетических элементов, которые необходимы для существования свободноживущего клеточного организма [12]. Это понятие тесно связано с видовой специфичностью и внешними факторами (должны быть обеспечены неограниченность ресурсов, оптимальные физические условия, отсутствие конкуренции) и зависит от конечной цели [13]; без учета этого такая концепция теряет свою ценность из-за неспособности поддерживать жизнь (по крайней мере, современного типа). Предпосылкой к этому стал поиск минимально необходимого числа генов [14], которое достаточно для клетки (при вышеперечисленных условиях). Для этого было проведено сравнение самого короткого генома среди свободноживущих организмов — Mycoplasma genitalium (0,58 млн п.н. (миллиона пар нуклеотидов), около 524 генов) — с геномом Haemophilus influenza (1,83 млн п.н., около 1788 генов), после чего были найдены 256 генов-кандидатов, достаточных для поддержания жизни современного типа. Помимо предсказательной модели, для поиска необходимых генов (при идеальных условиях) использовали экспериментальные подходы: транспозонный мутагенез, последовательное выключение генов и подавление генной экспрессии антисмысловыми РНК.
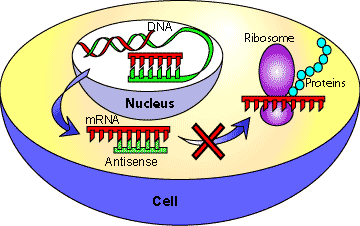
Рисунок 5. Механизм блокирования трансляции антисмысловой РНК. Образуя двухцепочечный комплекс (по принципу комплементарности) с матричной РНК, антисмысловая (antisense) РНК препятствует трансляции (синтезу белкового продукта гена). Рисунок с сайта www.scq.ubc.ca.
Первый подход основан на трансформации (трансфекции) клеток вектором, содержащим транспозон (мобильный, то есть способный перемещаться в геноме, элемент) и селективный маркер (например, маркер резистентности к антибиотикам), по которому можно будет отобрать бактериальные колонии, в которые попал вектор. Транспозон встраивается в гены клетки-хозяина, «разрывая» и инактивируя их (рис. 4). Если вставка произошла в жизненно необходимом гене (генах), то клетка погибает, не оставляя потомков, и колония не формируется; при этом клетка толерантна к вставкам в не жизненно важных генах (главный принцип: если ген может быть «разорван», то без него клетка может обойтись в данных условиях). Дальнейший отбор на селективной среде и изучение гено-/фенотипа позволяют установить инактивированные гены. Однако некоторые необходимые гены могут оказаться толерантными к транспозиции, а уменьшение скорости роста, которое вызывают некоторые мутировавшие «второстепенные» гены, может сформировать ложное представление об их значимости — экспериментатор рискует ошибочно принять одни за другие [15].
Направленный синтез антисмысловых РНК (РНК, которые комплементарно связываются с мРНК целевого гена, формируя двухцепочечный нетранслируемый комплекс) в клетках подавляет экспрессию гена на посттранскрипционном уровне, что используется для его целевой инактивации (рис. 5) [16]. Проблема заключается в том, что не всегда удается достичь адекватной экспрессии антисмысловой РНК, и это накладывает свои ограничения на применение такого метода. На основе вышесказанного (и с использованием некоторых других методов) в более позднем исследовании [17] было охарактеризовано 206 генов, необходимых для поддержания жизни клетки с минимальным размером генома. Генетический аппарат такой клетки кодирует почти полный набор белков, отвечающих за репликацию (белки реплисомы, вспомогательные белки), транскрипцию (полимеразы и т.д.) и менее полный комплекс белков трансляции (субъединицы рибосом, факторы трансляции), а также сильно редуцированные системы репарации ДНК и регуляции транскрипции. В этой клетке нет путей биосинтеза аминокислот, редуцирован биосинтез липидов и углеводов, а в качестве источника энергии выступает субстратное фосфорилирование — примитивный способ синтеза богатых энергией соединений (рис. 6, более детально — см. [17]).
Важность модели минимального генома заключается в возможностях лучше понять фундаментальные принципы жизни, руководствуясь более простой системой; исходная простота также помогает лучше контролировать такую систему при добавлении новых, усложняющих ее, функциональных конструктов. Имея наборы жизненно необходимых генов, можно построить более сложные модули для последующих систем (синтетических геномов), а также предсказать «уязвимые места» клеток, на которые можно воздействовать в своих целях (например, таргетное производство новых антибиотиков против патогенных организмов).
Рисунок 6. Метаболизм клетки с минимальным геномом. В белых боксах приведены классификационные номера ферментов и названия кодирующих их генов. В зеленых —промежуточные и конечные продукты метаболизма, а в розовых — источники химической энергии. Рисунок из [17].
Синтезированная жизнь
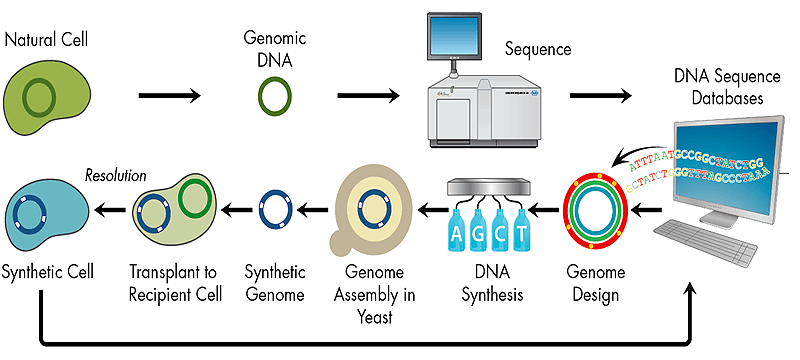
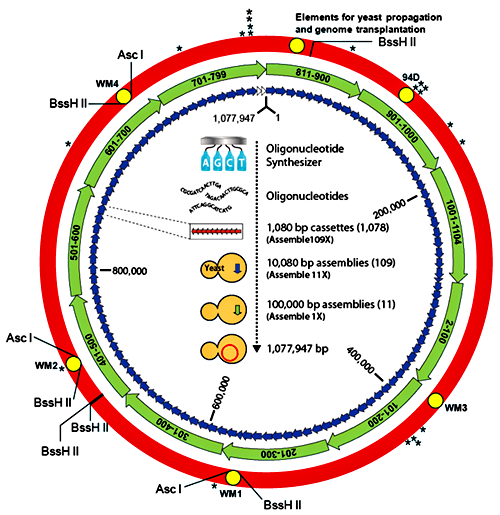
Одним из триумфов в синтетической биологии стал синтез de novo генома Mycoplasma genitalium [18, 19] (рис. 7). Бактерия с синтезированным геномом длиной более 580 т.п.н. (точнее — 582970 п.н.) получила название Mycoplasma genitalium JCVI-syn1.0 в честь института, в котором проводились работы (J. Craig Venter Institute). Использование бактерий в качестве модельной системы удобно из-за небольших размеров генома, быстрого роста бактериальных колоний и простоты трансплантации синтезированной хромосомы в клетку-реципиент. Первоначально весь геном был смоделирован на компьютере, где в межгенных областях (последовательностях ДНК между генами), толерантных к транспозиции, фрагменты ДНК иерархично собирались во всё более крупные части. На первом этапе собирались участки ДНК («кассеты», 101 штука) длиной 5–7 т.п.н. с перекрывающимися последовательностями для соединения друг с другом (последняя кассета полностью перекрывается с первой для замыкания в кольцо — типичную форму существования ДНК в бактериальных клетках) (рис. 8). Затем методами in vitro-рекомбинации (комплекс генно-инженерных методов, в основе которого — манипуляции in vitro, приводящие к образованию новых гибридных молекул ДНК) такие кассеты были собраны по четыре и в составе BAC-вектора (bacterial artificial chromosome, одна из форм передачи в клетку крупных фрагментов ДНК, в нашем случае — 10–20 т.п.н.) перенесены в E. coli для дальнейшей их наработки. (Дело в том, что без этапа многократного «размножения» в бактериях получить нормальные копии фрагментов «в пробирке» невозможно по ряду причин.)
Рисунок 7. Общая схема синтеза организмов de novo. Рисунок с сайта www.jcvi.org.
В несколько этапов из таких модулей были собраны последовательности вплоть до вставок размером ¼ генома M. genitalium, после чего возникли трудности со сборкой бόльших по размеру фрагментов ДНК. Эта проблема была решена использованием TAR-вектора (специальный вектор для клонирования в дрожжевые клетки, «искусственная хромосома») и копированием конструкций в дрожжах S. cerevisiae. Выделение вектора со вставкой синтезированного генома и последующая аннотация последнего показали идентичность смоделированной на компьютере и полученной последовательностей.
Рисунок 8. Схема сборки генома M. genitalium JCVI-syn1.0. Рисунок автора статьи.
После этого похожим способом был синтезирован геном Mycoplasma mycoides* (M. mycoides JCVI- syn1.0, рис. 9) [20], но, в отличие от предыдущего эксперимента, он был успешно трансплантирован в клетку-реципиент M. capricolum с получением жизнеспособной бактерии. Несмотря на природное происхождение плазматической мембраны и цитоплазмы, такие бактерии проявляли фенотипические признаки клеток M. mycoides. Данный эксперимент показывает функциональную релевантность искусственной хромосомы и процесс перехода от «программы» к ее «реализации».
Рисунок 9. Схема сборки генома M. mycoides JCVI-syn1.0. Рисунок из [20].
В настоящий момент экспериментаторы-«синтетики» ведут работы по минимизации размера генома M. mycoides JCVI-syn1.0, руководствуясь подходами, описанными ранее («выключение» генов в целом геноме или предсказание жизненно важных элементов и затем синтез de novo). Возможно, в скором времени число «синтетических» бактерий увеличится еще на одну, но на этот раз это будет не встречающийся в природе организм — упрощенный вариант своего природного аналога.
«Язык программирования» жизни
Создание контролируемой и отлаженной системы требует строгой типизации действий и четкого набора правил и инструкций; более того, наличие формализованного языка существенно повышает воспроизводимость результатов. Так, в 2011 году появляется «язык», на котором возможно «общаться» в контексте синтетической биологии — SBOL (Synthetic Biology Open Language) [23], чем-то напоминающий язык программирования. Он представляет собой набор стандартных компонентов (building blocks, строительных блоков), которые отражают различные генетические элементы (рис. 10). Их комбинация составляет генетические конструкты с определенными функциями, хранящиеся в виде библиотеки, благодаря чему можно пользоваться уже готовыми шаблонами (или конструктами) или уточнять их для своих нужд благодаря иерархичности языка. Таким образом, от задания последовательности нуклеотидов в геноме мы переходим к более высокому уровню сборки из комплекса последовательностей, связанных функциональной значимостью.
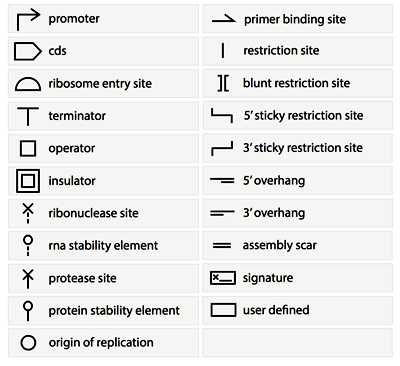
Рисунок 10. Графические элементы SBOL. Рисунок с сайта www.sbolstandard.org.
Камни преткновения
В связи со своей упрощенностью синтетические организмы очень требовательны к условиям роста, проигрывая в гибкости своим природным аналогам. Кроме того, значительно более медленный рост причиняет неудобства во время их изучения и практического использования (есть и обратный эффект [24]). Необходимость больших ресурсов для получения и исследования синтетических организмов также провоцирует определенные затруднения. Однако такие системы дают детальное представление о взаимодействии генов и гораздо больший контроль при добавлении различных биохимических путей. К сожалению, пока все исследования проведены на бактериях (в связи со сложностью эукариотических организмов: замысловатой эпигенетической регуляцией*, большой длиной генома и особенностями его организации), хотя сейчас совместными усилиями многих ученых реализуется проект по синтезу генома дрожжей Saccharomyces cerevisiae (Synthetic Yeast 2.0) [25]. Если цель будет достигнута, то это однозначно станет новым прорывом в искусстве создания синтетической жизни — состоится переход от прокариотических организмов к эукариотическим, а в дальнейшем, возможно, и к многоклеточным существам.
* — Под этим термином понимают влияния на экспрессию генов, не затрагивающие последовательность нуклеотидов ДНК. Эпигенетические модификации хроматина просто определяют, как наследственную информацию нужно «считывать» — каким генам молчать, а каким — работать: «Развитие и эпигенетика, или история о минотавре» [26], «Катится, катится к ДНК гистон» [27]. Эти модификации порой не менее значимы для здоровья человека, чем нарушающие первичную структуру ДНК мутации: «Эпигенетические часы: сколько лет вашему метилому?» [28], «Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?» [29], «Пилюли для эпигенома» [30]. — Ред.
Прикладное значение
Получив модельную систему с заранее известными свойствами, ее можно усовершенствовать в зависимости от целей, которые стоят перед исследователем. Например, добавлять наборы генов, отвечающих за желаемые биохимические пути, в том числе комбинируя их так, чтобы получать новые, не встречающиеся в природе вещества [31]. Такие организмы могут стать потенциальными источниками энергии и продуцентами топлива, а также средством биоремедиации (очистки окружающей среды с помощью биологических объектов) [32, 33]. Они могут найти свое применение в генотерапии, а знание о жизненно необходимых для клетки генах может лечь в основу производства принципиально новых антибиотиков.
Заключение
Еще с давних времен люди пытались получить живое из неживого (см. Самозарождение), и если такие методы выглядят скорее как плод фантазии, то с развитием наук о живом и появлением молекулярной биологии стало накапливаться всё больше истинных данных о функционировании живого организма и роли генома в нём. Вступив в эру геномных технологий и расшифровки ДНК, ученые получили ключевой инструмент для искусственного создания геномов, что стало предпосылкой к зарождению синтетической биологии. Но. для окончательной сборки генома и получения работающей системы всё еще нужен другой живой организм, то есть по-прежнему справедливо «omnis cellula e cellula» («клетка происходит только от другой клетки», Рудольф Вирхов). Однако быстрое развитие ДНК-технологий* и изучение систем искусственных клеток (artificial cells) [34], способных имитировать клеточное деление [35], дают надежду на то, что этому постулату в будущем будет предложена достойная альтернатива.
* — Теперь генетические инженеры могут орудовать не только «по-старинке» — in vitro, — но и прямо в живых объектах. Особую популярность приобрели системы редактирования ZFN, TALEN и CRISPR/Cas9, основанные на сайт-специфическом действии нуклеаз in vivo: «А не замахнуться ли нам на. изменение генома?» [36], «CRISPR-системы: иммунизация прокариот» [37], «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [38]. Однако это не означает, что апокалипсис не за горами — контроль, контроль и ещё много раз контроль (причем на законодательном уровне) никто не отменял. Зато победу над множеством тяжелейших недугов (и старостью?) это сулить может. — Ред.