Что такое скк в гистологии
Что такое скк в гистологии
Эмбриональный источник развития кроветворных тканей — мезенхима. В эмбриогенезе можно различать 3 периода гемопоэза: 1) внезародышевый, или мезобластический (1-2 мес), 2) гепато-тимо-лиенальный (2-5 мес), 3) медулло-тимо-лимфоидный (5-10 мес).
Постэмбриональным гемопоэзом, или физиологической регенерацией крови, называют кроветворение во взрослом организме.
Кроветворение в желточном мешке. В конце 2-й — начале 3-й недели эмбриогенеза в мезенхиме стенки желточного мешка образуются кровяные островки, в составе которых клетки дифференцируются на плоские эндотелиальные и округлые клетки. Последние преобразуются в стволовые кроветворные клетки. При внезародышевом кроветворении из стволовых клеток формируются первичные эритробласты — мегалобласты. Они делятся внутри сосудистого русла (интраваскулярно). Небольшая часть мегалобластов превращается в безъядерные первичные эритроциты — мегалоциты. Образуется также незначительное количество вторичных эритроцитов меньшей величины, чем мегалоциты. Экстраваскулярно дифференцируется часть первичных лейкоцитов (гранулоцитов — нейтрофилов и эозинофилов). Из желточного мешка стволовые кроветворные клетки по развивающимся сосудам расселяются по органам зародыша.
Кроветворение в печени. На 2-м месяце эмбриогенеза печень становится центром кроветворения. Источником гемопоэза здесь служат стволовые кроветворные клетки. Кроветворение в печени происходит экстраваскулярно. Из стволовых кроветворных клеток образуются эритроциты, зернистые гранулоциты (нейтрофилы и эозинофилы) и мегакариоциты. Зернистые лейкоциты развиваются здесь укороченным путем и не имеют четкой специфической зернистости. К концу эмбриогенеза человека кроветворение в печени постепенно прекращается.
Кроветворение в селезенке. На 4—5-м месяцах эмбриогенеза человека селезенка становится универсальным органом гемопоэза, в котором экстраваскулярно образуются все клетки крови. Позднее процессы эритро- и гранулоцитопоэза в селезенке угасают, но усиливается образование незернистых лейкоцитов.
Кроветворение в красном костном мозге и тимусе. Постепенно центральным органом кроветворения становится красный костный мозг. Строму его вначале образует мезенхима, которая позднее преобразуется в ретикулярную ткань. Ретикулярная ткань, в трехмерной сети которой происходит развитие эритроцитов, гранулоцитов, моноцитов и мегакариоцитов, называют миелоидной тканью. Миелоидная ткань — специализированная гемопоэтическая ткань красного костного мозга. Она обеспечивает развитие стволовых клеток и всех форменных элементов крови. Наряду с миелоидной к кроветворным тканям относится лимфоидная ткань, которая развивается в лимфатических узлах, селезенке и других лимфоидных органах, составляющих лимфоидную систему. Здесь в сети ретикулярной ткани происходит образование лимфоцитов, плазматических клеток, удаление клеток и продуктов их распада.
К центральным органам кроветворения относится тимус, в котором на 2-м месяце эмбриогенеза начинают дифференцироваться лимфоциты тимуса. В дальнейшем они расселяются по периферическим органам лимфоидной системы.
Кроветворение в лимфатических узлах начинается с 4-го месяца эмбриогенеза после миграции стволовых кроветворных клеток.
В соответствии с унитарной теорией кроветворения А.А. Максимова, существует единый источник развития для всех клеток крови. Исходной клеткой для всех ростков кроветворения является стволовая кроветворная клетка, сходная по своему строению с малым лимфоцитом. А.А. Максимов (1911) писал, что индифферентные блуждающие клетки, или лимфоциты в широком смысле, одарены очень большой потенцией развития: «Это индифферентная мезенхимная блуждающая клетка, лимфоцит, является общей родоначальницей всех элементов крови. Попадая в благоприятные условия, она проявляет свою потенцию развития, причем в зависимости от условий, направление развития и продукты его получаются очень разнообразными». Унитарная теория кроветворения была развита в трудах А.А. Заварзина, Н.Г. Хлопина, А.Н. Крюкова, М.И. Аринкина и др. Метод селезеночных колоний, разработанный канадскими учеными Тиллом и МакКуллохом (1961), прозволил идентифицировать вид клеток, являющийся источником развития клеток эритроидного, гранулоцитарного и мегакариоцитарного рядов. Эту клетку, которая гистологически сходна с малым темным лимфоцитом, авторы назвали колониеобразующей единицей (КОЕ).
В развитии клеток крови условно выделяются классы клеток. По мере перехода клеток из класса в класс, в каждом из них все более отчетливо обнаруживаются гемопоэтические клеточные диффероны, которые характеризуются определенными гистологическими признаками. Однако клетки первых трех классов по своему строению идентичны. Только методы иммуноцитохимии позволяют различать клетки по наборам клеточных рецепторов, что является показателем дивергентной дифференцировки стволовой клетки.
В общем виде развитие клеток крови происходит в следующей последовательности.
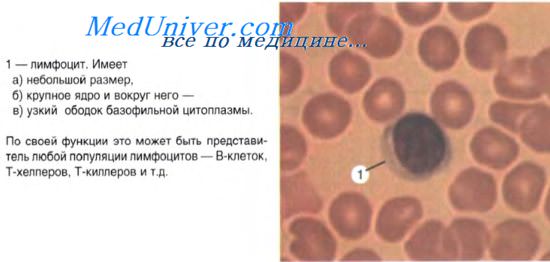
1-й класс — плюрипотентные клетки — это стволовые кроветворные клетки (СКК). Стволовая клетка является общим самоподдерживающимся предшественником всех клеток крови, включая все виды иммунокомпетентных клеток. Полагают, что каждая из стволовых клеток способна проделать по меньшей мере 100 митозов, т. е. потомками одной стволовой клетки можно было бы обеспечить всю кроветворную систему. Однако стволовые клетки после цикла пролиферации в эмбриогенезе переходят в состояние покоя. Она лишена каких-либо специфических признаков строения и локализуется в миелоидной ткани среди популяции лимфоците- или моноцитоподобных элементов. Она может с током крови мигрировать по тканям организма. Объективным методом обнаружения и количественного учета стволовых клеток является метод селезеночных колоний. Стволовые клетки составляют около 0,1% популяции кроветворных элементов.
2-й класс. Стволовые клетки под влиянием ряда факторов (тромбопоэтический, ИЛ-7 и др.) дивергентно дифференцируются в двух направлениях: полустволовые, или мультипотентные, клетки — предшественники миелопоэза (КОЕ-ГЭММ) и мультипотентные клетки — предшественники лимфопоэза (КОЕ-Л). В составе колоний эти клетки имеют ограниченные возможности к самоподдержанию (около 3-4 недель), однако этого достаточно для поддержания физиологической регенерации крови.
3-й класс. Из мультипотентных клеток — предшественников миелопоэза (КОЕ-ГЭММ) в результате дивергентной дифференцировки, происходящей под влиянием ряда факторов микроокружения, возникают следующие клеточные линии: а) родоначальные (прогениторные) клетки, или клетки-предшественники, эритропоэза (БОЭ-Э, от англ. burst — взрыв) и развивающиеся из них КОЕ-Э; б) общие родоначальные клетки гранулоцито- и моноцитопоэза (КОЕ-ГМо). Последние в процессе дальнейшей дивергентной дифференцировки под влиянием факторов микроокружения формируют родоначальные клетки для нейтрофильных (гранулоцит-стимулирующий фактор), эозинофильных (ИЛ-5) и базофильных (ИЛ-3) гранулоцитов (КОЕ-Гн, КОЕ-Эо, КОЕ-Б) и моноцитов (КОЕ-Мо, фактор — моноцит-колониестимулирующий).
Мультипотентные клетки лимфопоэза (КОЕ-Л) под влиянием дифференцировочных факторов микроокружения (ИЛ-7, ИЛ-6) развиваются в родоначальные клетки Т- и В-лимфоцитов.
Мультипотентные клетки КОЕ-ГЭММ (при участии тромбопоэтина и ИЛ-11) являются источником развития родоначальной клетки для мегакариоцитов (КОЕ-Мег).
Таким образом, важнейшее свойство, которое приобретают в миелопоэзе и лимфопоэзе кровеобразующие клетки — это формирование рецепторно-трансдукторной системы, реагирующей на конкретные факторы дифференцировки (эритропоэтин, тромбопоэтин, колониестимулирующие факторы, интерлейкины — ИЛ и др.), вырабатываемые кроветворным микроокружением и клетками других органов. Все это приводит к тому, что в клетках появляются гистологические маркеры, на основе которых можно с большой вероятностью отнести ту или иную клетку к конкретному гемопоэтическому ряду (дифферону).
IV-й класс клеток — гистологически распознаваемые клетки кроветворной ткани — это пролиферирующие клетки («бласты»). Они способны к пролиферации и дифференцировке.
V-й класс — созревающие клетки («про-циты») и VI класс — зрелые клетки периферической крови.
Гистологическое исследование биопсийного материала (простое) кожных и подкожных новообразований
Описание
Гистологическое исследование биопсийного материала (простое) кожных и подкожных новообразований — морфологическое исследование тканей и подкожных новообразований больного, полученных во время биопсии. Гистологическое исследование является самым важным в диагностике злокачественных опухолей, одним из методов оценки лекарственного лечения. Гистологические исследования дают полный отчёт о том, что же за опухоль или новообразование на коже выявлено. Чем именно оно является. Чем быстрее сделают срез новообразования, тем быстрее можно будет получить результат и приступить к лечению.
При гистологическом исследовании берётся кусочек тканей или кусочек новообразований, которые необходимо исследовать, в жировой клетчатке и на слизистых оболочках. Затем образец этой ткани полностью обезвоживают для того, чтобы он стал легко пропитываемым. Далее его пропитывают специальным парафином. После этого делают тоненький срез ткани и помещают его на предметное стекло. Благодаря различным красителям под микроскопом становятся видны клетки, которые могут быть как клетками кожи, так и клетками рака.
При диагностических биопсиях даётся микроскопическое описание и нозологическое заключение. В ясных и банальных случаях микроскопическое описание не даётся или ограничивается минимально, заключение ограничивается гистологическим диагнозом.
Гистологический диагноз может быть описательным в тех случаях, когда морфологические изменения не специфичны и не свидетельствуют в пользу какого-либо заболевания или когда недостаточно представляется клиницистами клиническая картина конкретного пациента.
Гистологическое заключение даётся в соответствии с последними гистологическими классификациями ВОЗ и медицинской номенклатурой, принятой у нас в стране.
Для качественного исследования необходимо правильно оформлять направление на гистологическое исследование. Заполнять все указанные в направлении пункты с точным указанием места локализации взятого материала, его связь с окружающими тканями, обязательно указывать основные клинические проявления и давность процесса.
Стандартный бланк направления на патогистологическое исследование заполняет и подписывает лечащий врач. При этом в направлении отражают такие клинические данные, как продолжительность заболевания, характер проведённого лечения, результаты предыдущих исследований, если они проводились. При наличии опухоли необходимо указать её точную локализацию, темпы роста, размеры, консистенцию, отношение к окружающим тканям, наличие метастазов и других опухолевых узлов, специальное лечение и клинический диагноз. Если в направлении отсутствуют необходимые данные, заведующий патологоанатомическим отделением ставит об этом в известность заведующего того отделения, откуда была прислана биопсия, а при повторных случаях сообщает администрации.
Порядок поступления биопсийного материала в лабораторию
Объект, взятый для гистологического исследования, помещают в заранее приготовленную ёмкость с фиксирующей жидкостью 10% формалин; 10% формалин наливают в чистую посуду, так, чтобы формалина было не менее чем в 10 раз больше объёма фиксируемого объекта, после чего посуду закрывают герметической крышкой или пробкой. Нельзя применять формалин более высокой концентрации или формалин с вышедшим сроком годности — с белым осадком, нельзя помещать мелкий диагностический материал в посуду из тёмного малопрозрачного стекла с узким горлышком.
В случаях, когда диагностический материал содержит примесь большого количества крови (соскобы со слизистых оболочек женских половых органов), следует, до помещения в фиксирующую жидкость, освободиться от крови, путём промывки соскобов в ванночке с тёплым физиологическим раствором, поместив их в марлевый мешочек, либо промыть тёплой водой под краном, а затем, промокнув излишки промывной жидкости, поместить в фиксатор. При этом соскоб не должен содержать кровь, которая пагубно влияет на обработку материала, уменьшает количество представительного диагностического материала и снижает полноценность гистологического исследования.
Посуда с диагностическим или операционным материалом обязательно маркируется: пишется фамилия, инициалы и возраст пациента, присваивается номер и сопровождается направлением. Маркировка не должна проводиться на крышке, закрывающей посуду.
Фрагменты ткани или органа, полученные при биопсии с диагностической целью, запрещается делить на части и посылать в разные патологоанатомические лаборатории.
Материал для патогистологического исследования должен быть достаточно представительным, а кусочки, после специальной обработки и окраски, сохранять информацию для диагноза или диагностического описания.
Материал в виде слизи, экссудата или крови, а также очень мелкий материал (менее 1 мм) не считается полноценным объектом гистологического исследования.
Ответственность за качество доставленного в лабораторию материала несёт врач, назначивший данное исследование. Подсохший, загнивший, замороженный, нефиксированный материал не принимают в патогистологическое отделение и о таких фактах сообщают администрации лечебного учреждения. Если по условиям работы невозможно сразу отправить из операционной материал в патогистологическую лабораторию, то хирург, проводивший операцию, обеспечивает правильную фиксацию материала и его сохранность.
Подготовка
Условия подготовки определяются лечащим врачом. Взятие биоматериала для данного исследования проводится лечащим врачом пациента или самостоятельно.
После того как проведена операция по иссечению, опухоль или мазок со слизистой помещают в контейнер с нейтральным 10% раствором формалина. Затем это образец отправляется в лабораторию. Если у человека наблюдается несколько и более новообразований, необходимо каждый образец помещать в отдельный контейнер. Контейнер в обязательном порядке подписывать, фамилия и имя пациента, откуда взят образец новообразования. Кроме того полностью передают историю болезни пациента.
Показания
Во всех случаях, когда удаляется какое-либо новообразование с кожи или подкожной жировой клетчатки или слизистой, проводится гистологическое исследование. Врач даёт полную картину заболевания и подтверждает диагноз, который поставил лечащий врач.
Интерпретация результатов
После полного исследования, врач-патоморфолог даёт полное заключение о том, что было обнаружено в образце опухоли или слизистой. Для полной картины необходимо знать историю болезни пациента. Иногда бывает так, что для исследования недостаточно материала для исследования, поэтому врач даёт заключение о том, какие клетки были выявлены в данном образце и о чём они могут говорить.
В заключении может быть ориентировочный или заключительный диагноз, в ряде случаев — только «описательный» ответ. Ориентировочный ответ позволяет определить круг заболеваний для проведения дифференциального диагноза. Заключительный диагноз патоморфолога является основой для формулировки клинического диагноза. «Описательный» ответ, который может быть при недостаточности материала, клинических сведений, позволяет иногда высказать предположение о характере патологического процесса. В некоторых случаях, когда присланный материал оказывается скудным, недостаточным для заключения, при этом патологический процесс мог не попасть в исследуемый кусочек, заключение патоморфолога может быть «ложноотрицательным». В случаях же отсутствия необходимых клинико-лабораторных сведений о больном или их игнорировании, ответ патоморфолога может быть «ложноположительным». Во избежание «ложноотрицательных» и «ложноположительных» заключений необходимо совместно с врачом-клиницистом проводить тщательный клинико-анатомический анализ обнаруженных изменений с обсуждением результатов клинического и морфологического обследования больного.
Медицинские интернет-конференции
Языки
Морфологическая и иммуногистохимическая характеристика почечно-клеточного рака
Маслякова Г.Н., Медведева А.В., Цмокалюк Е.Н., Воронина Е.С., Палатова Т.В.
Резюме
Ключевые слова
Статья
Введение. В последние десятилетия отмечается прогрессивное увеличение новых случаев возникновения злокачественных опухолей различных локализаций. Не является исключением и рак почки. В отличие от большинства зарубежных стран, где ежегодный прирост уровня заболеваемости почечно-клеточным раком (ПКР) составляет 2-3%, в России ежегодный прирост уровня заболеваемости ПКР составляет 6-10% [1,2,4,7,10,11,12,13]. Чаще ПКР растет медленно, имеет хорошо выраженную фиброзную капсулу, длительно не прорастает в окружающие почку ткани. Но с течением времени могут появиться признаки инвазии в окружающие почку структуры, а также в сосуды, что можно расценить как проявление агрессии раковой опухолью и опасным в плане метастазирования [3,5,6,12].
Часто злокачественные опухоли почки обнаруживают случайно при профилактическом осмотре, так как ПКР длительное время не дает клинических проявлений. При появлении жалоб у пациента с раковым заболеванием почки (боли в пояснице, повышение артериального давления, макрогематурия) уже обнаруживаются признаки инвазии опухоли в окружающие ткани и структуры почки или даже метастазирование [5,6,12]. Таким образом, актуальным остается задача раннего обнаружения и скорейшей точной диагностики опухолей в почках (локализации, степени дифференцировки и варианта ПКР).
Тактика ведения больных и прогноз выживаемости при злокачественных новообразованиях в почках зависят, прежде всего, от патологогистологического диагноза опухолевого процесса [5,6,8,9,12,14]. До сих пор гистологическое исследование при биопсии опухоли или удаленной опухоли почки является важнейшим в плане определения варианта ПКР, степени его дифференцировки и, соответственно, от окончательно поставленного патогистологического диагноза зависит дальнейшее лечение и прогноз для пациента. Важными прогностическими факторами при опухолях почек является степень ядерной атипии по Фурману, TNM стадия, клеточный вариант. По рекомендациям ВОЗ 2004 года существуют определенные гистологические признаки G (грейда или степени дифференцировки) почечно-клеточного рака: форма и размер ядер опухолевых клеток, распределение хроматина, форма и размер ядрышек, наличие митозов [7,12]. Чем выше дифференцировка опухоли (G1), тем более мелкие и однотипные ядра имеет опухоль (не более 10 мкм), хроматин и ядрышки не просматриваются. Со снижением дифференцировки (G3-G4), ядра становятся крупными, полиморфными, хроматин и ядрышки хорошо различимы [12]. Однако постановка диагноза рака почки и его дифференцировка по клеточной атипии бывает затруднена, особенно, если имеет место не классический светлоклеточный вариант, другие более редкие варианты (хромофобный, папиллярный, веретеноклеточный, мультилокуляный кистозный и другие). В таких случаях на помощь патологоанатому приходит иммуногистохимическое исследование.
Значимость иммуногистохимии опухолей трудно переоценить. В последние годы иммуногистохимическое исследование является обязательным для постановки окончательного патологогистологического диагноза в некоторых случаях, помогает максимально точно определить гистогенез опухоли, а также позволяет уточнить степень ее дифференцировки [4]. При изучении литературных источников мы не обнаружили данных, где в одном исследовании присутствовали бы результаты иммуногистохимического исследования наиболее распространенных вариантов ПКР с использованием большого количества антител (цитокератины, AMACR, Ki67, P53, PCNA, E-cadherin, VEGF, EGFR).
Цельисследования: выявление морфологических особенностей и определение наиболее важных иммуногистохимических маркеров нескольких вариантов ПКР для более точной и быстрой диагностики новообразований почек, что в дальнейшем позволит сформулировать прогноз для пациентов с опухолями в почках.
Материал и методы. Материалом для исследования явился послеоперационный материал 459 больных со злокачественными новообразованиями в почках эпителиального генеза (ПКР). Пациенты были прооперированы в клинической больнице им. Р.В. Миротворцева ФГБОУ ВО «Саратовский ГМУ им. В.И. Разумовского» Минздрава России в период с 2006 по 2011 год. Нами были проанализированы морфологические данные (локализация процесса, макрокартина, гистокартина) и дополнительно проведено иммуногистохимическое исследование цитокератинового профиля (СК 7, 8, 18), AMACR, Ki67, P53, PCNA, E-cadherin, VEGF, EGFR светлоклеточного, папиллярного, мультилокулярного кистозного, веретеоклеточного и хромофобного вариантов ПКР. Уровень экспрессии антител определялся путём суммарной оценки интенсивности окрашивания опухолевых клеток и числа позитивно окрашенных клеток. Случай расценивался как позитивный, если имело место любое по интенсивности окрашивание более 10 % опухолевых клеток. При окрашивании менее 10 % опухолевых клеток результат расценивался как нулевой. Слабая реакция более чем у 10 % опухолевых клеток со слабым окрашиванием оценивалась как «1+», при умеренном окрашивании более чем у 10 % опухолевых клеток – «2+», выраженное интенсивное окрашивание более чем 10% опухолевых клеток – «3+». В качестве группы сравнения выраженность экспрессии антител определялась в папиллярной аденоме (доброкачественная опухоль).
Результаты и обсуждение. По данным литературных источников, средний возраст, при котором обнаруживается ПКР, составляет 62 года [3,5,6,12]. Однако в нашем исследовании мы отметили, что средний возраст обнаружения рака почек 57 лет [8,9]. Некоторые случаи ПКР регистрировались в молодом и даже подростковом возрасте [14]. Кроме того, нами было отмечено, что у молодых пациентов с ПКР обнаруживаются редкие варианты опухолей почки (хромофобный, папиллярный, веретеноклеточный, мультилокулярный поликистозный). Также нами было отмечено, что редкие формы ПКР чаще встречаются у женщин [14], а у мужчин преобладал типичный светлоклеточный вариант.
Как известно из литературных источников [3,5,6,12], в последнее время все чаще стали выявляться злокачественные опухоли почек с признаками агрессии. Нами были отмечены признаки агрессии опухолей почек в 69,7% случаев (из 459 новообразований признаки инвазии имели 320). Естественно, что прогноз злокачественных опухолей любой локализации, в том числе и в почках, зависит от наличия или отсутствия метастазов, от стадии процесса и гистологического варианта заболевания, которые возможно дифференцировать только с помощью морфологического исследования [3,5,6,7,11,12]. Иногда опухоль имеет такое необычное строение или низкую дифференцировку, что постановка гистологического диагноза возможна только при использовании иммуногистохимического исследования [4]. Чтобы выявить эпителиальное происхождение опухоли (ПКР), мы использовали группу цитокератинов (СК, 7,8,18). Было обнаружено, что почти при всех вариантах ПКР СК18, дает более интенсивную реакцию (рис.1, рис.2), чем СК 7 и 8, кроме мультилокулярного кистозного варианта (табл.1). Доброкачественная опухоль почки (папиллярная аденома) показала одинаковую резко положительную реакцию на цитокератины СК7,8,18 (табл.1).
Было отмечено, что папиллярный, хромофобный и муцинозный веретеноклеточный варианты ПКР имеют более агрессивное течение, чаще прорастают лоханку и капсулу почки, дают метастазы. Напротив, мультилокулярный кистозный вариант ПКР имеет более благоприятное течение и прогноз, никогда не метастазирует (рис.5, рис.6). Таким образом, для каждого варианта опухоли, также как и для степени дифференцировки (G) опухоли, имеется своеобразная комбинация реагирования и интенсивность окрашивания антител.
После проведения иммуногистохимических реакций в нашем исследовании была произведена коррекция диагноза для некоторых опухолей. Например, после проведения обычного гистологического исследования с помощью красителя гематоксилина/эозина в группе мультилокулярного поликистозного варианта ПКР насчитывалось 13 случаев. Как уже было сказано выше, этот вариант рака почки считается наиболее благоприятным – он чаще имеет высокий G грейд и никогда не дает метастазов [9]. В нашем исследовании в одном из 13 случаев мультилокулярного кистозного варианта после проведения иммуногистохимического исследования мы отметили такую же реакцию антител, как при светлоклеточном варианте. После дополнительного обследования у пациента обнаружены метастазы рака почки в лимфоузлы. Таким образом, вместо первоначально поставленного диагноза мультилокулярного поликистозного варианта ПКР был выставлен диагноз светлоклеточного ПКР с кистозной трансформацией, пациенту проведена коррекция лечения [9].
Заключение. Таким образом, в связи с увеличением частоты развития опухолей, их поздней диагностикой, агрессивности течения и неблагоприятного прогноза, морфологический метод исследования при опухолях почек является своевременным, необходимым и самым точным диагностическим методом. Также целесообразно использование дополнительно иммуногистохимического исследования при низкодифференцированных опухолях почки и может являться обязательным методом, последовательно выполняемым после стандартного гистологического исследования. Иммуногистохимический метод с помощью ряда антител позволяет провести дифференциальную диагностику различных вариантов ПКР, в некоторых случаях позволяет уточнить G (грейд) опухоли, а это позволяет быстро назначить правильное лечение и спрогнозировать течение заболевания.
Литература
Таблицы
Таблица 1. Сравнительная характеристика реагирования антител при иммуногистохимическом исследовании различных вариантов ПКР