Что такое соли 8 класс
Что такое соли 8 класс
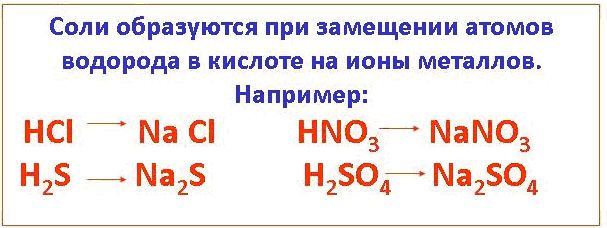
Соли – это такие сложные вещества, которые состоят из атомов металла и кислотных остатков. В некоторых случаях соли в своем составе могут содержать водород.
Если мы внимательно подойдем к рассмотрению этого определения, то заметим, что по своему составу соли чем-то похожи на кислоты, только с той разницей, что кислоты состоят из атомов водорода, а соли содержат ионы металла. Из этого следует, что соли являются продуктами замещения атомов водорода в кислоте на ионы металла. Так, к примеру, если взять известную каждому поваренную соль NaCl, то ее можно рассматривать как продукт замещения водорода в соляной кислоте НС1 на ион натрия.
Но бывают и исключения. Взять, например, соли аммония, в них кислотные остатки с частицей NH4+, а не с атомами металла.
Типы солей
А теперь давайте более подробно рассмотрим классификацию солей.
Физические свойства солей
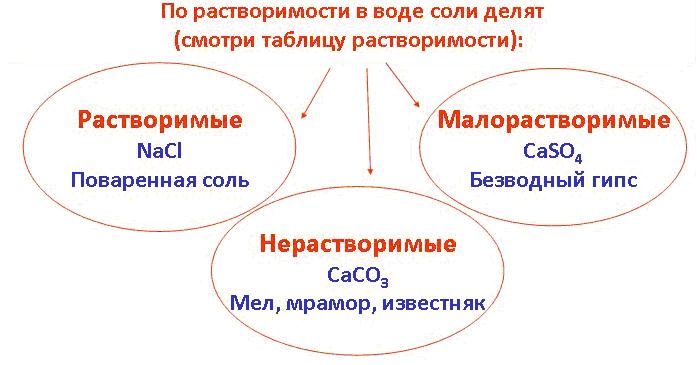
Мы уже с вами знаем, что соли являются твердыми веществами, но следует знать, им свойственна различная растворимость в воде.
Если рассматривать соли с точки зрения растворимости в воде, то их можно поделить на такие группы, как:
— растворимые (Р),
— нерастворимые (Н)
— малорастворимые (М).
Номенклатура солей
Чтобы определить степень растворимости солей, можно обратиться к таблице растворимости кислот, оснований и солей в воде.
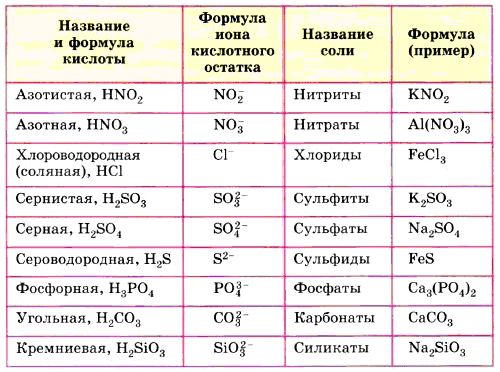
Как правило, все названия солее состоят из названий аниона, который представлен в именительном падеже и катиона, который стоит в родительном падеже.
Например: Na2SO4 — сульфат (И.п.) натрия (Р.п.).
Кроме того, для металлов в скобках указывают переменную степень окисления.
Возьмем для примера:
FeSO4 — сульфат железа (II).
Также следует знать, что существует международная номенклатура названия солей каждой кислоты, зависящая от латинского названия элемента. Так, например, соли серной кислоты, называются сульфатами. К примеру, СаSO4 – носит название сульфата кальция. А вот хлоридами называют соли соляной кислоты. Например, всем нам знакомая, NaCl называется хлоридом натрия.
Если же соли двухосновных кислот, то к их названию прибавляют частицу «би» или «гидро».
Например: Mg(HCl3)2 – будет звучать, как бикарбонат или гидрокарбонат магния.
Если в трехосновной кислоте один из атомов водорода заменить на металл, то следует еще добавить приставку «дигидро» и мы получим:
NaH2PO4 – дигидрофосфат натрия.
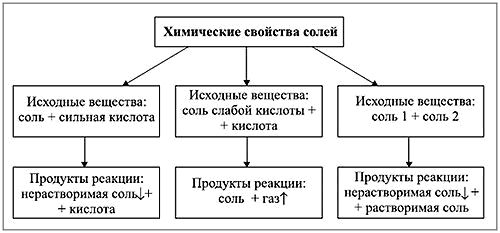
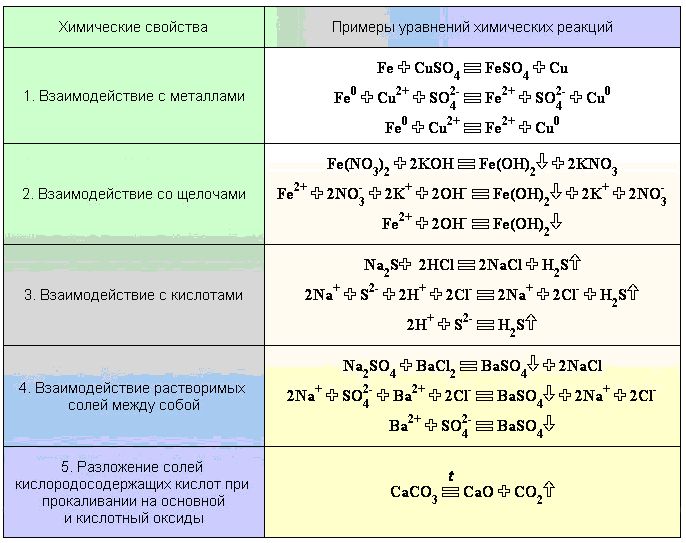
Химические свойства солей
А сейчас перейдем к рассмотрению химических свойств солей. Дело в том, что они определяются свойствами катионов и анионов, которые входят в их состав.
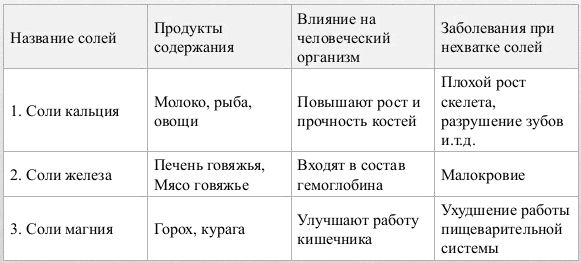
Значение соли для человеческого организма
В обществе давно идут дискуссии о вреде и пользе соли, которую она оказывает на организм человека. Но какой бы точки зрения не придерживались оппоненты, следует знать, что поваренная соль это минеральное природное вещество, которое жизненно необходимо для нашего организма.
Также следует знать, что при хронической нехватке в организме хлорида натрия, можно получить летальный исход. Ведь, если вспомнить уроки биологии, то нам известно, что тело человека на семьдесят процентов состоит из воды. А благодаря соли происходят процессы регулирования и поддержки водного баланса в нашем организме. Поэтому исключать употребление соли ни в коем случае нельзя. Конечно же, безмерное употребление соли так же ни к чему хорошему не приведет. И тут напрашивается вывод, что все должно быть в меру, так как ее недостаток, также как и избыток могут привести к нарушению баланса в нашем рационе.
Применение солей
Соли нашли свое применение, как в производственных целях, так и в нашей повседневной жизни. А сейчас давайте рассмотрим более детально и узнаем, где и какие соли чаще всего применяются.
• Соли соляной кислоты
Из этого вида солей чаще всего используют хлорид натрия и хлорид калия. Поваренную соль, которую мы с вами употребляем в пищу добывают из морской, озерной воды, а также на соляных шахтах. И если хлорид натрия мы употребляем в пищу, то в промышленности его используют для получения хлора и соды. А вот хлорид калия незаменим в сельском хозяйстве. Его применяют, как калийное удобрение.
• Соли серной кислоты
Что же касается солей серной кислоты, то они нашли широкое применение в медицине и строительстве. С ее помощью изготавливают гипс.
• Соли азотной кислоты
Соли азотной кислоты, или как их еще называют нитраты, применяются в сельском хозяйстве в качестве удобрений. Самыми значимыми среди этих солей является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Их еще называют селитрами.
Среди ортофосфатов, одним из наиболее важных, является ортофосфат кальция. Эта соль входит в основу таких минералов, как фосфориты и апатиты, которые необходимы при изготовлении фосфорных удобрений.
• Соли угольной кислоты
Соли угольной кислоты или карбонат кальция можно встретит в природе, в виде мела, известняка и мрамора. Его используют для изготовления извести. А вот карбонат калия применяется, как составляющая сырья при производстве стекла и мыла.
Интересные факты
Конечно, о соли вы знаете много интересного, но есть и такие факты, о которых вы вряд ли догадывались.
Вам, наверное, известен тот факт, что на Руси гостей было принято встречать с хлебом и солью, но злили вы, что за соль даже платили налог.
Известно ли вам, что были такие времена, когда соль ценилась больше золота. В древние времена римским воинам даже жалование платили солью. А самым дорогим и важным гостям в знак уважения преподносили горсть соли.
А знаете ли вы, что такое понятие, как «заработная плата» произошло от английского слова salary.
Оказывается, что поваренную соль можно применять в медицинских целях, так как она является отличным антисептиком и обладает ранозаживляющим и бактерицидным свойством. Ведь, наверное, каждый из вас наблюдал, будучи на море, что ранки на коже и мозоли в соленой морской воде заживают намного быстрее.
А знаете, почему зимой в гололед принято посыпать дорожки солью. Оказывается, если на лед насыпать соли, то лед превращается в воду, так как температура ее кристаллизации снизится на 1-3 градуса.
А известно ли вам, сколько соли человек употребляет в течение года. Оказывается, что за год мы с вами съедаем около восьми килограммов соли.
Оказывается, что людям, живущим в жарких странах, нужно употреблять соли в четыре раза больше, чем тем, кто живет в холодных климатических зонах, потому что во время жары выделяется большое количество пота, а с ним и выводятся соли с организма.
Урок по теме «Соли». 8-й класс
Разделы: Химия
Класс: 8
Цель урока: ввести понятие о солях, дать определение, познакомить с важнейшими неорганическими солями; рассмотреть состав, названия, номенклатуру, классификацию, физические свойства и составление структурных формул солей.
1. Проверка домашнего задания
2. Фронтальная беседа
1. Какие классы неорганических соединений вы знаете?
2. Какие соединения называют оксидами?
3. Подчеркните, синим мелом формулы оксидов и дайте им названия.
4. Как классифицируют оксиды?
5. Назовите основные оксиды, кислотные оксиды.
6. Какие соединения называют основаниями?
7. Подчеркните желтым мелом формулы оснований и назовите эти вещества.
8. Как классифицируют эти основания?
9. Пользуясь таблицей растворимости, выберите из данных формул формулы растворимых и нерастворимых оснований.
10. Какие соединения называют кислотами.
11. Как классифицируют кислоты.
12. Назовите следующие кислоты и напишите их структурные формулы: HF, H3PO4, H2SO4.
13. Составьте молекулярные и структурные формулы следующих оснований: а) гидрооксид натрия; б) гидрооксид бария.
14. Напишите молекулярные и структурные формулы оксидов элементов третьего периода.
15. Подчеркните красным мелом формулы кислот и назовите эти вещества.
3. Изучение нового материала
Обращаем внимание учащихся на то, что на доске остались неподчеркнутые формулы веществ, с которыми они еще не знакомы. Это формулы солей.
Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
Как из определения, соли по составу похожи на кислоты, только вместо ионов водорода они содержат ионы металла.
Отсюда, формула фосфата кальция имеет вид:
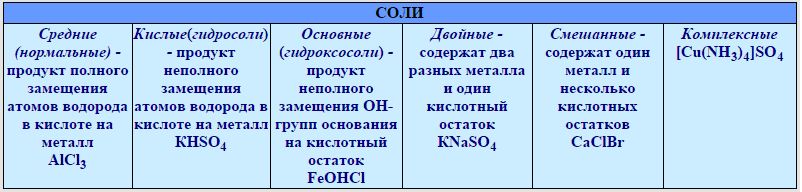
КЛАССИФИКАЦИЯ СОЛЕЙ
В зависимости от состава кислотного остатка различают средние (нормальные) и кислые соли. Молекула средней соли состоит из ионов металла и кислотного остатка: Na NO3, К СО3.
Молекула кислой соли состоит из ионов металла и кислотного остатка, содержащего ион (ионы) водорода: Na HSO4, КН2РО4.
Кислые соли образуют только многоосновные кислоты.
Схема №1.
Из схемы №1 следует, что:
1. Двухосновная кислота образует одну среднюю и одну кислую соль.
2. Трехосновная кислота образует одну среднюю и две кислые соли.
По растворимости в воде средние соли делят на растворимые (Р), нерастворимые (Н) и малорастворимые (М) (см. таблицу растворимости кислотные основания и солей в воде №2). Почти все кислые соли растворимы в воде.
НОМЕНКЛАТУРА (НАЗВАНИЯ) СОЛЕЙ.
I. Средние соли.
Сначала указывают название кислотного остатка, затем наименование металла в родительном падеже.
1. Соли бескислородных кислот.
Название кислотного остатка составляется из русского или латинского названия элемента с добавлением суффикса «-ид».
NaCl – хлорид натрия K2S – сульфид калия
2. Соли кислородосодержащих кислот. Если кислотный остаток содержит кислообразующий элемент в высшей степени окисления, то и название добавляется суффикс «-ат».
+6 +5
Na2SO4 – сульфат натрия KNO3 – нитрат калия
При более низкой степени окисления кислотообразующего элемента добавляется суффикс «-ит».
+4 +3
Na2SO3 – сульфит натрия KNO3 – нитрит калия
Если металл проявляет переменную степень окисления, то её величину указывают римской цифрой в скобках.
Например:
FeCl2 – хлорид железа (II) FeCl2 – хлорид железа (III).
II. Кислые соли
Названия кислых солей образуют также, как и средних, только при этом к названию кислотного остатка прибавляют приставку «гидро», которая указывает на наличие в молекуле соли незамещенных ионов водорода (латинское название водорода «гидрогениум):
Na2CO3 – карбонат натрия NaHCO3 – гидрокарбонат натрия
Если в молекуле кислой соли с одним кислотным остатком связано два иона водорода, то добавляют еще и числовую приставку «-ди».
Номенклатура солей приведена в таблице №1.
Номенклатура солей
Название кислоты
Формула
Название солей
Формула
Обращать внимание учащихся на таблицу растворимости и номенклатуры солей.
Какой вывод о классификации солей по растворимости можете делать?
Растворимость солей, кислот и оснований в воде
| Ионы | H + | NH + 4 | K + | Na + | Ag + | Ba 2+ | Ca 2+ | Mg 2+ | Zn 2+ | Cu 2+ | Hg 2+ | Pb 2+ | Fe 2+ | Fe 3+ | Al 3+ |
| OH – | P | P | P | – | P | M | M | Н | H | – | Н | Н | Н | Н | |
| NO 3– | P | P | P | P | P | P | P | P | Р | P | Р | Р | Р | Р | Р |
| Cl – | P | P | P | P | H | P | P | P | Р | P | Р | М | Р | Р | Р |
| S2 | P | P | P | P | H | – | – | – | Н | H | Н | Н | Н | Н | – |
| SO 2– 3 | P | P | P | P | M | M | M | M | М | – | – | Н | М | – | – |
| SO 2– 4 | P | P | P | P | M | H | M | P | Р | P | Р | Н | Р | Р | Р |
| CO 2– 3 | P | P | P | P | H | H | H | H | Н | H | – | Н | Н | – | – |
| SiO 2– 3 | H | – | P | P | H | H | H | H | Н | – | – | Н | Н | – | – |
| PO 3– 4 | P | P | P | P | H | H | H | H | Н | H | Н | Н | Н | Н | Н |
| CH3COO – | P | P | P | P | P | P | P | P | Р | P | Р | Р | Р | Р | Р |
Р – растворимые (больше 10г. в 1000г воды); М – малорастворимые (от 10г и до 0,001г в 1000г воды); Н – нерастворимые (меньше 0,01г в 1000г воды); черточка – разлагается водой или не существуют).
Вывод.
СТРУКТУРНЫЕ ФОРМУЛЫ
При изображении структурной формулы средней соли в формуле соответствующей кислоты ионы водорода заменяют атомом металла.
MgSO4 – сульфат магния образует серная кислота H2SO4:
При изображении структурных формул кислых солей в формуле соответствующей кислоты атомы водорода только частично (не полностью) заменяют атомы металла.
Mg(HSO4)2 – в образовании молекул гидросульфата магния участвуют две молекулы H2SO4. Затем в каждой молекуле H2SO4 убираем по одному атому водорода.
Два атома кислорода, у которых убрали атомы водорода, соединяем с одним атомом магния, так как магний двухвалентен:
Соли имеют различные физические свойства. Соли – кристаллические вещества различного цвета. О растворимости солей в воде можно узнать по таблице растворимости, в которой по вертикали расположены знаки гидроксогрупп и кислотных остатков, а по горизонтали – знак металлов. На пересечении знаков металла и кислотного остатка можно найти обозначения растворимости соответствующих солей: Н – нерастворимая соль, М – малорастворимая, Р – хорошо растворимая, Тире – соль в водном растворе разлагается.
Большинство солей имеют немолекулярное строение. Соли – твердые вещества различного цвета. Растворимость их различна.
РАСПРОСТРАНЕННОСТЬ СОЛЕЙ В ПРИРОДЕ И РОЛЬ В ПРОЦЕССАХ ОБМЕНА ВЕЩЕСТВ В ЖИВОТНЫХ И РАСТИТЕЛЬНЫХ ОРГАНИЗМАХ
Из всех классов неорганических соединений класс солей наиболее многочисленный.
Соли широко распространены в природе и играют важную роль в процессе обмена веществ в животных и растительных организмах. Соли содержатся в клеточном соке живых организмов, входят в состав различных тканей: костный, нервный, мышечный и др.
В организме человека содержится около 5,5% солей. Живые организмы нуждаются в постоянном поступлении солей извне.
Велика роль солей в хозяйстве страны. Соль используют, например, для получения целого ряда металлов, минеральных удобрений, стекла, моющих веществ и т.д.
Многие соли получают в промышленности в очень больших количествах.
Хлорид натрия
NaCl – хорошо растворимая в воде соль под названием «поваренная соль». Без этой соли невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обуславливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможно переваривание и усвоение пищи.
Необходимость соли для жизни была известна со времен глубочайшей древности. Значение соли отражено в многочисленных пословицах, поговорках, обычаях.
«Хлеб да соль» – вот одно из пожеланий, которым русские люди с древних пор обменивались, друг с другом во время приёма пищи, подчеркивая равноценное с хлебом значение соли.
Хлеб и соль стали символом гостеприимства и радушия русской нации. Говорят: «Чтобы узнать человека надо с ним пуд соли съесть». Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг.), так как в год каждый человек с пищей потребляет от 3 до 5,5 кг. соли.
В названиях многих городов и поселков разных стран присутствуют слово соль: Соликамск, Соль-Илецк, Усолье, Усолье-Сибирское, Солт-Лейк-Сити, Зальцбург и т.д.
Соль образует мощные отложения в земной коре. В Соль-Илецке, например, толщина пласта соли превышает полтора километра. Соли, находящиеся в озере Баскунчак в Астраханской области, хватит нашей стране на 400 лет, Огромные количества соли содержат в себе воды морей и океанов. Солью, извлеченной из Мирового океана, можно было бы засыпать всю сушу земного шара слоем 130 метров.
Хлорид натрия широко используют в химической промышленности для получения натрия, хлора, соляной кислоты, в медицине, для приготовления пищи, для консервирования продуктов питания (соление и квашение овощей) и т.д.
Карбонат кальция
CaCO3 – нерастворимый в воде, важнейшая соль, из которой многочисленные морские животные (моллюски, раки, простейшие) строят покровы своего тела – разнообразные по форме, многоцветные по окраске раковины.
Скапливаясь после гибели своих хозяев на дне водоемов и главным образом морей, эти раковины за десятки и сотни миллионов лет образовали мощные пласты соединений кальция, давших начало образованию горных пород – известняков CaCO3.
Эту же формулу имеет и замечательный строительный камень – мрамор, столь привычный каждому, стоящему у доски мел. Из известняка получают негашеную и гашеную известь, строят дома.
Мрамор идет на изготовление статуй, мрамором отделаны станции московского метро.
Из этой соли наземные животные и строят свои скелеты – внутреннюю опору для мягких тканей, которые, в десятки раз, превышают вес самой опоры.
Сульфат магния
MgSO4 х 7H2O (горькая соль) содержится в морской воде и придает ей горький вкус.
Горькую воду применяют для утяжеления хлопка и шелка, в медицине в качестве слабительного.
Фосфат кальция
Ca(PO4)2 – нерастворим в воде, это основа минералов фосфоритов и апатитов. Из них производят необходимые в сельском хозяйстве фосфорные удобрения, без которых, в свою очередь было бы невозможно получение высоких урожаев. Он входит в состав костей животных.
Растворы силиката натрия
Na3SiO3 – используют для приготовления клея (с помощью силикатного клея склеивают обычно картонные изделия).
4. Закрепление изученного материала
1. С каким классом неорганических веществ вы сегодня познакомились?
2. Выпишите из приведенных формул солей – K2S, NaB2, Na2SiO3, Mg(H2PO4), Mg HPO4, Mg3(PO4)2, KHS, NaHSiO3 – отдельно средние и кислые соли, назовите их.
3. Что такое соли и как их классифицируют?
4. Какие соли называются кислыми и средними?
5. Какие вещества называются солями?
6. Какими физическими свойствами обладают соли?
7. Назовите важнейшие соли?
8. Соли в природе.
9. Соли и их применение.
10. Соли и их значение для живого мира (фауны и флоры).
5. Заканчиваем урок подведением итогов, выставляем отметки и предлагаем домашнее задание.
Литература: