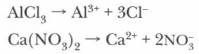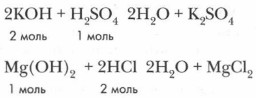Что такое соли как электролиты
§ 11. Соли как электролиты
Солями называются электролиты, которые при диссоциации образуют катионы металлов и анионы кислотных остатков:
Если рассматривать соли как продукт реакции нейтрализации, т. е. взаимодействия соответствующих основания и кислоты, то легко понять условия образования средних, кислых и осно́вных солей.
Кислые и осно́вные соли — продукты неполного замещения в реакциях нейтрализации ионов водорода катионами металла или гидроксогрупп основания кислотными остатками. Они образуются двух- и многоосновными кислотами (Н2СО3, H2SO4, Н3РО4 и др.) или двух- и многокислотными основаниями (Mg(OH)2, Ba(OH)2, Cr(OH)3 и др.).
Средние соли, в отличие от кислых и основных, являются продуктами полной нейтрализации:
Двойные соли существуют только в твердом виде, при растворении они диссоциируют с образованием двух катионов:
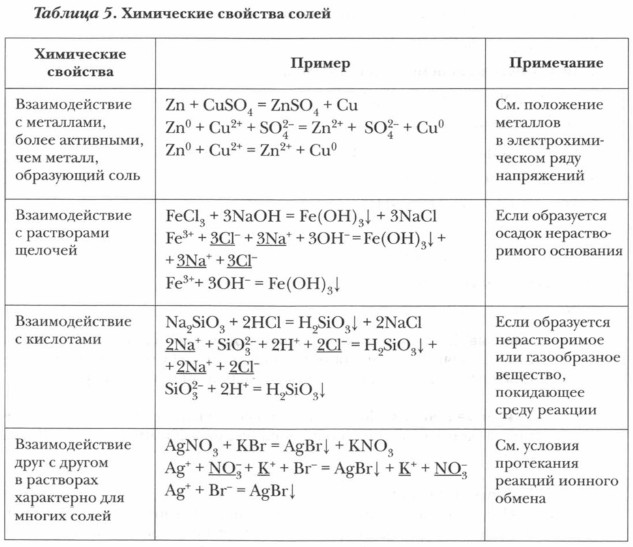
Химические свойства солей
Обратимся к таблице 5.
Задание. Составьте уравнения реакций в молекулярной, полной и сокращенной ионной форме, характеризующих химические свойства солей.
Задание. Составьте уравнения реакций в молекулярной, полной и сокращенной ионной форме, характеризующие химические свойства солей.
Тема 15. Соли и их свойства.
5. Соли как электролиты.
6. Соли средние, кислые и оснóвные.
7. Химически свойства солей в свете теории электролитической диссоциации.
8. Способы получения солей.
Соли как электролиты.
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
2) Соли средние, кислые и оснóвные.
Все соли разделяются на средние, кислые и основные. Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 8-6 являются средними солями.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
| H2SO3 | + | 2 NaOH | = | Na2SO3 | + | 2 H2O |
| сульфит натрия (средняя соль) |
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия:
| H2SO3 | + | NaOH | = | NaHSO3 | + | H2O |
| гидросульфит натрия (кислая соль) |
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
| Mg(OH)2 | + | 2 HCl | = | MgCl2 | + | 2 H2O |
| хлорид магния(средняя соль) | ||||||
| Mg(OH)2 | + | HCl | = | Mg(OH)Cl | + | H2O |
| гидроксохлорид магния(основная соль) |
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Одноокислотные основания таких солей образовать не могут.
Химически свойства солей в свете теории электролитической диссоциации.
1-Взаимодействие с металлами, ряд активности металлов
СОЛЬ + МЕТАЛЛ → новая СОЛЬ + Металл↓
Fe + CuSO₄ = FeSO₄ + Cu↓
Mg + FeCl₂ = MgCl₂ + Fe↓
Задание: дописать уравнения реакций
соль₁ + кислота₁ → соль₂ + кислота₂
Ряд активности кислот
каждая предыдущая кислота вытесняет последующую из раствора ее соли
K₂CO ₃ + 2 HCl = 2KCl + H₂CO₃
Na₂SiO₃ + H₂SO₄ = Na₂SO₄ + H₂SiO₃↓
Задание: дописать уравнения реакций
3- Взаимодействие с основаниями
соль₁ +основание₁ = соль₂ +основание₂↓
CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
AlCl₃ + 3KOH = 3KCl + Al(OH)₃↓
FeCl₂ + 2NaOH = Fe(OH)₂↓ + 2NaCl
4- Взаимодействие с солями
соль₁ +соль₂= новая соль₁↓+ новая соль₂
BaCl₂ + Na₂SO₄ = BaSO₄↓ + 2NaCl
Cu(NO₃)₂ + K₂S = 2KNO₃ + CuS↓
5- Разложение нерастворимых солей при нагревании
соль ↓ → оксид металла + оксид неметалла
Способы получения солей.
Известно большое число реакций, приводящих к образованию солей. Приведем наиболее важные из них.
1. Взаимодействие кислот с основаниями (реакция нейтрализации):
2. Взаимодействие металлов с кислотами:
3. Взаимодействие кислот с основными и амфотерными оксидами:
4. Взаимодействие кислот с солями:
5. Взаимодействие растворов двух различных солей:
6. Взаимодействие оснований с кислотными оксидами (щелочей с амфотерными оксидами):
2NаОН(тв.) + ZnO 
7. Взаимодействие основных оксидов с кислотными:
СаO + SiO2 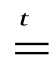
8. Взаимодействие металлов с неметаллами:
Fе + S 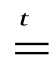
9. Взаимодействие металлов с солями.
10. Взаимодействие растворов щелочей с растворами солей
Вопросы для самоконтроля
¾ Назовите физические свойства солей.
¾ Где применяются соли?
¾ В вашей специальности соли нашли применение?
ПЛАН ЗАНЯТИЯ № 16
Дисциплина: Химия.
Тема:Гидролиз солей. Оксиды и их свойства.
Цель занятия: Научиться определять реакцию среды раствора соли в воде, составлять уравнения реакций гидролиза неорганических веществ;Углубить, систематизировать, обобщить знания обучающихся об оксидах, способах их получения и областях применения.
Предметные: понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач; владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
Метапредметные: использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи;
Личностные: готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
2. Солеобразующие и несолеобразующие оксиды.
3. Основные, амфотерные и кислотные оксиды. Зависимость характера оксида от степени окисления образующего его металла.
4. Химические свойства оксидов.
5. Получение оксидов.
Оснащение:Учебник, периодическая система химических элементов.
Литература:
Преподаватель:Тубальцева Ю.Н.
Тема 16. Гидролиз солей. Оксиды и их свойства.
2. Солеобразующие и несолеобразующие оксиды.
3. Основные, амфотерные и кислотные оксиды. Зависимость характера оксида от степени окисления образующего его металла.
4. Химические свойства оксидов.
5. Получение оксидов.
Гидролиз солей.
Кислая среда образуется в растворах кислот, так как кислоты диссоциируют с образованием ионов водорода: HCl ↔ H+ + Cl- Лакмус в кислой среде окрашивается в красный цвет.
Щелочная среда образуется в растворах щелочей и обусловлена наличием ОН-. Щёлочи диссоциируют с образованием гидроксид-ионов: NaOH ↔ Na + + OH- Лакмус в щелочной среде окрашивается в синий цвет.
Нейтральная среда образуется тогда, когда концентрация ионов Н+ и ионов ОН- будут равны: [H+] = [OH-] Лакмус не изменяет окраску, остаётся фиолетовым.
Можно предположить, что нейтральная среда образуется в растворе любой средней соли, так как в их составе нет ионов водорода или ионов гидроксильных групп.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
Тема – 8: Кислотность растворов. Гидролиз солей. Электролиз
Тема – 8: Кислотность растворов. Гидролиз солей. Электролиз.
· Теорию электролитической диссоциации Аррениуса.
· Гидролиз солей и электролиз расплавов и растворов солей.
· Записывать уравнения реакций ионного обмена
· Определять кислотность растворов кислотно – основными индикаторами.
· Составлять полные и сокращенные ионные уравнения гидролиза солей.
· Предсказывать реакцию среды в растворах солей.
· Решать задачи на концентрацию растворов.
8.1. Кислоты, основания и соли, как электролиты
Вы уже знаете, что растворы кислот, оснований и солей проводят электрический ток. Следовательно, эти вещества — электролиты. Запишем еще раз уравнения диссоциации этих веществ:
Рассматривая эти уравнения, можно заметить, что кислоты проявляют свои свойства благодаря присутствию в их растворах ионов водорода. Общие свойства оснований определяются ионами ОН (гидроксид-ионами). А свойства солей — ионами металлов и кислотных остатков.
Теперь вспомним, как мы раньше при изучении атомно-молекулярной теории определяли эти классы веществ. Кислотами мы называли сложные вещества, в состав молекул которых входят атомы водорода и кислотные остатки.
Основаниями мы назвали сложные вещества, в состав молекул которых входят атомы металлов и гидроксогруппы. Теперь, зная, что эти вещества диссоциируют в воде, мы можем дать этим веществам новые определения.
Кислоты – сложные вещества, в растворах которых нет других катионов, кроме ионов водорода.
Основания – сложные вещества, в растворах которых нет других анионов, кроме гидроксид – ионов.
Соли – сложные вещества, при диссоциации которых в воде образуются катионы металлов и анионы кислотных остатков.
Обратим теперь внимание на диссоциацию многоосновных кислот. Выше мы записали уравнение диссоциации так:
Следует иметь в виду, что данное уравнение выражает суммарный процесс диссоциации. В природе такие кислоты диссоциируют ступенчато:
Аналогичным образом ступенчато диссоциируют и многокислотные основания:
В зависимости от того, сколько атомов водорода в многоосновной кислоте замещено на металл, различают средние и кислые соли:
При диссоциации кислых солей в растворе кроме катионов металла появляются еще и катионы водорода.
8.2 Степень диссоциации (ионизации)
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично. Большая часть их молекул остается в растворе в недисоциированном виде. В растворах таких электролитов одновременно присутствуют и ионы и недиссоциированные молекулы растворенного вещества. Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита используют понятие «степень электролитическойдиссоциации».
Для каждого электролита степень электролитической диссоциации определяют опытным путем, измеряя электропроводность его водного раствора.
Степень диссоциации обозначают буквой «ОС» и часто выражают в процентах, реже в долях единицы. Степеньэлектролитической диссоциации равна отношению числа молекул, которые распались на ионы, к общему числу растворенных молекул электролита:
где п — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Степень диссоциации зависит от природы растворителя и природы растворенного вещества.
Одно и то же вещество в одних растворителях может вести себя как электролит, в других — как неэлектролит. Например, молекулы серной кислоты H2S04 хорошо диссоциируют в воде, слабее в этаноле и совсем не диссоциируют в бензоле. Это объясняется тем, что вода является одним из наиболее полярных растворителей, этанол — слабополярный, а бензол — неполярный растворитель.
Так как на практике в качестве растворителя наиболее часто используется вода, рассмотрим классификацию электролитов по степени диссоциации в водных растворах.
На степень ионизации влияет тип химической связи в молекулах электролита. Электролиты, отличающиеся друг от друга типом химической связи, диссоциируют в водном растворе в разной степени. Так, для электролитов с ионными или сильно полярными ковалентными связями диссоциация протекает в воде практически нацело. Эти электролиты называют сильными.
Таким образом, сильные электролиты — это такие электролиты, для которых степень диссоциации в водных растворах равна 1 (100%). К сильным электролитам относятся:
1. Практически все соли;
Кислоты и основания, являющиеся сильными электролитами, относятся к сильным кислотам и сильным основаниям.
Электролиты со слабо полярными связями диссоциируют в воде частично. Степень ионизации зависит от степени полярности связей в их молекулах. Электролиты, диссоциирующие не полностью, называют слабыми.
Следовательно, слабые электролиты — это такие электролиты, для которых степень диссоциации в водных растворах меньше 1 (100%).
К слабым электролитам относятся:
2. Слабые малорастворимые в воде основания и амфо-терные гидроксиды: Fe(OH)2 Fe(OH)3 Cu(OH)2 Pb(OH)2 Al(OH)3 Cr(OH)3;
He следует путать растворимость вещества с его принадлежностью к сильным и слабым электролитам. Например, хлорид серебра AgCl имеет очень низкую растворимость в воде. Однако вся растворившаяся соль находится в растворе в виде ионов Ag+ и Cl-, поэтому AgCl относят к числу сильных электролитов.
С другой стороны, например, газ аммиак NH3 очень хорошо растворяется в воде, но только часть молекул NH3 взаимодействут с водой с образованием ионов NH4+ и ОН-. Значит гидроксид аммония является слабым электролитом.
На степень диссоциации слабых электролитов влияет несколько факторов.
1. Степень ионизации электролита зависит от его концентрации в растворе. Разбавление раствора ведет к по-
вышению степени диссоциации электролита. Это происходит потому, что с уменьшением его концентрации уменьшается вероятность встречи ионов в растворе.
Повышение концентрации электролита в растворе понижает степень его ионизации.
Чем слабее электролит, тем больше повышается его степень диссоциации по мере разбавления раствора.
Изменение температуры раствора электролита также влияет на степень ионизации.
При повышении температуры степень диссоциации электролита увеличивается. Это объясняется тем, что с повышением температуры энергия молекул увеличивается, химическая связь в них ослабляется, что облегчает процесс диссоциации электролитов, то есть их распад на ионы. И наоборот, понижение температуры уменьшает степень ионизации электролита.
На степень диссоциации влияет добавление одноименных ионов к раствору слабого электролита.
8.3. Диссоциация воды. рН
Вода как слабый электролит в незначительной степени диссоциирует на ионы Н+ и ОН-, которые находятся в равновесии с недиссоциированнымк молекулами ;
Произведение концентраций ионов водорода и гидро-ксид-иснов е воде называется ионным произведением воды (обозначается К(). При определенной температуре Кв — величина постоянная. Численное значение его при температуре 22″С равно ]0″и :
Из постоянства произведения [Н»]и [ОН] следует, что при увеличении концентрации одного из ионов воды соответственно уменьшается концентрация другого иона. Это позволяет вычислять концентрацию Н4-ионов, если известна концентрация гидроксид-ионов ОН», и наоборот. Например, если в водном растворе [Н]= 103 моль/л, то [ОН
1
Таким образом, кислотность и щелочность раствора можно выражать через концентрацию либо ионов Н4, либо ионов ОН». На практике пользуются первым способом. Тогда для кислого раствора [Н] > 10 7 и для щелочного [Н] 7. Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить схемой. Из схемы видно, что чем меньше рН, тем больше концентрация ионов Н+,т. е. выше кислотность среды; и наоборот чем больше рН, тем меньше концентрация ионов Н4, т. е. выше щелочность среды.
В
Существуют различные методы измерения рН. Качественно реакцию среды и рН водных растворов электролитов определяют с помощью индикаторов, меняющих. свою окраску в определенном интервале рН.
Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды раствора, т. е. рН раствора.
На практике применяют индикаторы лакмус, метиловый оранжевый (метилоранж) и фенолфталеин.
Индикаторный метод основан на сравнении окраски индикатора в испытуемом водном растворе с окраской его в условиях известной величины рН.
1. В чем вы видите различия определений кислот, оснований и солей с позиции атомистики и электролитической диссоциации?
2. Какие вещества называют сильными электролитами? Приведите формулы и названия таких веществ.
3. Составьте уравнения диссоциации следующих веществ: а) НВг; Na2S04; б)» H3B03; NaN03; в) ВаС12; Н2С03. При составлении уравнений учтите силу электролитов.
4. Составьте уравнения ступенчатой диссоциации следующих веществ:
H3P04 NaH2P04 KHSO,, Ва(ОН)2
Фосфорная Дигидрофосфат Гидросульфат Гидроксид
кислота натрия калия бария’ Назовите образующиеся ионы.
5. В воде объемом 100 мл растворили 5 г вещества. Определите массовую долю вещества в растворе.
6. Рассчитайте молярную концентрацию раствора, в 150 мл которого растворено 0,1 моль вещества.
7. В 100 мл раствора содержится 9,8 г серной кислоты. Определите молярную концентрацию раствора.