Что такое соли жесткости как они влияют на моющую способность мыла
Что такое мыла и как их получают? Какова химическая формула мыла?
Содержание:
Мыло – это вещество, которое используется в качестве косметического средства или средства бытовой химии. Это жидкий или твердый продукт, который содержит поверхностно-активные вещества (ПАВ). Эти вещества снижают поверхностное натяжение и увеличивают смачивающую способность воды.
История открытия мыла
Впервые о мыле в Древнем Риме в 77 г. н.э. говорил Плиний Старший. В Русь из Византийской империи пришло не только православие, но и мыло. Особенно поддерживал мыловарение Петр I.
Формула мыла в химии была определена Мишелем Эжен Шеврёль в XIX веке. Ученый установил, что мыло — это смесь натриевых солей жирных кислот. В нашей столице первое производство мыла было открыто во второй половине XIX века. Мыло стоило одну копейку, поэтому его могли покупать даже бедные люди.
Химическая формула мыла
Например, формула твердого мыла C17H35COONa, а жидкого – C17H35COOК. В состав мыла также входят красящие вещества и ароматизаторы.
Особенные свойства мыла
Мыло формирует пену благодаря образованию мицелл и высокой поверхностной активности. Остаток кислоты – гидрофобная часть очищающего средства, карбоксильный ион – гидрофильная.
Грязь растворяется в несколько этапов:
Классификация мыла
I. По особенностям реагирования с водой:
II. По агрегатному состоянию:
III. По сферам применения:
Способы получения мыла
Процесс изготовления мыла
Очищающее средство в промышленных условиях синтезируют в результате двух стадий.
Мыло можно сварить двумя способами.
Как ПАВ влияют на природу
Водоемы могут самоочищаться, что достигается разбавлением, оседанием частичек на дно и созданием отложений, разложением органики до аммиака и солей аммония при помощи микробов. Устранить негативные последствия действия ПАВ сложно, ведь ПАВ в водоемах присутствуют в виде гомологов и изомеров. Если концентрация ПАВ в смеси близка к критической, то вредные свойства всех веществ в смеси суммируются.
ПАВ можно классифицировать на две группы:
ПАВ опасны для природы, т. к. они понижают поверхностное натяжение. Если в водоемах поверхностное натяжение изменяется, то концентрация кислорода в воде снижается. Это приводит к развитию биомассы водных растений и гибели водных животных. Но ПАВ могут быть не только вредными, но и безопасными. Некоторые ПАВ распадаются на углеводы.
В организм человека или животного ПАВ попадают с пищей, водой и через кожу. ПАВ могут вызывать аллергию, которые иногда сопровождаются осложнениями.
Большая Энциклопедия Нефти и Газа
Применяемые поверхностно-активные вещества должны были содержать возможно минимальное количество несульфированных соединений при высокой моющей способности в отношении полиамидных волокон. Средство должно было содержать три-полифосфат натрия в количестве, достаточном для связывания солей жесткости воды и солей железа. В составе средств необходимо наличие веществ, препятствующих ресорбции мелкодиспергированных загрязнений из моющего раствора на ткань. Ддя введения в средства должен был. Кроме того, отбеливатель должен хорошо сочетаться с другими компонентами средства и равномерно распределяться по всему его объему. [32]
Наименьшей моющей способностью обладает смесь, состоящая из 70 % мыла и 30 % синтетических моющих средств. В дистиллированной воде антисинергетического эффекта не наблюдается. Соли жесткости воды не одинаково влияют на синер-гетизм. Магниевые соли не снижают моющую способность, в то время как кальциевые приводят к резкому снижению моющей способности смеси моющих веществ. [36]
В основном в состав подобных продуктов входят анионные и неионогенные ПАВ. Анионные ПАВ обладают хорошей способностью удалять масляные пятна и частицы загрязнений при относительно низкой стоимости. Кроме того, они обеспечивают большую стабильность получаемого средства и смываются с очищаемых поверхностей легче неионогенных. Недостатком анионных ПАВ является их взаимодействие с солями жесткости воды ; кальций и магний снижают растворимость анионного ПАВ, делая их способность удалять загрязнения менее эффективной. Алкилэфиросуль-фаты более эффективны в жесткой воде, нежели ЛАБСК, и более мягкие по отношению к коже. [37]
Для потребителей особый интерес представляет устойчивость пены в присутствии пищевых загрязнителей и мягкость средства по отношению к коже. Наименее важным является чистящая способность ПАВ, поскольку в данном случае в процессе мытья прикладывается значительная физическая энергия. Учитывая эти особенности, наиболее подходящими для ручного мытья посуды являются анионные ПАВ. Обычно в этом качестве используются линейные алкилбензолсульфонаты, алкилсульфаты и сульфо-этоксилаты спиртов. Сульфоэтоксилаты спиртов менее чувствительны к действию солей жесткости воды и обладают более мягкими свойствами по отношению к коже, но при этом дороже алкиларилсульфатов. Заметим, что даже в случае сульфоэтоксила-тов в составы в небольших количествах включают усилители пен, такие как амиды и аминооксиды. Данные классы неионогенных ПАВ используют в качестве вспомогательных ингредиентов для пенообразования, для стабилизации пены в процессе мытья и для придания средствам мягкости по отношению к коже. В процессе получения устойчивых однофазных составов применяют гидротропы, такие как этанол или ксилол-сульфонат, предотвращающие разделение фаз и дающие возможность использовать ПАВ в необходимых количествах. [39]
Что такое соли жесткости как они влияют на моющую способность мыла
Эти моющие средства представляли собой алкилсульфонат, полученный реакцией бутилового или пропилового спирта с нафталином и последующим сульфированием. Эти СМС получили общее название “Nekal”. Они до сих пор производятся для текстильной промышленности.
В конце 20-х – начале 30-х годов 20 века широко применялись сульфатированные длинноцепочные спирты, которые продавались как нейтрализованные натриевые соли. Эти спирты не имели никаких добавок, кроме сульфата натрия, используемого в качестве наполнителя.
В начале 30-х годов на рынке США появились длинноцепочные алкиларилсульфонаты, полученные алкилированием бензола керосиновыми фракциями. Продукт продавали так же в виде натриевой соли, поскольку основной его составляющей был сульфат натрия. И сульфаты спиртов, и алкиларилсульфонаты продавались как моющие материалы, но существенного влияния на весь рынок они не оказывали. После второй мировой войны алкиларилсульфонаты полностью наводнили рынок, вытеснив алкилсульфаты. Однако последние впоследствии нашли широкое применение в производстве шампуней.
При этом на развитие промышленности моющих средств сильно влияли ограничивающие факторы, такие как доступность сырья. Поэтому в разных странах развитие моющей промышленности происходило с поправкой на доступность конкретного сырья в конкретной стране. Например, в США стали активно применять натриевую соль олеилтаурида., в Германии – алифатические сульфаты (сульфаты жирных спиртов), в Соединенном Королевстве – вторичный олефинсульфат, получаемый из нефтехимических источников, который производился в огромных количествах и производится в Англии по сей день.
Все эти вещества как базовые имели свои преимущества и недостатки, но при их производстве во многом учитывались и факторы, не влияющие на моющую способность веществ:
— доступность сырья;
— простота производства;
— стоимость сырья;
— стоимость производства;
— пригодность/качество конечного продукта.
Благодаря простоте изготовления и своей универсальности, алкилбензолсульфонаты, производимые из тетрамера пропилена и бензола, быстро утвердились на рынке, вытеснив ранее использовавшиеся продукты. Этот материал впоследствии вытеснил все другие основные ПАВ и в 1950-65 гг. половина мировых моющих средств основывалась на этом веществе.
Таким образом, синтетические моющие средства окончательно утвердились на рынке. В период с 1940-1972 год объем спроса на синтетические детергенты в США увеличился в 1000 раз до 4,5 млн. тонн в год, объем спроса на мыло сократился почти в 3 раза.
Больше стали потреблять жидких моющих средств. Если в 1958 жидкие моющие средства среди общего объема синтетических моющих средств занимали в массовом выражении 22,8% рынка США, то 1972 году эта доля возросла почти до 40%, а объем потребляемых жидких СМС увеличился за этот период в 5 раз.
Появление карбоксиметилцеллюлозы и использование ее в качестве добавки в моющих веществах решило проблему ресорбции загрязнений вовнутрь ткани. Несмотря на существенный прогресс в появлении новых активных моющих веществ, относительно слабым было развитие моющих веществ для стирки хлопка. Однако уже в 1947 году на рынке появились тетранатриевые пирофосфаты и триполифосфаты натрия, которые решили эту проблему.
Тетрамерпропиленбензолсульфонат стал основным ингредиентом, используемым в производстве моющих средств вплоть до 1960-х годов. Однако в связи с широким его использованием возникла проблема сточных вод. Уровень пены в реках повышался. Этот факт связывали с тем, что основанный на пропилене алкилбензолсульфонат не полностью разрушался бактериями, присутствующими в натуральной среде. Разветвленная цепь в линейной цепи алкилбензола препятствовала действию бактерий. В связи с этим вскоре начали применять сульфаты жирных кислот, которые разрушались очень легко, и с тех пор все природные жирные кислоты, из которых производят жирные спирты, представляют собой соединения с неразветвленной цепью, а линейный алкилбензол легко разрушался в природе под действием бактерий.
Переход к линейному алкилбензолу принес удивительные результаты. Выяснилось, что его моющая способность примерно на 10% лучше, чем у нелинейного. Растворы нейтрализированной сульфоновой кислоты были менее мутными, а пасты и смеси имели более низкую вязкость. Это давало определенные преимущества линейному алкилбензолу, когда его высушивали и применяли в виде порошка. Однако когда его стали продавать в виде жидкого моющего средства или пасты, покупательная привлекательность была утрачена именно по причине низкой вязкости.
Производство порошков, где использовался алкилбензол, также столкнулось с рядом проблем. Порошок оказывался слишком липким, и терял свои сыпучие свойства. Однако вскоре было установлено, что с добавлением изомеров фенила все названные негативные процессы нивелируются. Переход к линейному алкилбензолу, однако, завершился не до конца. Во многих частях света, где проблема сточных вод стоит не так остро, нелинейное вещество используется во всевозрастающих количествах.
Фосфаты также оказывают негативное влияние на окружающую среду. Выяснилось, что в озерах, куда сбрасываются сточные воды, водоросли стали расти беспрецедентными темпами, так как фосфаты оказались удобрением для них.
В настоящее время замена фосфатам так до конца и не найдена. В некоторых странах фосфаты заменяют на нитрилотриуксусную кислоту (НТК), однако, далеко не повсеместно. Предполагается, что смесь НТК и буры может полностью заменить фосфаты, однако, это может принести большое количество неожиданных проблем. Некоторые гидроксикарбоновые кислоты также могут рассматриваться как замена фосфатам. Однако самой большой революцией в производстве моющих средств стало появление энзимов (ферментов). Они способны расщеплять белки на аминокислоты. Благодаря этим свойствам, они нашли широкое применение в промышленности современных детергентов.
Состав и свойства моющих средств
Моющие средства представляют собой многокомпонентные смеси веществ, водные растворы которых применяют для очистки поверхности различных тел от загрязнений. В состав большинства моющих средств помимо моющих веществ (поверхностно-активных веществ, растворы которых обладают моющим действием), входят соли неорганических кислот (фосфаты, карбонаты), усиливающие моющее действие, а также отбеливающие и дезинфицирующие вещества, пенообразователи или пеногасители, ароматизирующие вещества, красители и др.
Поверхностно-активные вещества (ПАВ) представляют собой органические соединения, обладающие поверхностной активностью, способностью образовывать пену и полуколлоидный раствор в воде. Благодаря поверхностной активности, они понижают поверхностное натяжение воды, увеличивая тем самым ее смачивающую способность.
Моющие вещества в зависимости от строения углеводородного радикала и активной группы делят на следующие типы:
1. Алкилкарбонаты (мыла);
2. Алкилсульфаты;
3. Алкилсульфонаты;
4. Алкиларилсульфонаты;
5. Алкиламмонийхлориды (катионоактивные моющие вещества).
Мыла получают переработкой жирового сырья, сульфаты и сульфонаты являются синтетическими моющими веществами. Перечисленные моющие вещества называют ионогенными (ионообразующими). В водном растворе они диссоциируют на ионы.
Мыла, сульфаты и сульфонаты являются анионоактивными, так как образуют поверхностно-активный отрицательно заряженный ион. Встречаются и неионогенные моющие вещества. Они в воде не диссоциируют, но растворяются, благодаря наличию в молекуле большого числа гидрофильных групп, например ОН.
Неионогенные ПАВы бывают естественного происхождения и синтетические — препараты типа ОН, полученные из окиси этилена и фенолов, жирных спиртов. Хотя ПАВы и являются основными компонентами моющих средств, моющий эффект их самих по себе слаб. В этой связи, их применяют в смеси с полезными добавками: нейтральными и щелочными солями (электролитами), отбеливателями, стабилизаторами пены, энзимами (ферментами).
Щелочные соли (сода кальцинированная, триполифосфат, тринатрийфосфат, гексаметафосфат, силикат натрия) улучшают эмульгирующую способность и коллоидную структуру моющих растворов, способствуют получению более прочных пленок мою¬щего вещества вокруг частиц загрязнения, смягчают воду и соз¬дают благоприятную (слабо-, умеренно- или сильнощелочную) среду для стирки изделий из различных волокон. Например, для стирки хлопковых и льняных тканей эффек¬тивно вводить в средства сильнощелочные добавки — соду, тринатрийфосфат.
Скажем, гексаметафосфат образует в моющем растворе слабокислую среду, благоприятную для стирки шерстяных тканей. Нейтральные соли (сульфат натрия) являются наполнителями и улучшают структуру коллоидных растворов моющих средств. При введении отбеливателей в состав синтетических моющих средств не требуется подсинивания белья.
Стабилизаторы пены (алкилоламиды) улучшают и стабилизируют пенообразование моющих средств. Для устранения повторного осаждения загрязнений в состав синтетических моющих средств вводят карбоксиметилцеллюлозу (КМЦ).
Потребительскими свойствами мою¬щих средств являются моющая, пенообразующая и антиресорбционная способность, рН среды моющего вещества.
Моющая способность — комплексный показатель оценки по¬требительных свойств моющих средств. Ее определяют по степени восстановления белизны загрязненной ткани после одной или нескольких стирок в моющем растворе определенной консистенции.
Моющая способность может быть выражена отношением бе¬лизны (коэффициента отражения) выстиранной ткани к белизне (коэффициенту отражения) белой незагрязненной ткани (в про¬центах). Моющая способность зависит от поверхностной активности моющего вещества, его способности эмульгировать жировые и масляные загрязнения, жесткости воды, температуры, рН среды и др.
В мягкой (не содержащей солей Са, Mg, Fe) воде наиболее высокую моющую способность проявляет жировое мыло. Хорошую моющую способность имеют первичные алкилсульфаты и алкиларилсульфонаты. Более низкой моющей способностью обладают вторичные алкилсульфаты, алкилсульфонаты, катионоактивные, неионогенные синтетические моющие вещества. С увеличением жесткости воды моющая способность мыла может быть утрачена полностью, в то время как у синтетических мою¬щих веществ она уменьшается лишь наполовину, а в присутст¬вии электролитов почти не изменяется.
Пенообразовательную способность моющих растворов характе¬ризуют объемом или высотой столба пены, а также пеноустойчивостью, т. е. отношением объема или высоты столба пены через определенный промежуток времени после ее образования к пер-воначальному объему или высоте столба пены. В мягкой воде мыло образует более обильную и устойчивую пену, чем синтетические моющие вещества.
Антиресорбционная способность характеризует стабилизирую¬щее действие моющих веществ. Моющие вещества должны не только удалять загрязнения с поверхности, но и удерживать их в растворе, препятствовать повторному осаждению, т. е. прояв¬лять солюбизирующий эффект. Мыла обладают высоким собили¬зирующим действием. Синтетические моющие вещества прояв¬ляют сравнительно слабую способность удерживать в моющем растворе загрязнения. Мелкие частицы загрязнения повторно осаждаются на очищаемой поверхности, и ткани после многократных стирок приобретают серый оттенок. Для повышения антиресорбционной способности моющих веществ вводят различ¬ные добавки (КМЦ).
В зависимости от вида и количества нейтральных и щелочных солей моющий раствор имеет различную среду (рН) — кислую, нейтральную, слабо- и сильнощелочную. Кислая и нейтральная среды благоприятны для стирки изделий из волокон животного происхождения, щелочная — для стирки изделий из волокон рас¬тительного происхождения; умеренно щелочная среда (при добав¬лении триполифосфата) — для стирки тканей из искусственных и синтетических волокон. В зависимости от рН среды изменяется также моющая способность моющих веществ. Например, анионоактивные моющие вещества (мыло, алкилсульфаты и сульфонаты) проявляют моющий эффект лишь в щелочной и нейтраль¬ной среде, в кислой среде они сами закрепляются на ткани.
Катионоактивные моющие вещества проявляют моющее действие в нейтральной и слабокислой средах. Такое различие свойств зави¬сит от характера заряда растворенных в воде активных частей молекулы моющего вещества.
Несмотря на важность поверхностно-активных веществ, содержание полезных добавок к ним в объемном выражении в десятки раз превосходит содержание самих ПАВов. В главе 2 рассмотрим примерную степень концентрации всех названных веществ в современных жидких моющих средствах.
Суммируя все, мы можем выделить пять основных компонентов моющих средств.
1) Поверхностно-активные вещества являются главным компонентом моющих средств. Их цель – очистка загрязнений, посредством снижения поверхностного натяжения воды. Часто детергенты содержат несколько типов ПАВов, которые способствуют большей эффективности.
2) Вспомогательные вещества снижают концентрацию ПАВов, до уровня, необходимого для осуществления моющего действия. Помимо этого, создают щелочную среду и снижают жесткость воды. Некоторые из этих веществ предотвращают отложение солей на элементах посудомоечных и/или стиральных машин.
3) Отбеливающие элементы (в стиральных порошках) обладают двойным действием – помимо отбеливания обеспечивают гигиену.
4) Энзимы расщепляют белки до легко смываемых аминокислот.
5) В синтетических моющих веществах могут содержаться и другие добавки – стабилизаторы энзимов, оптические отбеливатели, вещества, предотвращающие повторное отложение грязи, стабилизаторы пены, ароматизаторы, ингибиторы коррозии.
С анализом российских производителей СМС Вы можете познакомиться в отчете Академии Конъюнктуры Промышленных Рынков «Анализ производителей синтетических моющих средств в России».
СВОЙСТВА МЫЛА
Строение мыла. Развернутая формула строения натриевых и калиевых мыл показывает, что они состоят из двух неравных частей. Левая — их длинная часть — состоит из углеводородных групп, вокруг которых нет электрического поля; правая же—-короткая часть (—COONa или —COOK), содержащая карбоксильную группу, создает вокруг себя электрическое поле. Ниже приведена развернутая структурная формула строения натриевого, мыла стеариновой кислоты:
М I I I I I I I I I I I I I I I X°Ns ннн НН нннннннннннн
Аналогичное строение имеют мыла других жирных кислот.
Левая часть молекулы мыла называется неполярной (не несет электрического заряда), правая — полярной (несет электрический заряд). Каждая из этих частей характеризуется своими свойствами.
Полярные вещества хорошо растворяются в воде и различных водных растворах; неполярные вещества в воде нерастворимы, но хорошо растворяются в жирах, маслах и других неполярных веществах, в том числе и в воздухе. Особенности строения мыла обусловливают его многие свойства, в том числе моющее действие.
Растворимость мыла. Мыла щелочных металлов хорошо растворяются в воде: калиевые мыла растворяются быстрее, чем натриевые. Мыла низкомолекулярных жирных кислот растворяются легче высокомолекулярных; в присутствии мыл из низкомолекулярных кислот улучшается растворимость высокомолекулярных. При одинаковом числе углеродных атомов в молекуле мыла ненасыщенных жирных кислот растворяются лучше мыл из насыщенных кислот. С повышением температуры растворимость всех мыл увеличивается.
Диссоциация — обратимое разложение молекул на более простые молекулы, атомы, атомные группы или ионы. Принято считать, что в сильно разбавленных растворах мыло находится в состоянии истинного раствора. При этом часть его диссоциирует (распадается) электролитически, давая катион металла и анион жирной кислоты по уравнению
Степень диссоциации мыла можно изменять. Если из раствора удалять один из ионов или понижать концентрацию их, то диссоциация будет продолжаться и все новые молекулы вещества будут
Распадаться на ионы. Наоборот, если повысить концентрацию раствора мыла или ввести в этот раствор некоторое количество вещества, например едкой щелочи или поваренной соли, дающего ионы сильного основания, то диссоциация будет снижаться.
Г и д р о л и з — реакция обменного разложения между различными веществами и водой. Мыло как соль сильного основания и слабой кислоты в водном растворе подвергается гидролизу, т. е. взаимодействует с водой, распадаясь на жирную кислоту и свободную щелочь по уравнению
ЯСОСЖа + Н20 ИСООН + №ОН.
Гидролиз мыльных растворов увеличивается с понижением концентрации растворов, повышением молекулярной массы жирных кислот и повышением температуры раствора. Мыла ненасыщенных кислот гидролизуются несколько меньше, чем насыщенных. Мыла смоляных кислот подвергаются гидролизу сильнее, чем мыла жирных кислот.
Образующиеся в результате гидролиза молекулы жирных кислот могут взаимодействовать с негидролизованным мылом, образуя кислые мыла по уравнению
ЯСООН + ИСОСЖа ИСООН • КСООМа.
Получающиеся при этом кислые мыла насыщенных высокомолекулярных жирных кислот в разбавленных мыльных растворах и в воде нерастворимы, они представляют собой тонкодисперсные взвеси (суспензии). Кислые мыла ненасыщенных жирных кислот при повышенной температуре в мыльных растворах частично растворяются.
Ассоциация молекул — соединение нескольких молекул одного и того же вещества в одну частицу. В более концентрированных мыльных растворах молекулы мыла начинают ассоциироваться (соединяться), образуя сначала пары молекул, связанные межмолекулярным притяжением групп —СОО№, а затем — более крупные ассоциаты, называемые мицеллами.
Таким образом, в зависимости от концентрации мыльного раствора в нем может находиться значительное количество разных компонентов: растворенные в воде недиссоциированные молекулы мыла, ассоциированные молекулы мыла (мицеллы), диссоциированные молекулы мыла — анионы и катионы, ассоциированные анионы, кислые мыла.
Между этими компонентами устанавливается равновесие, которое зависит от природы жира, концентрации раствора, температуры, наличия других электролитов и т. д.
Способность мыльных растворов к диссоциации, гидролизу и ассоциации обусловливает их сложный химический состав. Сложный состав мыльных растворов определяет их свойства, благодаря которым они отнесены к коллоидным электролитам, т. е. к таким водным растворам, которые ведут себя как электролиты (проводят электрический ток) и наряду с этим обладают некоторыми свойствами коллоидов.
Моющее действие мыла. Как известно, главное свойство всех видов мыла заключается в их способности образовывать водные растворы, которые отмывают различные загрязнения на коже, волосах, разных тканях, на стекле, металле, дереве и на других предметах. Эти водные растворы способны отделять загрязнения •от поверхности, переводить их в раствор и удерживать в нем, не давая обратно оседать на очищаемую поверхность. Моющее действие мыльных растворов сопровождается довольно сложными •физико-химическими процессами, которые обусловлены строением мыла.
Как уже известно, молекула мыла состоит из двух неравных частей — полярной и неполярной. При растворении в воде мыло своей полярной карбоксильной группой погружается в водный раствор, в то время как неполярная углеводородная группа из воды выталкивается. Если в водный раствор мыла попадает капелька жира, масла или другого неполярного вещества, то углеводородная часть растворится в нем, в то время как карбоксил застревает в воде.
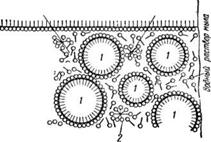
Таким образом, мыло связывает водный раствор с нерастворимыми в нем жировыми и жироподобными веществами. Это можно себе представить так, что молекула мыла является булавкой, шляпка которой находится в водном растворе, а острие—-в капельке масла. Так как в растворе находится большое количество молекул мыла, то они образуют вокруг капельки жира сплошной «частокол» в виде довольно прочной упругой пленки, удерживающей капельку в водном растворе. Схематично этот процесс показан на рис. 2.
Благодаря своей высокой поверхностной активности водные растворы мыла хорошо растекаются по поверхности ткани, погруженной в мыльную воду, и хорошо ею впитываются. При этом молекулы мыла обычно погружаются в ткань своей длинной углеводородной частью, а короткая часть — карбоксил как бы «торчит» наружу. В это время между тканью и прилипшими к ней загрязнениями образуются тончайшие пленочки, которые ослабляют силы сцепления ткани с загрязнениями и облегчают отрыв загрязнений от ткани.
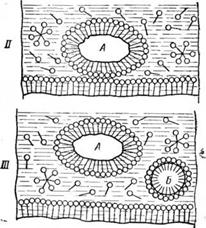
Схематично процесс смачивания ткани, отрыв загрязнений с поверхности и удерживание их в водном растворе мыла представлен на рис. 3.
Пена, образующаяся в моющем растворе, облегчает удерживание отмываемых загрязнений, которые прилипают к поверхности тончайших мыльных пленок, окружающих воздушные пузырьки. Наличие пены является также показателем того, что в моющем растворе еще имеется некоторый запас неизрасходованного мыла.
Рис. 2. Схема удерживания капелек жира в мыльном растворе:
/ — капельки жира; 2 — молекулы растворенного мыла (мелкими кружками обозначены водорастворимые карбоксилы, черточками — жирорастворимая углеводородная часть).
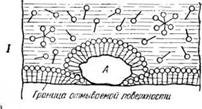
I—молекулы мыла адсорбируются на твердой грязевой частице и отмываемой поверхности; //—молекулы мыла отделяют грязевую частицу от отмываемой поверхности; Ш — твердая грязевая частица в моющем растворе; А — молекулы мыла адсорбируются на поверхности твердой грязевой частицы; Б — молекулы мыла, адсорбируясь на поверхности жидкой грязевой частицы, своими концами вторгаются внутрь грязевой частицы.
Моющая способность мыла проявляется при сравнительно низких концентрациях его водных растворов (порядка 0,1—0,2% в пересчете на жирные кислоты). На результат моющего действия существенное влияние оказывают следующие факторы: состав жирных кислот, из которых сварено мыло, характер очищаемой поверхности и интенсивность загрязнения, температура при мытье, жесткость воды, характер механического воздействия на очищаемую поверхность и др.
Недостатки мыла. Отличительной особенностью мыла является его сравнительная универсальность при мытье, стирке и чистке.
К его потребительским недостаткам следует отнести чувствительность к качеству воды. В жесткой воде жировое мыло плохо моет, образует липкий осадок. Расход его на мытье и стирку увеличивается. Вредное действие солей жесткости не ограничивается только перерасходом мыла. Если на ткани остаются кальциевые или магниевые мыла, то она быстрее изнашивается ввиду ускорения окисления ее кислородом воздуха. Выстиранная
В жёсткой воде ткань становится грубой, менее эластичной, поры ее забиваются и хуже пропускают воздух, краски становятся блеклыми, и в конечном счете свойства ткани резко снижаются. При мытье головы мылом в жесткой воде волосы склеиваются.
Для борьбы с отрицательным действием солей жесткости воды рекомендуется их предварительно удалять. Для этого воду можно умягчить, применяя специальные порошки, содержащие фосфорные соли, кальцинированную соду, силикат натрия и некоторые другие добавки.
Недостатком жирового мыла является и то, что при растворении его в воде выделяется (в результате гидролиза) некоторое незначительное количество свободной едкой щелочи. Щелочь безвредна для хлопчатобумажных и льняных тканей, но не допускается при стирке шелковых, шерстяных и многих синтетических тканей.
Несмотря на имеющиеся недостатки, мыло является весьма эффективным и универсальным видом моющих средств, особенно для ухода за телом и в ряде других случаев.