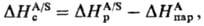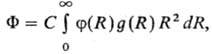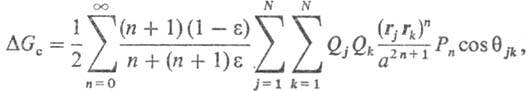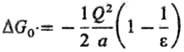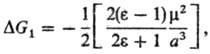Что такое сольватация в химии
СОЛЬВАТАЦИЯ
взаимод. молекул растворенного в-ва (или их ассоциатов) с молекулами р-рителя. Приводит к изменению св-в молекул в р-ре (в сравнении со св-вами газовой фазы), влияет на все физ. и физ.-хим. процессы, протекающие в р-рах, в т. ч. определяет скорость реакций в растворах и положение равновесия, а в ряде случаев и их механизм. С. в водных средах часто наз. гидратацией. Наиб. интенсивна С. ионов в растворах электролитов.
С. состоит в том, что молекула растворенного в-ва оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул р-рителя. В результате С. образуются сольваты-мол. образования постоянного или переменного состава. Время жизни соль-ватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимод. время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В соответствии с типами межмол. взаимод. выделяют неспецифическую и специфическую С. Неспецифическая С. обусловлена ван-дер-ваальсовыми взаимод., специфическая С. проявляется гл. обр. вследствие электростатич. взаимод., коор-динац. и водородных связей.
где 
D(DG c ) = DG п (X, W:S)= 

где 
Структура ближайшего окружения частицы растворенного в-ва характеризуется координационными числами С., определяемыми как кол-во молекул р-рителя, связанных достаточно долго с этой частицей, чтобы участвовать вместе с ней в диффузионном движении. Число С. зависит от природы растворенной частицы и р-рителя, а также в нек-рой степени от используемого метода определения; обычно используют данные по сжимаемости р-ра, скорости диффузии ионов, электропроводности, а также термохим. методы, электронное спиновое эхо и др. Для одновалентных ионов щелочных металлов и галогенов числа С. составляют от 0,5 до 5,0 (значения меньше 1 свидетельствуют о том, что в нек-рые моменты времени сольват-ная оболочка отсутствует).
В бинарных р-рителях, состоящих из нейтрального (не-полярного) и активного (полярного) компонентов, возникает селективная С., при к-рой состав сольватной оболочки резко отличается от состава р-ра в целом. Особенно сильна селективная С. при малых концентрациях полярного компонента.
Сольватация
Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией. Образующиеся в результате сольватации молекулярные агрегаты называются сольватами (в случае воды гидратами). В отличие от сольволиза объединение однородных частиц в растворе называют ассоциацией.
Сольватация состоит в том, что молекула растворенного вещества оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул растворителя. В результате сольватации образуются сольваты-молекулы образования постоянного или переменного состава. Время жизни сольватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимодействия время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В соответствии с типами межмолекулярного взаимодействия выделяют неспецифическую и специфическую сольватацию. Неспецифическая сольватация обусловлена ван-дер-ваальсовыми взаимодействиями, специфическая сольватация проявляется главным образом вследствие электростатических взаимодействий, координационных и водородных связей.
Сольватация приводит к тому, что тип растворителя изменяет скорость химических реакций (до 10 9 раз), определяет относительную устойчивость таутомеров, конформеров, изомеров, влияет на механизм реакций. Положения кислотно-основных равновесий в значительной степени определяются сольватирующей способностью растворителя. Подробнее о влиянии сольватации на физ.-хим, характеристики растворенных в-в и их реакц. способность см. в ст. Реакции в растворах.
На влиянии сольватации на характеристики электронных спектров поглощения и испускания основано явление, наз. сольватохромией.
СОЛЬВАТАЦИЯ
СОЛЬВАТАЦИЯ, взаимод. молекул растворенного в-ва (или их ассоциатов) с молекулами р-рителя. Приводит к изменению св-в молекул в р-ре (в сравнении со св-вами газовой фазы), влияет на все физ. и физ.-хим. процессы, протекающие в р-рах, в т.ч. определяет скорость реакций в растворах и положение равновесия, а в ряде случаев и их механизм. Сольватация в водных средах часто наз. гидратацией. Наиб. интенсивна сольватация ионов в растворах электролитов.
Сольватация состоит в том, что молекула растворенного в-ва оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул р-рителя. В результате сольватации образуются сольваты-мол. образования постоянного или переменного состава. Время жизни соль-ватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимод. время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В соответствии с типами межмол. взаимод. выделяют неспецифическую и специфическую сольватацию. Неспецифическая сольватация обусловлена ван-дер-ваальсовыми взаимод., специфическая сольватация проявляется гл. обр. вследствие электростатич. взаимод., коор-динац. и водородных связей.
где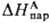
D ( D G c ) = D G п (X, W : S)=
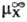
где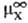
Структура ближайшего окружения частицы растворенного в-ва характеризуется координационными числами сольватации, определяемыми как кол-во молекул р-рителя, связанных достаточно долго с этой частицей, чтобы участвовать вместе с ней в диффузионном движении. Число сольватации зависит от природы растворенной частицы и р-рителя, а также в нек-рой степени от используемого метода определения; обычно используют данные по сжимаемости р-ра, скорости диффузии ионов, электропроводности, а также термохим. методы, электронное спиновое эхо и др. Для одновалентных ионов щелочных металлов и галогенов числа сольватации составляют от 0,5 до 5,0 (значения меньше 1 свидетельствуют о том, что в нек-рые моменты времени сольват-ная оболочка отсутствует).
В бинарных р-рителях, состоящих из нейтрального (не-полярного) и активного (полярного) компонентов, возникает селективная сольватация, при к-рой состав сольватной оболочки резко отличается от состава р-ра в целом. Особенно сильна селективная сольватация при малых концентрациях полярного компонента.
Впервые влияние р-рителя на кинетику р-ций этерифика-ции было обнаружено М. Бертло в 1854; впоследствии Н.А. Меншуткин установил (1890), что хим. р-цию нельзя рассматривать отдельно от среды, в к-рой она протекает. Возможность теоретич. расчета влияния р-рителя на реакц. способность и статич. св-ва молекул растворенного в-ва определяется гл. обр. разработанностью теории жидкого состояния (см. Жидкость). В рамках статистич. теории, являющейся основой совр. представлений о структурных и энергетич. св-вах жидкостей и р-ров, полный потенциал F взаимод. молекулы растворенного в-ва со средой, находящейся в термодинамич. равновесии, имеет для одноцент-ровых частиц (напр., атомов благородных газов) вид:
(Q-заряд иона) и ур-ние Онсагера (модель реактивного поля):
Более точные расчеты в рамках микроскопии, подходов получены с использованием методов Монте-Карло и мол, динамики. В методе мол. динамики с помощью ЭВМ численно решают классич. ур-ния движения Ньютона, считая известной потенц. энергию взаимод. молекул. Это позволяет «наблюдать» за движением отдельных молекул жидкости, определять фазовые траектории, а затем усреднять их по времени и находить значения требуемых термодинамич. и структурных ф-ций. Метод позволяет рассчитать статич. и динамич. св-ва р-ров, в т. ч. и для неравновесных процессов. В методе Монте-Карло состояния рассматриваемой системы частиц считаются случайными, задача же состоит в отборе наиб. вероятных конфигураций и послед. усреднении по этим конфигурациям разл. св-в. Ввиду этого метод приспособлен для расчета лишь равновесных величин. Развитие ЭВМ позволяет применять оба метода ко все более широкому кругу объектов. В результате оказывается возможным корректное разделение энтальпий и своб. энергий сольватации на физически обоснованные вклады, связанные с разл. взаимод., и анализ зависимостей между ними. Методы Монте-Карло и мол. динамики позволяют рассчитывать энтальпии сольватации с точностью, сравнимой е экспериментальной (5-10 кДж/моль). Однако пока они не позволяют учитывать взаимную поляризацию р-рителя и растворенного в-ва, а также структурную перестройку в р-ре. Эти эффекты возможно определить с помощью квантовохим. расчетов, к-рые позволяют прогнозировать строение и св-ва изолир. молекул и механизмы р-ций, что необходимо для корректного выделения вклада, обусловленного непосредственно влиянием р-рителя. Поверхности потенциальной энергии молекул и реагирующих систем в газовой фазе и в р-рах могут иметь принципиально разл. профиль.
Сольватация приводит к тому, что тип р-рителя изменяет скорость хим. р-ций (до 10 9 раз), определяет относит. устойчивость таутомеров, конформеров, изомеров, влияет на механизм р-ций. Положения кислотно-основных равновесий в значит. степени определяются сольватирующей способностью р-рителя. Подробнее о влиянии сольватации на физ.-хим», характеристики растворенных в-в и их реакц. способность см. в ст. Реакции в растворах.
На влиянии сольватации на характеристики электронных спектров поглощения и испускания основано явление, наз. сольватохромией.
Процесс сольватации, различия с гидратацией и примеры
сольватации физический и химический союз между растворенными частицами и растворителем в растворе. Он отличается от концепции растворимости тем, что нет термодинамического равновесия между твердым телом и его растворенными частицами..
Этот союз ответственен за растворенные твердые вещества, «исчезающие» в глазах зрителей; когда на самом деле частицы становятся очень маленькими и в конечном итоге «обертываются» листами молекул растворителя, что делает невозможным их наблюдение.
На верхнем изображении представлен очень общий эскиз сольватации частицы М. М может быть ионом (М + ) или молекула; и S представляет собой молекулу растворителя, которая может представлять собой любое соединение в жидком состоянии (хотя оно также может быть газообразным).
Обратите внимание, что М окружено шестью молекулами S, которые составляют то, что известно как Первичная сольватная сфера. Другие молекулы S, находящиеся на большем расстоянии, взаимодействуют силами Ван-дер-Ваальса с первой, образуя вторичную сольватную сферу и так далее, пока какой-либо порядок не станет очевидным..
Процесс сольватации
Молекулярно, как проходит процесс сольватации? Изображение выше суммирует необходимые шаги.
Молекулы растворителя, синего цвета, изначально упорядочены путем взаимодействия друг с другом (S-S); и частицы (ионы или молекулы) растворенного вещества пурпурного цвета делают то же самое с сильным или слабым М-М взаимодействием.
Для того чтобы происходила сольватация, растворитель и растворенное вещество должны расширяться (вторая черная стрелка), чтобы учесть взаимодействие растворенного вещества с растворителем (M-S).
Это обязательно подразумевает уменьшение взаимодействия растворенного вещества и растворителя с растворителем; уменьшение, которое требует энергии, и, следовательно, этот первый шаг является эндотермическим.
Как только растворенное вещество и растворитель были молекулярно расширены, они оба смешиваются и меняются местами в пространстве. Каждый фиолетовый круг на втором изображении можно сравнить с тем на первом изображении.
Изменение степени упорядочения частиц может быть детализировано на изображении; упорядоченный в начале и неупорядоченный в конце. Как следствие, последний этап является экзотермическим, поскольку образование новых M-S взаимодействий стабилизирует все частицы растворения.
Энергетические аспекты
За процессом сольватации стоит учитывать множество энергетических аспектов. Во-первых: S-S, M-M и M-S взаимодействия.
Когда взаимодействия M-S, то есть между растворенным веществом и растворителем, очень превосходят (сильные и стабильные) по сравнению с взаимодействиями отдельных компонентов, мы говорим об экзотермическом процессе сольватации; и, следовательно, энергия высвобождается в среду, что можно проверить, измерив повышение температуры с помощью термометра..
Если, с другой стороны, взаимодействия M-M и S-S сильнее, чем взаимодействия M-S, то для «расширения» им потребуется больше энергии, чем они получают после окончания сольватации..
Затем говорится о процессе эндотермической сольватации. В таком случае регистрируется снижение температуры или, что то же самое, окружение охлаждается.
Межмолекулярные взаимодействия
Было упомянуто, что сольватация является результатом физического и химического соединения между растворенным веществом и растворителем; Однако, как именно эти взаимодействия или союзы?
Когда мы говорим о диполь-дипольных взаимодействиях, говорят, что в M и S. существует постоянный дипольный момент. Таким образом, богатая электронами область δ- из M взаимодействует с плохой областью электронов δ + S. Результатом всех этих взаимодействия является формирование нескольких сольватных сфер вокруг М.
Кроме того, есть еще один тип взаимодействия: координатор. Здесь молекулы S образуют координационные (или дативные) связи с М, образуя различные геометрии.
Основное правило для запоминания и предсказания сродства между растворенным веществом и растворителем: равное растворяется равным. Поэтому полярные вещества очень легко растворяются в полярных растворителях; и неполярные вещества растворяются в неполярных растворителях.
Отличия от гидратации
Чем сольватация отличается от гидратации? Два идентичных процесса, за исключением того, что молекулы S первого изображения заменены молекулами воды, H-O-H.
На верхнем изображении вы можете увидеть катион M + в окружении шести молекул H2О. Обратите внимание, что атомы кислорода (красные) направлены на положительный заряд, потому что он является наиболее электроотрицательным и, следовательно, имеет наибольшую отрицательную плотность δ-.
За первой сферой гидратации другие молекулы воды группируются водородными связями (ОН2-Огайо2). Это взаимодействия ион-дипольного типа. Однако молекулы воды также могут образовывать координационные связи с положительным центром, особенно если он металлический.
Вода, пожалуй, самый удивительный растворитель из всех: она растворяет несоизмеримое количество растворенных веществ, она слишком полярна в качестве растворителя и имеет аномально высокую диэлектрическую проницаемость (78,5 К).
примеров
Ниже приведены три примера сольватации в воде..
Хлорид кальция
мочевина
Для мочевины это органическая молекула со структурой H2N-CO-NH2. При сольватации молекулы H2Или образуют водородные мостики с двумя аминогруппами (-NH2-Огайо2) и с карбонильной группой (C = O-H)2О). Эти взаимодействия ответственны за его большую растворимость в воде.
Также его растворение является эндотермическим, то есть он охлаждает емкость для воды, куда его добавляют.
Аммиачная селитра
СОЛЬВАТАЦИЯ
Найдено 5 изображений:
Лит.: Э н т е л и с С. Г., T и г е р P. П., Кинетика реакций в жидкой фазе, M., 1973; Мат яш И. В., Вода в конденсированных средах, К., 1971; Карякин А. В., Кривей нова Г. А., Состояние воды в органических и неорганических соединениях, M., 1973. Л.А.Шиц.
взаимод. молекул растворенного в-ва (или их ассоциатов) с молекулами р-рителя. Приводит к изменению св-в молекул в р-ре (в сравнении со св-вами газовой фазы), влияет на все физ. и физ.-хим. процессы, протекающие в р-рах, в т. ч. определяет скорость реакций в растворах и положение равновесия, а в ряде случаев и их механизм. С. в водных средах часто наз. гидратацией. Наиб. интенсивна С. ионов в растворах электролитов.
С. состоит в том, что молекула растворенного в-ва оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул р-рителя. В результате С. образуются сольваты-мол. образования постоянного или переменного состава. Время жизни соль-ватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимод. время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В соответствии с типами межмол. взаимод. выделяют неспецифическую и специфическую С. Неспецифическая С. обусловлена ван-дер-ваальсовыми взаимод., специфическая С. проявляется гл. обр. вследствие электростатич. взаимод., коор-динац. и водородных связей.
Важнейшие термодинамич. характеристики С.-энталь-пия С. DHc и энергия Гиббса С. (своб. энергия С.) DGc, связанные соотношением:
Структура ближайшего окружения частицы растворенного в-ва характеризуется координационными числами С., определяемыми как кол-во молекул р-рителя, связанных достаточно долго с этой частицей, чтобы участвовать вместе с ней в диффузионном движении. Число С. зависит от природы растворенной частицы и р-рителя, а также в нек-рой степени от используемого метода определения; обычно используют данные по сжимаемости р-ра, скорости диффузии ионов, электропроводности, а также термохим. методы, электронное спиновое эхо и др. Для одновалентных ионов щелочных металлов и галогенов числа С. составляют от 0,5 до 5,0 (значения меньше 1 свидетельствуют о том, что в нек-рые моменты времени сольват-ная оболочка отсутствует).
В бинарных р-рителях, состоящих из нейтрального (не-полярного) и активного (полярного) компонентов, возникает селективная С., при к-рой состав сольватной оболочки резко отличается от состава р-ра в целом. Особенно сильна селективная С. при малых концентрациях полярного компонента.
При исследовании динамич. поведения молекул в р-рах, их реакц. способности, для описания С. короткоживущих состояний используют понятие неравновесной С. (неравновесной среды), при к-рой состав и строение сольватных оболочек не отвечают минимуму своб. энергии системы, достижимому при условии бесконечности времени жизни данных состояний. Напр., состояния молекул, из к-рых происходит оптич. (излучательный) квантовый переход, всегда сольватированы неравновесно. Неравновесность среды определяется как вращательными, так и трансляц. степенями свободы молекул р-рителя. Релтаксация среды к равновесию происходит по закону ехр(-t/т L), где t- время, т L— характеристика релаксац. способности р-рителя. Для воды, напр., т L = 0,25