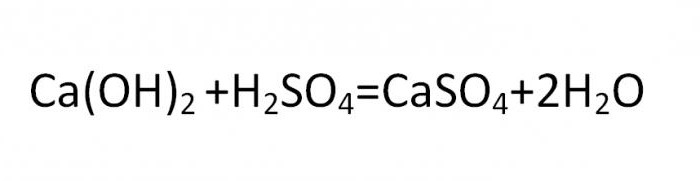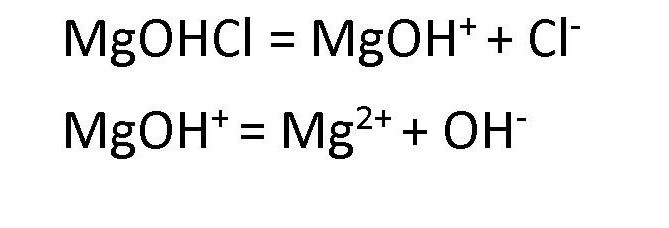Что такое солями в химии
Что такое солями в химии
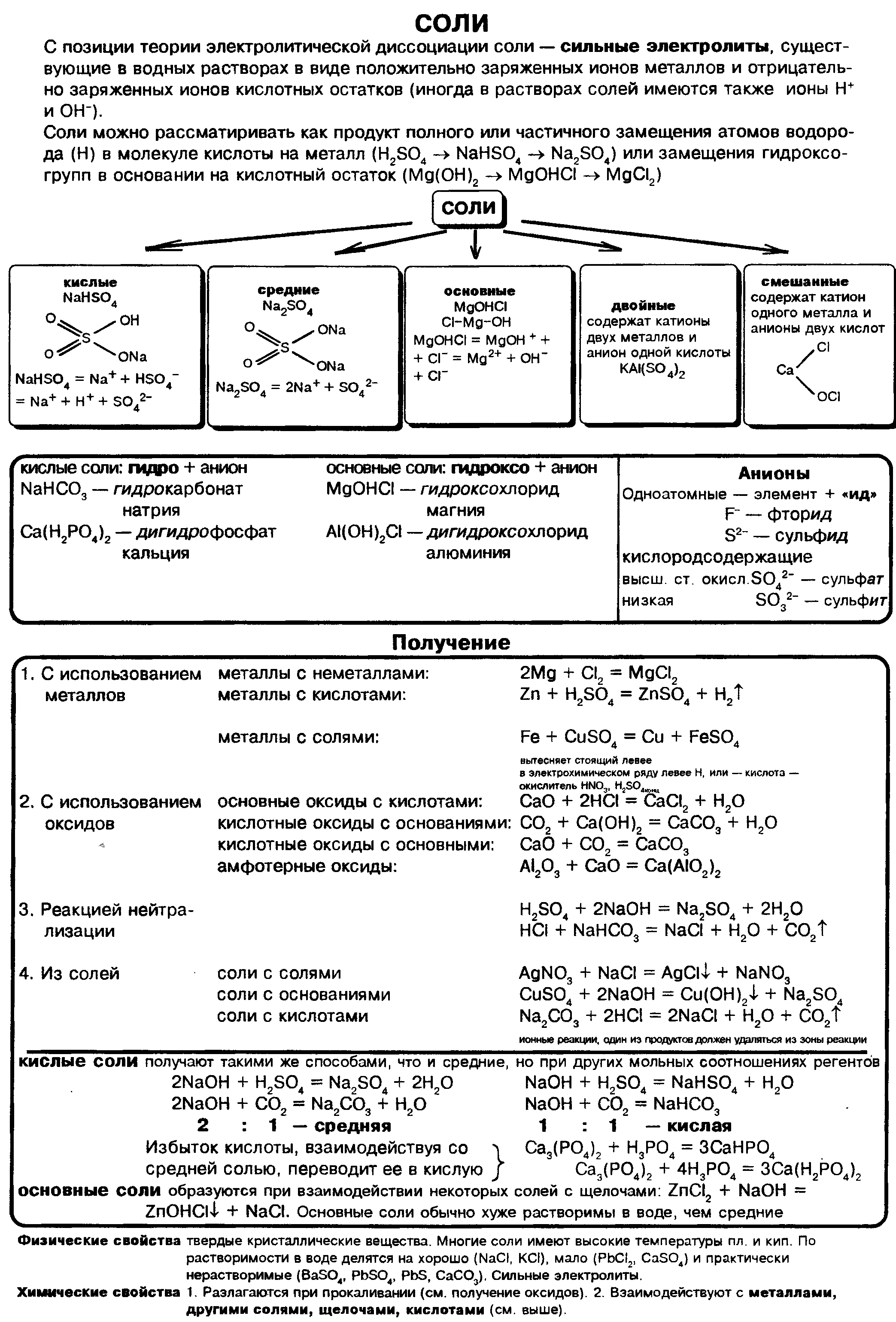
Генетические ряды металла и неметалла завершает класс солей:
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Сoли — это вещества немолекулярного строения. Химическая связь между катионами металлов и анионами кислотных остатков в солях ионная. Формулы солей составляют таким образом, чтобы суммарный заряд ионов металлов и соединенных с ними кислотных остатков был одинаков по величине и противоположен по знаку.
Соли — многочисленный класс соединений. Насколько это понятие применимо для органических соединений?
Лабораторный эксперимент.
Соберите прибор для получения газов и проверьте его герметичность. В пробирку налейте 3—4 мл соляной кислоты и опустите в неё 2—3 небольших кусочка мрамора. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку объёмом 20 мл с 5—6 мл известковой воды. Пропускайте через известковую воду полученный оксид углерода(IV). Что наблюдаете? Продолжайте пропускать углекислый газ до растворения осадка.
Полученную жёсткую воду разлейте в три пробирки.
К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете?
Вторую пробирку закрепите в пробиркодержателе и нагрейте до кипения. Прекратите нагревание и рассмотрите содержимое.
В третью пробирку добавьте раствор стиральной соды. Что наблюдаете?
При выполнении этого эксперимента были исследованы свойства солей двух типов: средних и кислых.
К первым относятся карбонат кальция СаСO3 (он составляет химическую основу мрамора), хлорид кальция СаСl2, карбонат натрия Na2CO3 (или стиральная сода) и стеарат натрия С17Н35СОONa (мыло).
Напомним, что мыла — это натриевые и калиевые соли жирных кислот: RCOONa — твёрдое мыло, RCOOK — жидкое мыло.
В эксперименте вы также использовали кислые соли — гидрокарбонат кальция Са(НСO3)2 и гидрокарбонат натрия NaHCO3. Запишем уравнения проделанных реакций.
1) Получение углекислого газа:
СаСO3 + 2НСl = СаСl2 + СO2↑ + Н2O
2) Взаимодействие углекислого газа с известковой водой с образованием нерастворимого карбоната кальция:
СO2 + Са(ОН)2 = СаСO3↓ + Н2O
3) Превращение нерастворимого карбоната в растворимый гидрокарбонат:
СаСO3 + СO2 + Н2O = Са(НСO3)2
4) Диссоциация растворимого гидрокарбоната кальция, обусловливающего жёсткость воды:
Са(НСO3)2 = Са 2+ + 2НСО3 –
Жёсткость воды и способы её устранения.
Вода называется жёсткой, если содержит катионы кальция, магния и железа. В жёсткой воде хуже мылится мыло, увеличивается расход стирального порошка, образуется накипь в системах отопления и горячего водоснабжения и т. д.
Умягчение жёсткой воды проводят разными способами:
Различают временную (устраняется кипячением) и постоянную (устраняется добавкой соды и другими способами) жёсткость воды.
Эксперимент показал различия в свойствах средних и кислых солей: карбонат кальция нерастворим, а гидрокарбонат — растворим. Переход гидрокарбоната кальция в карбонат наблюдается и в природе: рост сталактитов и сталагмитов в пещерах.
В повседневной жизни различия свойств кислых и средних солей мы наблюдаем при использовании стиральной, или технической, соды Na2CO3 (умягчает воду; применяется при стирке белья) и питьевой, или пищевой, соды NaHCO3 (применяется в хлебопечении, изготовлении шипучих напитков, для устранения изжоги).
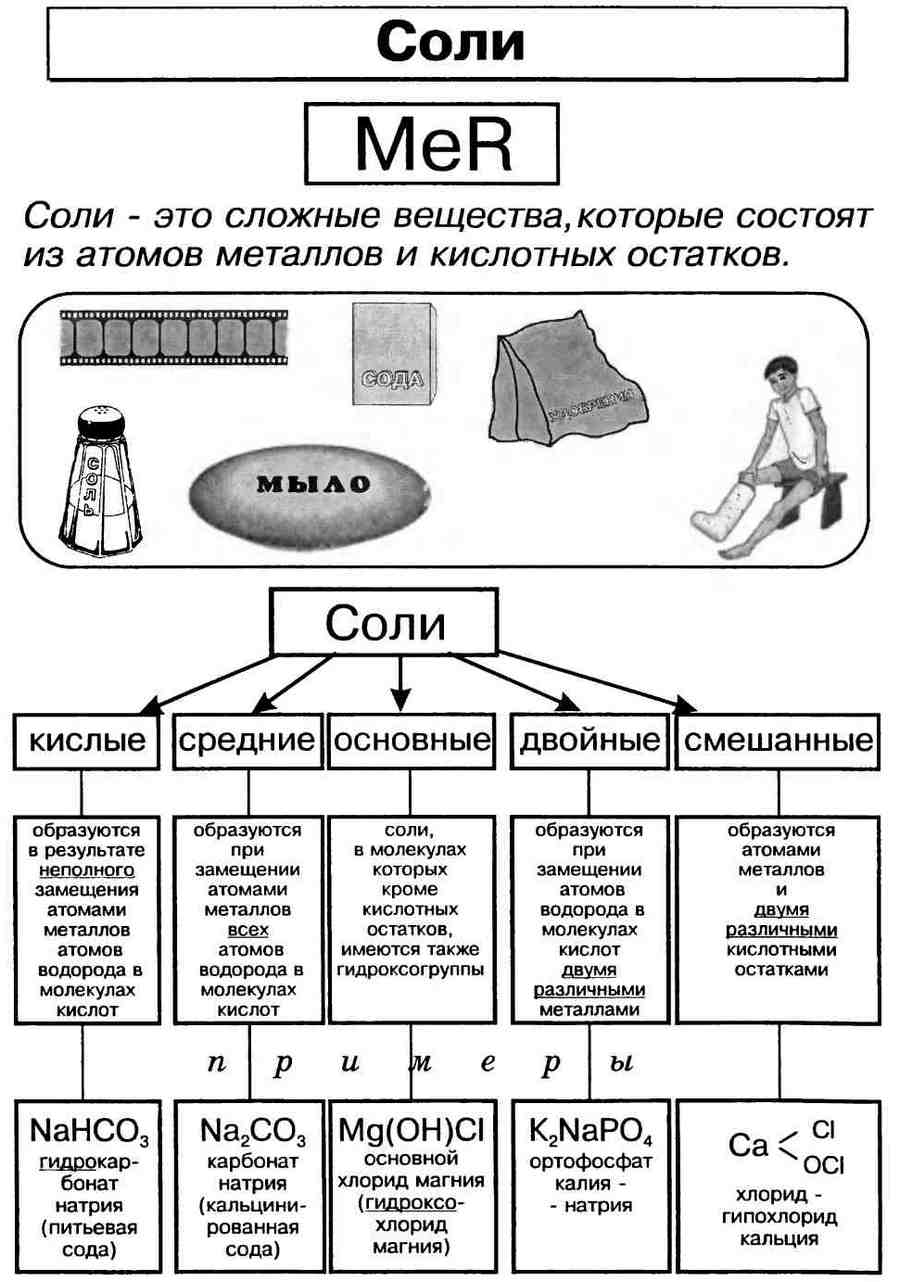
Классификация солей.
Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
Кислая соль образуется в результате неполного замещения катионов водорода в кислоте на катионы металла.
Однако если в основании, содержащем две или более гидроксогруппы, заменить одну группу на кислотный остаток, получается соль. Такую соль относят к основным солям. Например, гидроксохлорид магния MgOHCl, гидроксобромид цинка ZnOHBr.
Основная соль образуется в результате неполного замещения анионов гидроксогруппы в основании на анионы кислотного остатка.
Самая известная основная соль — гидроксокарбонат меди(II) (СuOН)2СO3, или малахит.
Кислотные остатки солей образуют и амфотерные гидроксиды. Наиболее известная соль такого типа — знаменитая благородная шпинель, венчающая корону Российской империи. Химическую основу этого минерала составляет алюминат магния Mg(AlO2)2, или MgAl2O4.
Несолеобразующие или безразличные оксиды (не образуют солей) — СО, NO, N2O.
Названия солей.
Названия солей складываются из двух слов: латинского названия кислотного остатка и русского названия металла в родительном падеже. Формулы читают справа налево.
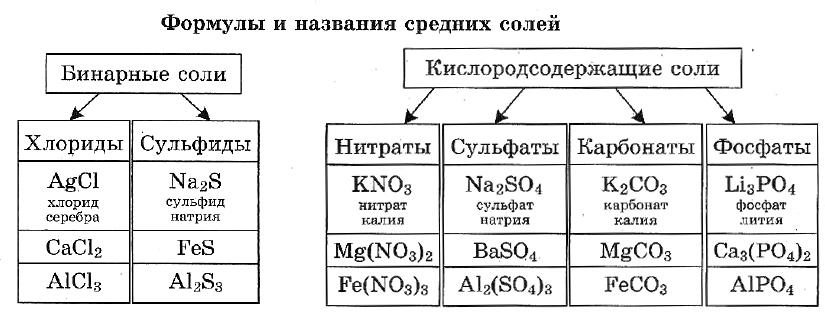
Название бинарной соли содержит суффикс «-ид»: ZnS — сульфид цинка, ВаСl2 — хлорид бария.
Названия кислородсодержащих солей чаще всего имеют в первом слове суффикс «-ат»: Mn(NO3)2 — нитрат марганца(II), Cr2(SO4)3 — сульфат хрома(III), K2SiO3 — силикат калия.
Общие химические свойства солей
Всё о соли кратко в одной таблице
Конспект урока по химии «Соли». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Что такое соль? Формула, свойства соли (химия)
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.
Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
Me n m Кислотный остаток m n.
Физические свойства соли
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200 о С.
По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.
Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
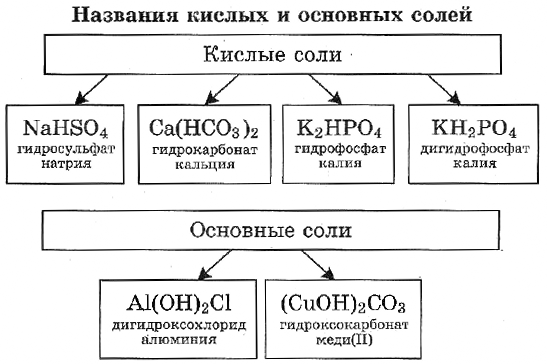
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия:
Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
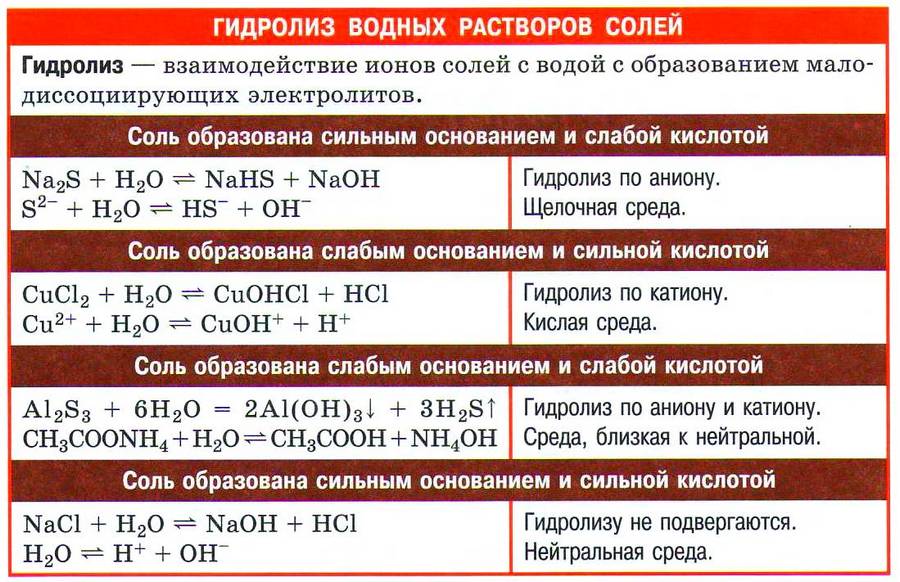
Свойства солей в электролитах
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.
Растворы основных солей
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
Что такое солями в химии
3. Взаимодействие с металлами CuSO4 + Fe = FeSO4 + Cu;
Но, если металл взаимодействует с водой, то CuCl 2 + 2К + 2 H 2 O = 2К Cl + Cu (ОН)2↓+ Н2↑;
Растворимые соли взаимодействуют с щелочами, если в результате образуется нерастворимое соединение
4. Взаимодействие с сильными и менее летучими кислотами:
Соли слабых кислот взаимодействуют с более сильными, менее летучими кислотами
5. Взаимодействие с солями
Растворимые соли взаимодействуют между собой, если образуется нерастворимая соль:
6. Нерастворимые соли и соли летучих кислот разлагаются при нагревании:
2 С u(NO3)2 = 2 CuO+ 4 NO2↑+ O2↑ (продукты разложения нитратов определяются активностью металла см. разложение нитратов)
2BaSO 4 → 2BaO + 2SO 2 + O 2
Под действием электрического тока соли в растворах и расплавах подвергаются разложению см. электролиз
В расплаве: 2 NaCl = 2 Na + Cl 2;
В растворе: 2 NaCl + 2 H 2 O = 2 Na ОН + Cl 2 ↑ + Н2↑
Металл с неметаллом : Fe + S = FeS (нагревание)
Металл с кислотой: Zn +2 HCl = Zn Cl 2 + H 2 ↑
Металл с солью: CuSO 4 + Fe = Fe SO 4 + Cu
Металл со щелочью: 2 NaOH + Zn = Na 2 ZnO 2 + H 2 ↑
Основные оксиды с кислотными и амфотерными оксидами:
Основные оксиды с кислотой: CaO + 2 HCl = CaCl 2 + H 2 O
Соль с неметаллом: KI + Cl 2 = KCl + I 2
Основание с кислотой: HCl + NaOH = NaCl + H 2 O – р-я нейтрализации
Кислоты с солями слабых и летучих кислот: BaCl 2 + Н2 SO 4 = BaSO 4 ↓+ 2Н Cl
Щелочи с растворимыми солями: 3 NaOH + FeCl 3 = Fe ( OH )3 ↓ + 3 NaCl
Растворимые соли друг с другом: BaCl 2 (р) + Na 2 SO 4 (р) = BaSO 4 ↓+ 2 NaCl
Соли с кислотными оксидами: Na 2 CO 3 + SiO 2 = Na 2 SiO 3 + CO 2
Кислотные оксиды со щелочами: SO 3 + 2 NaOH = Na 2 SO 4 + H 2 O ;
Общие сведения
Все соли имеют сложный химический состав и в зависимости от него могут быть органическими или неорганическими. В теоретической химии существует несколько определений этой группы веществ:
Кроме металлов, к кислотным остаткам могут присоединяться ионы аммония (NH4)+, гидроксония (Н3О)+, фосфония (РН4)+ и некоторые другие. С физической точки зрения чаще всего соли — это твердые кристаллические вещества. Встречаются вещества разной окраски. Прозрачные единичные кристаллы в большом количестве имеют белый цвет, например, поваренная соль NaCl.
Их строение представляет собой кристаллическую решетку, в узлах которой находятся анионы, а катионы занимают пространство между узлами. Другое распространенное строение — анионные фрагменты из кислотных остатков, соединенные в бесконечную цепочку, в трехмерных полостях которых находятся катионы. Такую структуру имеют силикаты, что отражается и на их свойствах: высокая температура плавления и неспособность проводить электрический ток.
Кроме ионных, в молекулах солей встречаются и молекулярные ковалентные связи, и промежуточные между ковалентными и ионными. В особую группу солей выделяются так называемые ионные жидкости, температура плавления которых ниже 100 °C, отличающиеся повышенной вязкостью.
Для изучения химических и физических свойств этой группы соединений важным критерием служит их растворимость в воде: полностью, частично или нерастворимые.
Классификация и номенклатура
Основные классы этой группы веществ были описаны французским химиком и аптекарем Г. Руэлем еще в 1754 году, а по мере развития химии к ним добавились новые. Главный принцип классификации солей основан на том, что при взаимодействии металла и кислоты в ней происходит частичное или полное замещение атомов водорода.
Общие характеристики
Формулы солей всегда образуются одним или несколькими металлами, кислотными остатками и гидроксильными группами. В зависимости от этого все солевые соединения делят на такие классы:
Средними считаются те, у которых все атомы водорода образующей кислоты заменены атомами металла. К такому типу соединений относятся и те, в которых водород замещается одновалентной группой аммония NH4. Согласно принятой номенклатуре, названия этих веществ образуются из латинского названия кислотного остатка и русского названия металла. Кислородосодержащие остатки оканчиваются на «ат», бескислородные — на «ид». Например:
Если одному химическому элементу соответствует не одна кислота, то может использоваться и окончание «ит». Это относится к таким кислотам, как серная H2SO4 (сульфаты) и сернистая H2SO3 (сульфиты).
Кислые вещества образуются только от двух- или полиосновных кислот: серной, фосфорной, угольной. Они относятся к неустойчивым соединениям и при нагревании происходит их разложение на составляющие элементы. В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
Образование основных солей происходит при частичном замещении гидроксильных групп кислотными остатками, причем валентность основного остатка всегда будет равна числу замещенных гидроксильных групп. Номенклатура названий таких химических соединений образуется в зависимости от количества гидроксогрупп приставками «гидроксо» и «дигидроксо»:
В двойных солях атомы водорода замещаются двумя разными металлами, соответственно и образовываться могут только от двух и более основных кислот: MgK (SO4)2, NaKCO3, KAl (SO4)2.
Комплексные соединения и кристаллогидраты
Этот класс химических соединений отличается большим разнообразием. В изучении комплексных солей (КС) большую роль сыграли швейцарский ученый А. Вернер и русский химик немецкого происхождения В. Освальд. КС состоят из комплексных частиц. Центральный элемент в комплексе называется комплексообразователем, а связанные с ним элементы — лигандами. Их число — это координационное число соединения. Лигандами могут быть как нейтральные молекулы, так и разнообразные ионы и катион водорода H+.
КС так и классифицируются на нейтральные, анионные и катионные. Разными лигандами образуются такие группы химических веществ:
Кристаллы, образующиеся в водном растворе при выпадении в осадок солей, называются кристаллогидратами. При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10H2O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2H2O — дигидрат сульфата кальция.
Исторические наименования
Названия химических веществ соответствуют международной системе правил, позволяющей давать им названия, по которым можно правильно составить их формулу. Многие соединения солевой группы давно и хорошо известны, и в процессе их использования химики много лет назад уже как-то называли их. Традиционные или тривиальные названия полезно знать любому человеку. Их список приведен в таблице:
| Соль | Номенклатурное название | Тривиальное название |
| CuSO4⋅5H2O | Пентагидрат сульфата меди | Медный купорос |
| CaCO3 | Карбонат кальция | Известняк |
| AgNO3 | Нитрат серебра | Ляпис |
| NaHCO3 | Гидрокарбонат натрия | Питьевая сода |
| K2СO3 | Карбонат калия | Поташ |
| HgCl2 | Хлорид ртути | Сулема |
| Na2SiO3 | Силикат натрия | Жидкое стекло |
Это далеко не полный перечь общеизвестных наименований. Какой-либо системе они не подчиняются, и тем, кто изучает химию, их надо просто запомнить.
Химические свойства
Соли как химические соединения проявляют разные свойства в зависимости от их структурного состава. В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
Некоторые соли под действием температуры могут разлагаться. Например, при нагревании из карбоната кальция СаСO3 получается оксид кальция СаO и кислотный оксид СО2. Солевые вещества, образованные от бескислородных кислот, разлагаются на простые элементы: хлорид серебра AgCl распадается на серебро Ag с выделением хлора Cl. Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Взаимодействие с оксидами и кислотами
Соли реагируют путем сплавления с кислотными или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. С основными оксидами такая реакция не происходит. Например, карбонат калия K2CO3 сплавляется с оксидом кремния (IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 может взаимодействовать и с оксидом алюминия, при этом получается алюминат калия KAlO2 и углекислый газ CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Взаимодействие с кислотами может происходить только в том случае, если в реакцию вступает кислота и соль, образованная более слабой кислотой. Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 вступает в реакцию с сильной серной кислотой: MgCO3 + H2SO4 → MgSO4 + 2H2O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, потому что в ходе реакции ожидается получение нерастворимой кремниевой кислоты: K2SiO3 + 2HCl → H2SiO3↓ + 2KCl.
Реакции с основаниями и другими солями
Со щелочами взаимодействуют в основном только соли аммония и тяжелых металлов, если при этом они относятся к растворимым. В результате получают новое солевое вещество и новое основание. Например, в реакцию с гидроксидом калия KOH вступает сульфат меди (II) CuSO4, в результате чего образуется сульфат калия K2SO4, а гидроксид меди Cu (OH) выпадает в осадок: 2KOH + CuSO4 → K2SO4 + Cu (OH)2.
Взаимодействие хлорида аммония с гидроксидом натрия описывается таким уравнением (NH4)2SO4 + 2KOH → 2H2O + K2SO4 + 2NH3↑. Если воздействовать основанием на кислую соль, то в результате получится средняя соль и вода. Например, гидрокарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + H2O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, при этом образуются две новые соли. С нерастворимым соединением взаимодействие не случается. Некоторые вещества, относящиеся к кислым, реагируют со слабокислыми солями и со своими средними соединениями.
Получение и применение
Многие соединения солей всех видов встречаются в виде залежей минеральных пород и рассолов. Например: известняк, разные виды селитры, поваренная и калийная соли, сильвин, карналлит, натрон, мирабилит и многие другие. Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Больше всего химическая промышленность выпускает солей для сельского хозяйства, причем они используются как в качестве удобрений для хорошего роста растений и повышения урожайности, так и для их защиты от сорняков и вредителей. Минеральные соли используют и как сырье для производства самых разнообразных химических веществ, применяемых в таких отраслях:
В качестве присадок и плавней соли применяются в металлургии для обогащения руд и при выплавке металлов. Производство цемента, одного из самых важных для строительной промышленности компонента, невозможно без известняка. Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.