Что такое соматическая мутация в биологии
Мутации
Но это в кино, в биологии тоже так, но немного более научно, менее фантастично и более обыденно.
Мута́ция (в переводе — изменение) — устойчивое, передающееся по наследству изменение ДНК, происходящее под влиянием внешних или внутренних изменений.
Обыденность в том, что эти изменения (мутации) происходят в природе и у человека постоянно, почти каждодневно.
Соматические мутации
Генеративные мутации
Передаются при вегетативном (бесполом размножении).
Передаются по наследству.
Разберем сначала виды генеративных мутаций.
Генные мутации
Что такое ген? Это участок ДНК (т.е. несколько нуклеотидов), соответственно, это и участок РНК, и участок белка, и какой-либо признак организма.
Вообще, это не всегда ведет к болезни. Например, при удвоении ДНК случаются такие “ошибки”. Но они возникают редко, это очень малый процент от всего количества, поэтому они незначительны, что практически не влияют на организм.
Геномные мутации
Вот классическое определение термина “геном”:
— совокупность наследственного материала, заключенного в клетке организма;
— геном человека и геномы всех остальных клеточных форм жизни, построены из ДНК;
— совокупность генетического материала гаплоидного набора хромосом данного вида в парах нуклеотидов ДНК на гаплоидный геном.
Для понимания сути мы очень сильно упростим, получится такое определение:
Примеры (некоторые перестройки такого рода есть у большинства людей и вообще никак не отражаются ни внешне, ни на здоровье, но есть и неприятные мутации):
— синдром кошачьего крика у ребенка
— задержка в развитии
и т.д.
Соответственно, есть мутации, вызванные изменениями именно в этих структурах.
Соматические мутации.
Это все описанные выше виды, но возникают они в клетках тела ( в соматических клетках).
Мутантных клеток обычно намного меньше, чем нормальных, и они подавляются здоровыми клетками. (Если не подавляются, то организм перерождаться или болеть).
Примеры:
— у дрозофилы глаз красный, но может иметь белые фасеты
— у растения это может быть целый побег, отличающийся от других (И.В. Мичурин таким образом выводил новые сорта яблок).
— раковые клетки у человека
Примеры вопросов ЕГЭ:
Синдром Дауна является результатом мутации
Генные мутации связаны с изменением
А) числа хромосом в клетках;
Б) структуры хромосом;
B) последовательности генов в аутосоме;
Г) нуклеогидов на участке ДНК.
Мутации, связанные с обменом участками негомологичных хромосом, относят к
Животное, в потомстве которого может появиться признак, обусловленный соматической мутацией
Что такое ДНК и хромосомы
Что такое ДНК, и из чего она состоит? Кто и когда открыл эту молекулу в клетках человека и других живых организмов? Чем уникален открытый учеными механизм наследования, и какие последствия ждал весь мир после этого открытия? Всю необходимую информацию Вы можете узнать, прочитав эту статью.
Когда впервые в истории появилось упоминание о ДНК
Иоганнес Фридрих Фишер – врач и биолог-исследователь родом из Швейцарии, стал первым в мире ученым, выделившим нуклеиновую кислоту. Открытие случилось в 1869 году, когда он занимался изучением животных клеток, а именно лейкоцитов, которых много содержалось в гное. Совершенно случайно молодой ученый заметил, что при отмывании лейкоцитов с гнойных повязок от них остается загадочное соединение. Под микроскопом Иоганн обнаружил, что оно содержится в ядрах клеток. Это соединение Мишер назвал нуклеином, а в процессе изучения его свойств переименовал в нуклеиновую кислоту, из-за наличия свойств, как у кислот.
Роль и функции только открытой нуклеиновой кислоты были неизвестны. Однако многие ученые того времени уже высказывали свои теории и предположения о существовании механизмов наследования.
Нынешние взгляды на состав молекулы ДНК ассоциируются у людей с именами английских ученых Джорджа Уотсона и Фрэнсиса Крика, которые открыли структуру данной молекулы в 1953 году. За несколько лет до этого, в тридцатые годы, ученые из советского союза А.Н. Белозерский и А.Р. Кезеля доказали наличие ДНК в клетках во всех живых организмах, тем самым они опровергли теорию о том, что молекула ДНК находится только в клетках животных, а в клетках растений присутствует только РНК. Лишь спустя несколько лет, в 1944 году, группой освальдских ученых было установлено, что молекула ДНК является механизмом сохранения наследственной информации клетки. Таким образом, благодаря совместным усилиям и трудам исследователей человечество познало тайну процесса эволюции и его основных принципов.
ДНК в медицине
Открытие состава молекулы дезоксирибонуклеиновой кислоты позволило перейти медицине на новый уровень развития. Появилось большое количество новых направлений практической медицины, стали доступны новые методы лечения, диагностики. Благодаря этому фундаментальному открытию для науки и современным технологиям, человечеству стали доступны:
И это еще не все доступные для людей услуги, которые может предложить медицина, изучающая генетику. Выше были представлены только самые популярные среди людей тесты. Перспективой для многих ученых-генетиков является создание таких лекарств, способных победить все болезни на Земле и даже смертность.
Строение молекулы ДНК
От цепочки к хромосоме
В каждом живом организме находится миллионы клеток, а внутри этих клеток находится ядро. Клетки, содержащие в себе ядро, называются эукариотами или ядерными. У древних одноклеточных нет оформленного ядра. К таким безъядерным одноклеточным, или прокариотам, относятся бактерии и археи, например, кишечная палочка или серая анаэробная бактерия. Также ядро отсутствует в клетках вирусов и вироидов, однако причисление вирусов к живым организмам – вопрос спорный, о котором по сей день дискуссируют ученые.
В ядре находятся хромосомы – структурный элемент, в котором содержится молекула ДНК в виде спирали, хранящая внутри себя всю генетическую информацию клетки.
Процесс упаковки ДНК спиралей
Количество нуклеотидов в ДНК велико, и нужны длинные цепочки, чтобы вместить все их число, поэтому нити ДНК закручиваются в две спирали, что позволяет укоротить цепочки в 5 раз, сделав их более компактными. Нити ДНК могут также закручиваться в форму суперспирали. Двойная спираль пересекает свою ось и накручивается на специальные гистоновые белки – гиразы, образуя при этом супервитки. Таким образом, двойная спираль закручивается в спираль более высокого порядка. Сокращение цепочек в этом случае произойдет в 30 раз.
Как гены связаны с ДНК
Ген – самый изученный на сегодняшний день участок ДНК. Гены являются структурной единицей наследственности всех живых организмов. Цепочки нуклеотидов в ДНК состоят из генов, которые определяют генотип особи, например, цвет и разрез глаз, тип кожи, рост, группу и резус фактор крови и другие физиологические качества и особенности внешности.
Еще много отраслей генетики до конца не изучены, и до конца не раскрыты все функции генома, но ученые до сих пор продолжают изучение генов, чтобы добиться новых открытий в области генетики.
Хромосома: определение и описание
Хромосомы – структурный элемент клетки, находящийся внутри ядра. Они содержат в себе молекулы ДНК, в которых содержится вся наследственная информация.
Строение и виды хромосом:
Отсюда возникают различные типы хромосом:
Всего в клетке человека находится 46 хромосом: 22 пары аутосом, встречающиеся у обоих полов, и одна пара половых хромосом: XY – у мужчин, XX – у женщин. Забавно, что если прибавить к количеству хромосом хотя бы одну пару, то человек мог бы быть шимпанзе или тараканом, а если отнять, то – кроликом.
Еще интересно то, что человек и ясень имеют одинаковое количество хромосом, несмотря на принадлежность к разным видам и царствам.
Наследственные болезни
Генетический код – система записи генетической информации в ДНК и РНК в виде определенной последовательности в цепочке нуклеотидов. Он должен сохранять наследственную информацию в первоначальном виде, восстанавливая повреждения цепочки в последующем поколении с помощью ДНК. Однако ген может каким-то образом быть поврежден, либо в нем может произойти мутация.
Генные мутации – изменение в последовательности нуклеотидов, например выпадение, замена, вставка другого нуклеотида в цепочку. Последствия этих мутаций могут быть полезные, вредные или нейтральные. Примером полезных мутаций является устойчивость к минусовым температурам, увеличенная плотность костей, меньшая потребность во сне, устойчивость к ВИЧ и другие. Примером вредных мутаций является аллергия на солнечный свет, глухота слепота и так далее. К нейтральным мутациям относятся те мутации, которые не влияют на жизнеспособность, например, гетерохромия.
Существуют также летальные и полулетальные мутации. Летальные мутации несовместимы с жизнью и приводят к гибели организма на ранних этапах его развития, например, при рождении у особи отсутствует головной мозг. Полулетальные мутации не приводят к смерти особи, но значительно уменьшают ее жизнеспособность. К таким мутациям относятся заболевания человека, передающиеся по наследству. Например, наличие 47-й хромосомы может вызвать у человека синдром Дауна, а, наоборот, отсутствие 46-й парной хромосомы – сидром Шерешевского-Тернера.
Расшифровка цепочки ДНК
Расшифровка цепочки ДНК в клетке – это исследование всех известных генов в клетках человека. Хоть цена за такую услугу значительно упала за последние десять лет, однако такое исследование по-прежнему остается дорогим удовольствием, и не каждый человек сможет позволить себе оплатить такую услугу. Чтобы уменьшить цену этого исследования, расшифровку ДНК стали делить по тематикам. Таким образом, появились различные тесты, которые исследуют интересующую человека группу генов и ее функции.
Как происходит расшифровка цепочки ДНК?
Таким образом, ученые получают картину гена, которую можно изучить и расшифровать. Синтез РНК Нуклеотиды делятся на четыре базовых элемента, служащими основой для формирования генов: АТГЦ, или аденин, тимин, гуанин, цитозин. В их состав входят фосфорные остатки, азотистые основания и пептоза.
Важно, что молекула дезоксирибонуклеиновой кислоты не должна выходить за пределы мембраны ядра. С помощью РНК, которая играет роль копии участка цепи с генетическим кодом, генетическая цепочка может покинуть ядро, попасть вовнутрь клетки и воздействовать на ее внутренние процессы.
Как это происходит:
Итак, группа генов, участвующих в процессе старения клеток может, как заставить процесс старения идти быстрее, так и вовсе его остановить и запустить процесс омолаживания. То есть, каждый из генов может спровоцировать синтез нескольких видов белка.
Сутягина Дарья Сергеевна
В нашей ДНК содержится очень много информации, но пока мы можем расшифровать лишь небольшой процент генов. Добавлю несколько интересных фактов о ДНК: возможность двойной ДНК у человека. Такое явление случается, когда при беременности в утробе развиваются близнецы, но в процессе развития плода они сливаются в одного человека. Длина одной молекулы ДНК человека равна 2 метрам, а общая длина цепочки ДНК всех клеток тела человека равна 16 млрд. километрам, что равно расстоянию от Земли до Плутона. ДНК человека и кенгуру всего лишь 150 млн. лет назад были одинаковыми. Все знания и информация во всем мире могла бы уместиться всего лишь в 2 граммах дезоксирибонуклеиновой кислоты.
ООО «Медикал Геномикс» Лицензия № ЛО-69-01-002086 от 06.10.2017
Юр. адрес: г. Тверь, ул. Желябова, 48
ООО «Лаб-Трейдинг», ИНН: 6950225035, ОГРН: 1186952017053, КПП:695001001
Юр. адрес: г. Тверь, ул. 1-Я За Линией Октябрьской Ж/Д, 2, оф. 22
Что такое соматическая мутация в биологии
Последовательность ядерной ДНК у любых двух человек идентична почти на 99,9%. Только очень небольшая доля последовательности ДНК различается у разных людей, обеспечивая генетическую изменчивость. Некоторые различия в последовательности ДНК не имеют влияния на фенотип, тогда как другие — непосредственные причины болезней. Между двумя крайностями — изменения, ответственные за генетически предопределенную фенотипическую изменчивость в анатомии и физиологии, переносимость пищи, реакции на лечение или побочные эффекты медикаментов, восприимчивость к инфекциям, склонность к опухолям и, возможно, даже изменчивость в различных чертах личности, спортивных способностях и художественном таланте.
Одно из важных понятий генетики человека и медицинской генетики — то, что генетические болезни — только наиболее очевидное и часто крайнее проявление генетических различий, один конец непрерывного спектра изменений от редких вариантов, вызывающих болезнь, через более частые варианты, увеличивающие восприимчивость к болезни, до наиболее частых изменений, не имеющих явного отношения к болезни.
Виды мутаций у человека
Мутация — любое изменение в последовательности нуклеотидов или расположения ДНК. Мутации можно классифицировать на три категории: влияющие на количество хромосом в клетке (геномные мутации), изменяющие структуру отдельных хромосом (хромосомные мутации) и изменяющие индивидуальные гены (генные мутации). Геномные мутации — изменения числа неповрежденных хромосом (анеуплоидии), возникающие вследствие ошибок в расхождении хромосом в мейозе или митозе.
Хромосомные мутации — изменения, затрагивающие только часть хромосомы, например частичные дупликации, делеции, инверсии и транслокации, которые могут происходить спонтанно или возникать вследствие аномального расхождения транслоцированных хромосом в ходе мейоза. Генные мутации — изменения в последовательности ДНК ядерного или митохондриального генома, от мутации в единственном нуклеотиде до изменений, захватывающих много миллионов пар оснований. Множество типов мутаций представлены разнообразными аллелями в отдельных локусах при более чем тысяче разных генетических заболеваний, а также среди миллионов вариантов ДНК, обнаруживаемых во всем геноме в нормальной популяции.
Описание разных мутаций не только увеличивает осведомленность о генетическом разнообразии человека и хрупкости человеческого генетического наследия, но также содействует получению информации, необходимой для обнаружения и скрининга генетических болезней в конкретных семьях риска, а также — для некоторых болезней — в популяции в целом.
Геномная мутация, приводящая к утрате или дублированию целой хромосомы, изменяет дозу и, таким образом, уровень экспрессии сотен или тысяч генов. Аналогично затрагивающая большую часть одной или нескольких хромосом хромосомная мутация также может влиять на экспрессию сотен генов. Даже небольшая генная мутация может иметь большие последствия, в зависимости от того, какой ген затронут и к чему приводит изменение в экспрессии этого гена. Мутация гена в виде изменения единственного нуклеотида в кодирующей последовательности может вести к полной утере экспрессии гена или образованию белка с измененными свойствами.
Некоторые изменения ДНК, тем не менее, не имеют фенотипических эффектов. Хромосомная транслокация или инверсия может не влиять на критическую часть генома и абсолютно не иметь фенотипических эффектов. Мутация в пределах гена может не иметь эффекта вследствие того, что либо не изменяет аминокислотную последовательность полипептида, либо, даже если это происходит, изменение в закодированной аминокислотной последовательности не изменяет функциональные свойства белка. Следовательно, не все мутации имеют клинические последствия.
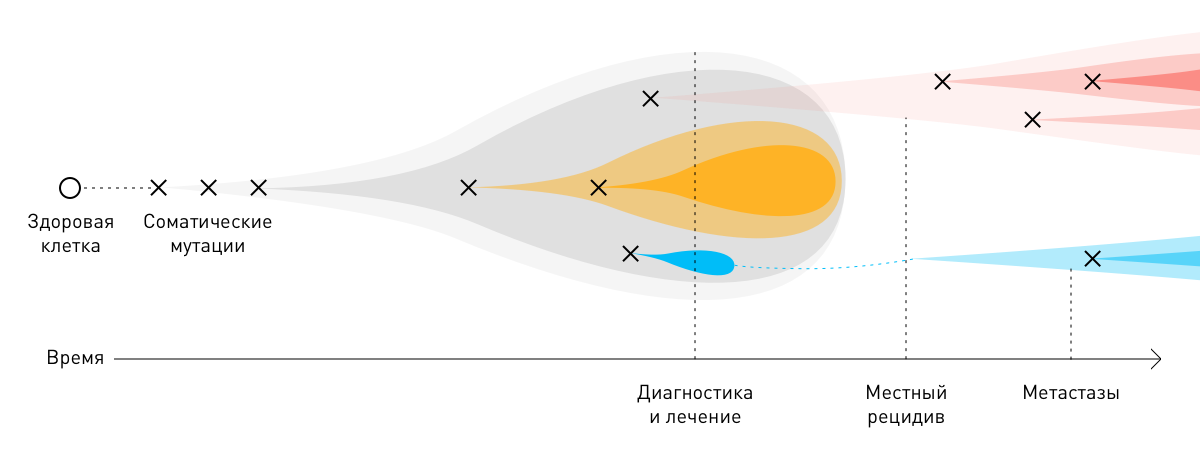
Все три типа мутаций происходят со значимой частотой во множестве разных клеток. Если мутация происходит в ДНК половых клеток, она может передаваться последующим поколениям. В отличие от этого, соматические мутации происходят случайным образом только в части клеток определенных тканей, приводя к соматическому мозаицизму, наблюдаемому, например, при многих опухолях. Соматические мутации не могут передаваться последующим поколениям.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Соматические мутации в опухоли
Мутация — любое изменение в молекуле ДНК либо структуре хромосом. Изменения, которые происходят в гаметах — половых клетках, называют герминальными, в любых других клетках организма — соматическими. Герминальные мутации передаются от родителей по наследству в виде генетических заболеваний. Соматические изменения не наследуются, а возникают в результате внешних воздействий (курения, радиоактивного излучения и других).
Доказано, что злокачественные опухоли в 90–95 % случаев возникают в результате соматических мутаций (спорадический рак). Наследственный рак, развивающийся в результате герминальных изменений, составляет 5–10 % от всех случаев заболевания.
Клеточные механизмы возникновения рака: протоонкогены и онкосупрессоры
Соматические мутации увеличивают шанс превращения здоровых клеток в раковые за счет активации онкогенов — генов, стимулирующих образование злокачественных опухолей. Онкогены образуются из обычных генов — протоонкогенов.
Деление клеток опухоли и разрастание опухолевой ткани тормозят антионкогены — гены-супрессоры. Протоонкогены и гены-супрессоры образуют систему стимуляции и подавления злокачественного процесса.
В подавляющем большинстве случаев раковые опухоли возникают из одной клетки в результате двух последовательных мутаций: первичной (герминальной) и вторичной (соматической). Для развития новообразования достаточно 3–6 таких повреждений. Вызванные ими изменения постепенно накапливаются в ДНК, вызывают неконтролируемое размножение пораженных клеток и образование атипичных тканей.
Драйверные соматические мутации и их использование для лечения злокачественных опухолей
В этиологии опухолей изменения в клетках вызывают ошибки копирования ДНК при делении — соматические драйверные мутации. В одних органах и тканях стволовые клетки делятся чаще, чем в других. В них злокачественные новообразования образуются чаще, чем в других структурах организма. По данным международного агентства по исследованию рака IARC, риск заболеть раком, а также выживаемость раковых клеток на 70–80 % зависят от интенсивности деления стволовых клеток и увеличиваются с возрастом.
Генетические маркеры опухолей (изменения в структуре белков в результате соматических драйверных мутаций) можно использовать как мишень и прицельно блокировать с помощью фармакологических препаратов. На этом принципе основан один из наиболее результативных современных методов лечения рака — таргетная терапия. Она позволяет:
Выявление драйверных соматических мутаций для диагностики злокачественных опухолей
Чем больше генетических маркеров известно, тем более адекватно подбирается лечение. Для выявления соматических мутаций при диагностике злокачественных опухолей используют следующие методики:
Целесообразность использования того или иного метода в каждом конкретном случае определяет врач.
Соматические мутации опухолей: влияние на диагностику и лечение
В процессе роста злокачественные новообразования приспосабливаются к факторам онкологического лечения — лучевой, химио- и иммунотерапии. Молекулы онкологических клеток, выжившие после того или иного лечебного этапа, нередко мутируют. Соматические мутации опухолей способствуют прогрессированию болезни и её более агрессивному (рецидивирующему и метастатическому) течению. Из-за индивидуальных различий на молекулярном уровне общеклинические стратегии лечения того или иного вида рака могут быть неэффективны для отдельных пациентов.
Чтобы максимально снизить риск рецидивов, улучшить качество жизни больных и увеличить её продолжительность, соматические мутации в опухолях в ответ на фармако- и химиотерапию необходимо учитывать. Для их выявления разработан инновационный метод исследования — молекулярное профилирование. Результаты этого вида диагностики позволяют врачу назначать наиболее оптимальное персонализированное лечение.
Соматические мутации и психические расстройства
Известно, что некоторые заболевания человека возникают в результате соматических мутаций, и данные многих исследований указывают на то, что соматические мутации могут частично объяснить склонность к психическим расстройствам. Такие мутации могут наблюдаться в различных тканях в течение раннего периода развития, включая периферические ткани (например, клетки крови), а также клетки головного мозга. Напротив, соматические мутации, возникающие после дифференцировки, существуют в ограниченной области одного типа ткани (например, мозга) и, таким образом, могут быть обнаружены только в этой ткани. Соматические мутации возникают из-за воздействия окружающей среды, включая воспаление и окислительный стресс (описанный ниже), а также из-за стохастических изменений во время развития.
В то время как полиморфизмы и варианты, передаваемые от предков, являются наследственными генетическими факторами, остальные три типа мутаций de novo и соматических мутаций, являются ненаследственными генетическими факторами. Тем не менее, все эти типа зародышевой линии и соматические варианты (мутации), вероятно, оказывают аддитивное влияние на отдельный фенотип. Например, исследования показали, что мутации зародышевой линии de novo и наследуемые варианты аддитивно влияют на риск развития расстройства аутистического спектра.
В принципе, мутации, которые приводят к эмбриональной летальности или тяжелым врожденным заболеваниям, не могут существовать в геноме зародышевой линии, хотя они могут существовать в виде соматических мутаций, что может привести к относительно менее серьезным физиологическим последствиям. Предыдущие исследования, касающиеся эпилептической энцефалопатии, показали, что одиночные соматические мутации PCDH19 приводят к менее тяжелой патологии, чем мутации de novo того же гена.
Полиморфизмы и варианты, передаваемые от предков и мутаций de novo, общих для монозиготных близнецов, способствуют наследуемости, оцененной в исследованиях близнецов. Тем не менее, соматические мутации, не разделяемые между монозиготными близнецами, не вносят непосредственного вклада в наследственность, но влияют на склонность к психическим расстройствам у пациентов, изменяя биологические пути, сходные с теми, на которые влияют мутации зародышевой линии. Соматические мутации могут вносить вклад в общую изменчивость ответственности, которая, как классически считается, связана с факторами окружающей среды.
Расчетная частота мутаций de novo составляет 1–1,5 × 10–8 на нуклеотид на поколение. Соматические мутации могут встречаться чаще, чем мутации de novo. При условии консервативной оценки 2,8 замещающих мутаций на клетку на клеточное деление и симметричных делений в развитии, 86 миллиардов нейронов прошло бы по крайней мере 36 делений, что привело бы к минимуму 100 однонуклеотидных вариантов (SNVs) в одном нейроне. Фактически, нейроны, вероятно, подвергаются гораздо большему количеству клеточных делений, и мутация в нервных тканях происходит через механизмы, отличные от ошибок репликации во время клеточного деления. Кроме того, могут возникать другие типы мутаций (например, структурные варианты), увеличивая количество мутационных событий сверх этой минимальной оценки.
Исследовательские группы опубликовали обзоры, которые систематизируют последние знания о соматических мутациях в человеческом мозге с нейропсихиатрической / нейробиологической точки зрения.
Одна нейрональная прогениторная клетка в коре плода имеет
1000–2500 соматических SNVs. Эти оценки основаны на секвенировании цельного генома (WGS) одноклеточных геномов после пролиферации клональных клеток или амплификации цельного генома (WGA). SNV в одном нейроне в префронтальной коре и зубчатой извилине увеличиваются на
40 в год соответственно. Скорость накопления в нейронах зубчатой извилины в два раза выше, чем в нейронах префронтальной коры, вероятно, из-за различий в скорости нейрогенеза. Некоторые мутации в отдельных нейронах также обнаруживаются в других областях мозга с различными аллельными фракциями. Предполагается, что аллельные фракции в определенных областях мозга коррелируют с моментом возникновения мутации, так что более крупные аллельные фракции могут отражать мутацию на более ранних стадиях развития. Исследователи предоставили оценку 5,1 SNV / день / отдельная клетка-предшественник во время нейрогенеза, 8,6 SNV / клетка / клетка-предшественник и 1,3 SNV / клетка / дочерняя клетка в раннем эмбрионе человека. Нейрогенез связан с более высокой частотой мутаций, чем в раннем эмбриогенезе, хотя частота нейрогенеза у взрослых в мозге человека активно обсуждается.
Наблюдаемые соматические мутации обогащены генами, связанными с нейроразвитием, и нитями, подвергающимися активной транскрипции. Большая длина нейрон-экспрессируемых генов может быть причиной мутационной восприимчивости. Соматические мутации в зрелых нейронах, вероятно, возникают во время активной транскрипции, тогда как соматические мутации в эмбриональных нейронах встречаются реже в геномных областях с гистоновыми метками мозга плода и эмбриональных стволовых клеток. Геномные участки, подверженные мутации, могут различаться в зависимости от стадии развития. Смещение соматических мутаций к генам нейроразвития в зрелых нейронах указывает на их отношение к психическим расстройствам.
Соматические мутации показали значительное пространственное разнообразие; некоторые мутации наблюдались в мозге, но не в печени, тогда как другие наблюдались в коре, но не в мозжечке.
Несколько исследовательских групп выявили соматическую анеуплоидию в мозге человека.
Мобильные элементы
Подвижные элементы занимают
Скорость соматической ретротранспозиции в мозге человека активно изучается. Исследователи наблюдали соматическую ретротранспозицию LINE-1 и Alu в объемной ткани, полученной из гиппокампа и хвостатого ядра человека. Соматическая ретротранспозиция была обнаружена с использованием секвенирования ретротранспозонов (RC-Seq), в котором ретротранспозоны в геноме были секвенированы в массовом порядке после захвата. Сайты вставки ретротранспозонов были идентифицированы фланкирующими геномными последовательностями. Авторы выявили 13 700 и 7700 предполагаемых соматических ретротранспозиций LINE-1 и Alu, соответственно, у трех индивидуумов ( Baillie et al., 2011).
Поскольку нервная ткань проявляет мало или вообще не обладает пролиферативной способностью, механизмы, лежащие в основе соматической мутации в мозге, должны отличаться от механизмов, связанных с раком. Исследования показали, что C> T- переходы составляют
80% соматических SNV в одиночных нейронах. Нейроны имеют характерные 5 мС в не-CpG-сайтах и относительно большее количество 5-гидроксиметилцитозина (5hmC), чем в других тканях. Более того, 5hmC является промежуточным продуктом при активном деметилировании 5mC до C, и предыдущие исследования показали, что этот процесс, включая восстановление базовой эксцизии, подвержен мутации. Тем не менее, одно исследование показало, что 5hmC был связан с
53% снижением частоты мутаций C> T в сайтах CpG по сравнению с 5mC.
Окислительный стресс
Окислительное повреждение не ограничивается мозгом, но на мозг приходится
1000 одноцепочечных разрывов на клетку в день. При окислительном повреждении образуется 8-оксогуанин, который иногда включает аденин в качестве неправильной комплементарной основы. Если системы репарации ДНК не могут восстановить исходную пару (гуанин и цитозин), неправильно введенный аденин включает тимин в качестве правильного комплементарного основания, что приводит к трансверсии C> A.
Ретранспозиция
Механизм, лежащий в основе ретротранспозиции в мозге человека, остается в значительной степени неизвестным. Однако, предполагается, что эпигенетическая модификация подавляет транскрипционную активность ретротранспозонов. Данные исследователей свидетельствуют о том, что воспалительный стресс в период развития плода вызывает соматическую ретротранспозицию, предполагают, что факторы окружающей среды приводят к соматической ретротранспозиции, вероятно, в результате нейровоспаления.
Соматические мутации при пороках развития мозга и нейродегенерации
Несколько исследований выявили соматические мутации в известных генах риска для определенных пороков развития головного мозга. Во многих случаях потенциальные соматические мутации были обнаружены в областях мозга, проявляющих местные анатомические изменения.
Корковая дисплазия с эпилепсией является еще одним примером порока развития головного мозга, вызванного соматическими мутациями, так идентифицировали соматические мутации в MTOR в пораженной области мозга у пациентов с кортикальной дисплазией II типа и эпилепсией. Они обнаружили предполагаемые соматические мутации с использованием WES на глубине 400–700 ×, подтвердив и количественно определив мутацию-кандидата с помощью TAS. Двенадцать из 77 пациентов имели соматические мутации в MTOR с аллельными фракциями от 1,3 до 12,6% в пораженных областях ( Lim et al., 2015).
Соматические мутации в GNAQ (c.548G> A, p.Arg183Glu) были зарегистрированы у пациентов с синдромом Стерджа-Вебера (редкое врожденное неврологическое расстройство, характеризующееся приступами, умственной отсталостью, церебральными пороками развития и другими симптомами).
Соматические мутации и психические расстройства ( посмертные исследования)
Психические расстройства часто связаны с меньшим количеством анатомических изменений, чем пороки развития головного мозга, что делает относительно трудным исследование соматических мутаций, связанных с этими патологическими состояниями. Длина теломер, как правило, варьируется в соматических клетках. Характерное уменьшение длины теломер наблюдается в гиппокампе у пациентов с большим депрессивным расстройством.
Соматические мутации и психические расстройства ( анализ переферической ткани)
Методики исследования ( валидация)
). Пиросеквенирование и секвенирование Сэнгера со многими клонами также можно использовать для расчета доли аллеля, хотя разрешение и чувствительность ниже, чем у ddPCR (пиропоследовательность,
5%). Однако, все эти методы демонстрируют трудности при обнаружении SNV в повторяющихся областях, включая ретротранспозоны, из-за сложности в ПЦР. TAS на сверхвысокой глубине (например, 10000 ×
) можно использовать в качестве альтернативного метода валидации, так как этот метод может обнаруживать соматические мутации с долями аллелей всего 0,1%. Тем не менее, существует вероятность систематических ошибок при использовании химии секвенирования, аналогичной исходной последовательности. Соматические CNV и ретротранспозоны в объемных тканях могут быть проверены с использованием КПЦР, хотя разрешение ограничено.
Стратегии секвенирования
Выбор целевого геномного региона является одним из наиболее важных вопросов. Хотя гены риска еще не определены для большинства психических расстройств, последние геномные исследования выявили несколько генов-кандидатов в качестве редких вариантов с сильным размером эффекта. Однако, если целевые гены неясны, требуются более комплексные методы, такие как WGS или WES. Выбор WGS, WES или TAS зависит от цели исследования, а также от конкретного расстройства.
Новые технологии секвенирования, включающие секвенирование с длительным считыванием, такие как PacBio / Sequel (Pacific Biosciences, Menlo Park, CA, USA) и MinION / PromethION (Oxford Nanopore Technology, Oxford, UK), были бы полезны для исследования структурных вариантов. и ретротранспозонов. Анализ CNV может быть выполнен с использованием микрочипов, но WGS с малой глубиной более чувствителен для обнаружения соматических CNV, а секвенсоры с длинным чтением полезны для обнаружения вариантов соматических структур, включая CNV.
Обнаружение кандидата
Ожидается, что аллельные доли соматических мутаций в нервной ткани будут низкими из-за низкой пролиферативной способности после дифференцировки. Это заметно контрастирует с раком, который характеризуется гиперпролиферацией и связан с соматическими мутациями, несущими большие аллельные фракции. Таким образом, высокочувствительный подход необходим для обнаружения соматических мутаций в мозге человека. Cibulskis et al. ( 2013) сообщили о чувствительности MuTect, хорошо известного инструмента обнаружения соматических мутаций с высокой чувствительностью и специфичностью, имитирующего различные случаи глубины секвенирования. Например, MuTect требует глубины последовательности 340 ×
Метод отбора проб
Одноклеточный анализ полезен для выявления соматических мутаций, которые возникают позже в развитии. Однако ложноположительные результаты индуцируются дезаминированием во время лизиса клеток, смещением амплификации и ошибками во время WGA. Каждый метод WGA (MDA, MALBAC или DOP-PCR) связан с преимуществами и недостатками. Предполагается, что линейное усиление с помощью транспозонной вставки (LIANTI), недавно предложенного метода WGA, уменьшает смещение усиления. Ложные срабатывания, указывающие на C> T из-за спонтанного дезаминирования C> U во время одноклеточной подготовки, могут быть уменьшены с помощью урацил-ДНК-гликозилазы. Перенос ядер соматических клеток (SCNT) нейронных ядер в энуклеированные ооциты также был предложен в качестве метода WGA.