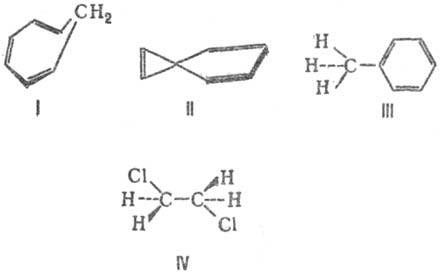
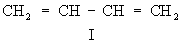Что такое сопряженные связи в химии
Сопряжение связей
Полезное
Смотреть что такое «Сопряжение связей» в других словарях:
СОПРЯЖЕНИЕ СВЯЗЕЙ — (конъюгация связей), чередование простых и кратных связей в структурной ф ле соед. (напр., в 1,3 бутадиене СН 2=СНЧСН=СН 2). В широком смысле понятие С. с. охватывает также гомосопряжение (в альтернирующую последовательность простых и двойных… … Химическая энциклопедия
Сопряжение — Сопряжение взаимосвязь чего либо с чем либо, непременное сопутствие, совмещение нескольких объектов, явлений. Математика Комплексное сопряжение операция над комплексным числом (набором комплексных чисел, оператором), при которой… … Википедия
СОПРЯЖЕНИЕ — (1) в машиностроении относительное положение составных частей изделия, характеризуемое соприкосновением их поверхностей млн. зазором между ними, заданными конструкторской документацией; (2) С. контуров обеспечение согласованного изменения… … Большая политехническая энциклопедия
Теория валентных связей — Рис.1. Модель перекрывания атомных орбиталей при образовании сигма связи Теория валентных связей ( … Википедия
Мезомерия — (от Мезо. и греч. méros часть) сопряжение, резонанс в сопряжённых системах, характер распределения электронной плотности в молекулах, который можно трактовать как частичную делокализацию связей и зарядов атомов. Так, в карбоксилат… … Большая советская энциклопедия
Молекула — (новолат. molecula, уменьшительное от лат. moles масса) наименьшая частица вещества, обладающая его химическими свойствами. М. состоит из атомов, точнее из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов,… … Большая советская энциклопедия
Молекула — Схема ковалентных связей между атомами в молекуле кислорода … Википедия
Органическая химия — раздел химии (См. Химия), естественнонаучная дисциплина, предметом изучения которой являются соединения углерода с др. элементами, называемые органическими соединениями, а также законы превращения этих веществ. Углерод образует соединения … Большая советская энциклопедия
Электронные теории в органической химии — теории, рассматривающие строение, физические свойства и реакционную способность (См. Реакционная способность) органических соединений на основе представлений о распределении электронной плотности в атомах и молекулах, а также о смещениях… … Большая советская энциклопедия
Цветности теория — теория о связи Цвета химических соединений с их строением. Ощущение цвета возникает при воздействии на зрительный нерв электромагнитных излучений с энергией в пределах от 2,5․10 12 до 5․10 12 эрг (длины волн от 400 до 760 нм). При этом… … Большая советская энциклопедия
СОПРЯЖЕНИЕ СВЯЗЕЙ
В то же время в ароматич. и нек-рых др. системах, к-рые наилучшим образом описываются суперпозицией резонансных структур и где доли локализованных мол. орбиталей имеют большие веса вне связей (напр., в бензоле ок. 13%), сопряжение связей обычно отождествляется с делокализацией связей. Экспериментально наблюдаемые коллективные св-ва таких сопряженных систем в принципе нельзя представить в виде аддитивных ф-ций св-в связей.
Наиб. существенной особенностью сопряженных систем с делокализованными связями является их повыш. термо-динамич. устойчивость. В ароматич. системах теплоты образования значительно выше, чем значения, найденные с учетом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин (см. Ароматичность). Количеств. мера повыш. термодинамич. устойчивости таких систем-энергия резонанса (сопряжения, дело-кализации). В сопряженных системах правилам аддитивности не подчиняются также параметры ЙК спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчете разл. характеристик вводят поправочные члены экзальтации и т.п.
Сопряженные системы с делокализованными связями представляют собой соед. с характсристич. электронными переходами, причем с удлинением цепи сопряжения повышается интенсивность и смещается поглощение в электронных спектрах в сторону больших длин волн (соотв. гипер-хромный эффект и батохромный сдвиг; см. Цветность органических соединений).
Понятие о сопряжении связей используют при рассмотрении реакц. способности. Напр., электроф. присоединение к сопряженным диенам (см. Диеновые углеводороды)приводит к смеси продуктов 1,2- и 1,4-присоединения.
Лит.: Базилевский М. В., Метод молекулярных орбит и реакционная способность органических молекул, М., 1969; Dewar М. I. S., Mc Кее М. L., «J. Amer. Chem. Soc.», 1978, v. 100, № 24, p. 7499-505; Cremer D., «Tetrahedron», 1988, v. 44, № 24, p. 7427-54. М. E. Клецкий.
Органическая химия
Информативные ответы на все вопросы курса «Органическая химия» в соответствии с Государственным образовательным стандартом.
Оглавление
Приведённый ознакомительный фрагмент книги Органическая химия предоставлен нашим книжным партнёром — компанией ЛитРес.
3. Сопряженные системы
В простейшем случае сопряженные системы —
это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Все атомы С находятся в состоянии sp-гибридиза-ции. Четыре негибридные р-орбитами, перекрываясь между собой, образуют единую электронную систему. Этот вид сопряжения называется p, p-сопряжением.
Происходит сопряжение р-электронов с S-электро-нами. Этот вид сопряжения называется р, р-сопряже-нием. Закрытая система имеется в ароматических УВ.
Сопряжение — процесс энергетически выгодный, энергия (Е) при этом выделяется. Энергия сопряжения бутадиена — 1,3 составляет 15 кДж/моль, энергия сопряжения бензола — 228 кДж/моль.
Это понятие, включающее различные свойства ароматических соединений. Условия ароматичности:
1) плоский замкнутый цикл;
2) все атомы С находятся в sp2-гибридизации;
3) образуется единая сопряженная система всех атомов цикла;
4) выполняется правило Хюккеля: в сопряжении участвуют 4n + 2 р-электронов, где n = 1, 2, 3…
Простейший представитель ароматических углеводородов — бензол. Он соответствует всем четырем условиям ароматичности. Правило Хюккеля: 4n + 2 = 6, n = 1.
Нафталин — ароматическое соединение 4n + 2 = 10, n = 2.
Пиридин — ароматическое гетероциклическое соединение. Взаимное влияние атомов в молекуле
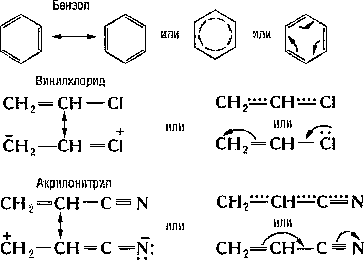
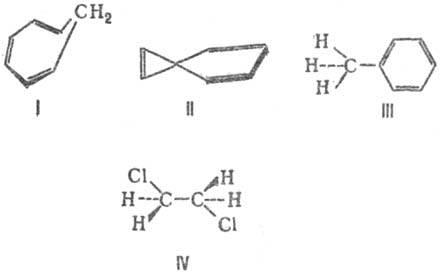
В 1861 г. русский ученый A. M. Бутлеров выдвинул положение: «Атомы в молекулах взаимно влияют друг на друга». В настоящее время это влияние передается двумя путями: индуктивным и мезомерным эффектами.
Индуктивный эффект — это передача электронного влияния по цепи р-связи. Известно, что связь между атомами с различной электроотрицательностью (ЭО) поляризована, смещена к более электроотрицательному атому. Это приводит к появлению на атомах эффективных (реальных) зарядов (d). Такое электронное смещение называется индуктивным и обозначается буквой «I» и стрелкой «→».
Индуктивный эффект может быть положительным или отрицательным. Если заместитель X притягивает электроны химической связи сильнее, чем атом Н, то он проявляет — I.I (H) = 0. В нашем примере X проявляет — I.
Если заместитель X притягивает электроны связи слабее, чем атом Н, то он проявляет +I. Все алкилы (R = СН3-, C2H5 — и т. д.), Меп+ проявляют +I.
СОПРЯЖЕНИЕ СВЯЗЕЙ
С. с. не обязательно означает неприменимость модели локализованных связей к рассматриваемой молекуле. Так, электронная заселенность локализованных мол. орбиталей вне s-связей не превышает 1%. Так же хорошо локализованы и p-связи в сопряженных неароматич. системах (особенно когда учитывается альтернирование связей). Так, в линейных полиенах заселенность вне двухцентровых связей ок. 2%. Такие сопряженные системы описываются одной резонансной структурой со связями только между соседними атомами и без разделения формальных зарядов (см. Резонанса теория),а их коллективные св-ва удается рассматривать в рамках аддитивных моделей.
В то же время в ароматич. и нек-рых др. системах, к-рые наилучшим образом описываются суперпозицией резонансных структур и где доли локализованных мол. орбиталей имеют большие веса вне связей (напр., в бензоле ок. 13%), С. с. обычно отождествляется с делокализацией связей. Экспериментально наблюдаемые коллективные св-ва таких сопряженных систем в принципе нельзя представить в виде аддитивных ф-ций св-в связей.
Наиб. существенной особенностью сопряженных систем с делокализованными связями является их повыш. термо-динамич. устойчивость. В ароматич. системах теплоты образования значительно выше, чем значения, найденные с учетом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин (см. Ароматичность).Количеств. мера повыш. термодинамич. устойчивости таких систем-энергия резонанса (сопряжения, дело-кализации). В сопряженных системах правилам аддитивности не подчиняются также параметры ЙК спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчете разл. характеристик вводят поправочные члены экзальтации и т. п.
Сопряженные системы с делокализованными связями представляют собой соед. с характсристич. электронными переходами, причем с удлинением цепи сопряжения повышается интенсивность и смещается поглощение в электронных спектрах в сторону больших длин волн (соотв. гипер-хромный эффект и батохромный сдвиг; см. Цветность органических соединений).
Понятие о С. с. используют при рассмотрении реакц. способности. Напр., электроф. присоединение к сопряженным диенам (см. Диеновые углеводороды )приводит к смеси продуктов 1,2- и 1,4-присоединения.
Лит.: Базилевский М. В., Метод молекулярных орбит и реакционная способность органических молекул, М., 1969; Dewar М. I. S., Mc Кее М. L., «J. Amer. Chem. Soc.», 1978, v. 100, № 24, p. 7499-505; Cremer D., «Tetrahedron», 1988, v. 44, № 24, p. 7427-54. М. E. Клецкий.
Алкадиены
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода.
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С.
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp 2 —гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
| Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей. |
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
| Например. Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
| Например. Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен |
| Бутадиен-1,3 | Бутин-1 | Циклобутен |
 |  |  |
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен) |
| Пентадиен-1,3 | 2-Метилбутадиен-1,3 |
 |  |
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
| Например. Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода) |
CH2=CH–CH=CH2
Номенклатура алкадиенов
| Например, алкадиен имеет название бутадиен-1,3. |
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
| Тривиальное название | Формула алкадиена |
| Дивинил |  |
| Изопрен |  |
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
1.1. Гидрирование алкадиенов
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
| Например, уравнение сгорания бутадиена: |
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):
Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3: