Что такое спектрофотометрия в биологии
СПЕКТРОФОТОМЕТРИЯ
СПЕКТРОФОТОМЕТРИЯ, метод исследования и анализа в-в, основанный на измерении спектров поглощения в оптич. области электромагн. излучения. Иногда под спектрофотометрией понимают раздел физики, объединяющий спектроскопию (как науку о спектрах электромагн. излучения), фотометрию и спектрометрию [как теорию и практику измерения соотв. интенсивности и длины волны (или частоты) электромагн. излучения]; на практике спектрофотометрию часто отождествляют с оптич. спектроскопией. По типам изучаемых систем спектрофотометрию обычно делят на молекулярную и атомную. Различают спектрофотометрию в ИК, видимой и УФ областях спектра (см. Инфракрасная спектроскопия, Ультрафиолетовая спектроскопия).
Переходы типа p : p * могут сопровождаться переходом электрона с орбитали, локализованной гл. обр. на одной группе (напр., С=С), на орбиталь, локализованную на др. группе (напр., С=О). Такие переходы сопровождаются переносом электрона с одного атома на другой и соответствующие спектры наз. спектрами с переносом заряда. Последние характерны для разл. комплексов (напр., арома-тич. соединений с галогенами), интенсивно поглощающих в видимой и УФ областях.
Для ионов переходных металлов и их комплексных соед. характерны переходы с участием d-электронов, а для РЗЭ и актиноидов-переходы с участием f-электронов. Соответствующие соед. в р-ре бывают интенсивно окрашенными, причем окраска (спектр поглощения) зависит от степени окисления катиона и устойчивости комплексного соединения. Поэтому спектрофотометрию широко используют при исследовании и анализе комплексных соед. металлов.
Изолированные, не взаимодействующие между собой хромофоры в молекуле поглощают независимо. В случае к.-л. взаимод. между ними аддитивность спектров нарушается. По отклонениям от аддитивности можно судить о характере и величине взаимодействия. Поскольку положение полос в спектре определяется как разность энергий основного и возбужденного состояний молекул, можно определять структуру энергетич. уровней молекул или по известной схеме энергетич. уровней определять положение полос поглощения. Любому электронному состоянию молекул соответствует набор разл. колебат. уровней энергии. Колебат. структура полосы, соответствующей переходу между электронными уровнями, может отчетливо проявляться не только в спектрах газов, но и в спектрах нек-рых р-ров, что дает возможность получать дополнит. информацию о взаимод. молекул. Спектрофотометрич. исследование спектров молекул в видимой и УФ областях позволяет установить вид электронных переходов и структуру молекул. При этом часто исследуют влияние разл. типов замещения в молекулах, изменения р-рителей, т-ры и др. физ.-хим. факторов.
В ИК области проявляются переходы между колебат. и вращат. уровнями (см. Колебательные спектры, Вращательные спектры). Среди частот колебаний молекул выделяют т. наз. характеристические, к-рые практически постоянны по величине и всегда проявляются в спектрах хим. соед., содержащих определенные функц. группы (вследствие чего эти частоты иногда называют групповыми; см. табл. на форзаце 2-го тома). Теория колебаний сложных молекул позволяет расчетным путем предсказать колебат. спектр соединений, т. е. определить частоты и интенсивности полос поглощения.
Колебат. спектры молекул чувствительны не только к изменению состава и структуры (т.е. симметрии) молекул, но и к изменению разл. физ. и хим. факторов, напр. изменению агрегатного состояния в-ва, т-ры, природы р-рителя, концентрации исследуемого в-ва в р-ре, разл. взаимод. между молекулами в-ва (ассоциация, полимеризация, образование водородной связи, комплексных соед., адсорбция и т. п.). Поэтому ИК спектры широко используют для исследования, качеств. и количеств. анализа разнообразных в-в.
ИК фурье-спектрофотометры могут содержать программы по автоматич. идентификации образца неизвестного состава и определению содержания примесей, напр. в полупроводниковых материалах.
Лит.: Ельяшевич М. А., Атомная и молекулярная спектроскопия, М., 1962; Дайер Д. Р., Приложения абсорбционной спектроскопии органических соединений, пер. с англ., М., 1970; Приборы и методы анализа в ближней инфракрасной области, М., 1977; Смит А., Прикладная ИК-спектроскопия, пер. с англ., М., 1982; Современная колебательная спектроскопия неорганических соединений, Новосиб., 1990; Накамото К., ИК спектры и спектры КР неорганических и координационных соединений, пер. с англ., М., 1991. Э. Г. Тетерин.
Применение спектрофотометрических методов в биологии
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 18.12.2019 |
| Размер файла | 106,3 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Министерство образования и науки Российской Федерации
Национальный исследовательский нижегородский национальный университет им. Н.И. Лобачевского
Институт биологии и биомедицины
Кафедра экспериментальной и ядерной биомедицины ННГУ им. Н.И. Лобачевского
Факультет медицинской биохимии
по дисциплине «Биофизика»
на тему: «Применение спектрофотометрических методов в биологии«
Выполнила: Попова О.В.
Проверила: Пескова Н.Н.
Нижний Новгород 2019
Спектрофотометрический метод анализа
Молекулы, имеющие одинаковую связь и образующие одну группу, в ИФ области выдают полосы поглощения соответствующей характеристической частоты. Данные характеристические частоты помогают определить по получаемому спектру имеющиеся в исследуемой взвеси наличие искомых групп атомов или молекул.
Делят спектрофотометрию: на молекулярную, когда искомое вещество молекулярная структура, и атомную. В зависимости от длин волн, которые способен различить прибор, и веществ, которые надо будет определять, выбираются спектрофотометры.
Спектрофотометрическое определение фигурирует во многих областях для разных задач:
1. подтверждает подлинность заявленного элемента/продукта,
2. определяет доброкачественность изготовленного препарата,
3. с его помощью находят радиоактивные элементы в водоемах,
4. количественно оценивает, сколько разных веществ находится во взвеси,
5. различать химические элементы во взвеси.
Применяется в биологических и геологических лабораториях, в целях радиационной безопасности (на АЭС, институтах и т.д.), промышленностях, где требуется знать химический состав продуктов и материалов.
Теоретическая часть
Введем понятие коэффициента пропускания Т.
СПЕКТРОФОТОМЕТРИЯ
метод исследования и анализа в-в, основанный на измерении спектров поглощения в оптич. области электромагн. излучения. Иногда под С. понимают раздел физики, объединяющий спектроскопию (как науку о спектрах электромагн. излучения), фотометрию и спектрометрию [как теорию и практику измерения соотв. интенсивности и длины волны (или частоты) электромагн. излучения]; на практике С. часто отождествляют с оптич. спектроскопией. По типам изучаемых систем С. обычно делят на молекулярную и атомную. Различают С. в ИК, видимой и УФ областях спектра (см. Инфракрасная спектроскопия, Ультрафиолетовая спектроскопия).
120 нм. Переходы n: s* наблюдаются в УФ области; напр., орг. соед., содержащие n-электроны, локализованные на орбиталях атомов О, N, Hal, S, имеют Полосы поглощения при длине волны ок. 200 нм. Линии, соответствующие переходам p : p*, напр., в спектрах гетероциклич. соединений проявляются в области ок. 250-300 нм и имеют большую интенсивность. Полосы поглощения, соответствующие переходам n: p*, находятся в ближней УФ и видимой областях спектра; они характерны для соед., в молекулах к-рых имеются такие хромофорные группы, как С = О, C = S, N = N. Так, насыщ. альдегиды и кетоны имеют максимумы поглощения при длине волны ок. 285 нм. Переходы типа n: p* часто оказываются запрещенными, и соответствующие полосы поглощения обладают очень малой интенсивностью.
Переходы типа p : p* могут сопровождаться переходом электрона с орбитали, локализованной гл. обр. на одной группе (напр., С=С), на орбиталь, локализованную на др. группе (напр., С=О). Такие переходы сопровождаются переносом электрона с одного атома на другой и соответствующие спектры наз. спектрами с переносом заряда. Последние характерны для разл. комплексов (напр., арома-тич. соединений с галогенами), интенсивно поглощающих в видимой и УФ областях.
Для ионов переходных металлов и их комплексных соед. характерны переходы с участием d-электронов, а для РЗЭ и актиноидов-переходы с участием f-электронов. Соответствующие соед. в р-ре бывают интенсивно окрашенными, причем окраска (спектр поглощения) зависит от степени окисления катиона и устойчивости комплексного соединения. Поэтому С. широко используют при исследовании и анализе комплексных соед. металлов.
Изолированные, не взаимодействующие между собой хромофоры в молекуле поглощают независимо. В случае к.-л. взаимод. между ними аддитивность спектров нарушается. По отклонениям от аддитивности можно судить о характере и величине взаимодействия. Поскольку положение полос в спектре определяется как разность энергий основного и возбужденного состояний молекул, можно определять структуру энергетич. уровней молекул или по известной схеме энергетич. уровней определять положение полос поглощения. Любому электронному состоянию молекул соответствует набор разл. колебат. уровней энергии. Колебат. структура полосы, соответствующей переходу между электронными уровнями, может отчетливо проявляться не только в спектрах газов, но и в спектрах нек-рых р-ров, что дает возможность получать дополнит. информацию о взаимод. молекул. Спектрофотометрич. исследование спектров молекул в видимой и УФ областях позволяет установить вид электронных переходов и структуру молекул. При этом часто исследуют влияние разл. типов замещения в молекулах, изменения р-рителей, т-ры и др. физ.-хим. факторов.
В ИК области проявляются переходы между колебат. и вращат. уровнями (см. Колебательные спектры, Вращательные спектры).Среди частот колебаний молекул выделяют т. наз. характеристические, к-рые практически постоянны по величине и всегда проявляются в спектрах хим. соед., содержащих определенные функц. группы (вследствие чего эти частоты иногда называют групповыми; см. табл. на форзаце 2-го тома). Теория колебаний сложных молекул позволяет расчетным путем предсказать колебат. спектр соединений, т. е. определить частоты и интенсивности полос поглощения.
Колебат. спектры молекул чувствительны не только к изменению состава и структуры (т. е. симметрии) молекул, но и к изменению разл. физ. и хим. факторов, напр. изменению агрегатного состояния в-ва, т-ры, природы р-рителя, концентрации исследуемого в-ва в р-ре, разл. взаимод. между молекулами в-ва (ассоциация, полимеризация, образование водородной связи, комплексных соед., адсорбция и т. п.). Поэтому ИК спектры широко используют для исследования, качеств. и количеств. анализа разнообразных в-в.
СПЕКТРОФОТОМЕТРИЯ
СПЕКТРОФОТОМЕТРИЯ — область измерительной техники, разрабатывающая методы и приборы для определения спектральных характеристик объектов. В медико-биологических исследованиях наибольшее значение имеет анализ молекулярных и атомных спектров поглощения (см. Спектральный анализ, Спектроскопия). С помощью Спектрофотометрии определяют в различных биол. пробах содержание ферментов, гормонов, белков, витаминов, многих неорганических веществ, анализируют качественный и количественный состав мазков крови и т. д.
Закон Бугера — Ламберта — Беера справедлив лишь для плоскопараллельного пучка монохроматического света и при выполнении ряда условий. На практике часто приходится сталкиваться с отклонениями от этого закона. К числу причин отклонения могут быть отнесены физ.-хим. свойства анализируемого вещества или всего раствора (диссоциация, флюоресценция и др.)» инструментальные факторы (напр., отсутствие должной степени монохроматичности пучка света), факторы, обусловленные неоднородностью изучаемого объекта в пучке света (особенно отчетливо проявляется при микроспектрофотометрии объектов) и т. д.
Важным принципом С. является принцип аддитивности (т. е. суммации) оптических плотностей, в соответствии с к-рым величина оптической плотности смеси соединений, подчиняющихся закону Бугера — Ламберта — Беера и не вступающих в хим. взаимодействие друг с другом, равна сумме оптических плотностей этих соединений.
Количественный анализ пробы, содержащей одно вещество, включает следующие операции: 1) регистрацию полного спектра поглощения вещества (D измеряют как функцию длины волны λ), выбор аналитической длины волны (λанал); 2) приготовление 6—7 эталонных (стандартных) р-ров, охватывающих весь ожидаемый диапазон концентраций определяемого вещества в анализируемых р-рах, и измерение оптической плотности (Dст) этих растворов при λанал. Затем строят график зависимости величины оптической плотности Dст от концентрации эталонного р-ра. Наиболее точные результаты дают измерения в диапазоне D в пределах 0,05—1,50. В случае, если построенная зависимость, т. е. Dcт = f(cст), линейна (определяемое вещество подчиняется закону Бугера — Ламберта — Беера), определение концентрации вещества осуществляют аналитически, используя формулу с = сст*(D/Dст). При несоблюдении закона Бугера — Ламберта — Беера количественный анализ проводят графическим методом (с помощью калибровочного графика). Оптическая плотность анализируемого р-ра во всех случаях измеряется относительно р-ра сравнения (прямой спектрофотометрический метод). В качестве р-ра сравнения может быть использован как чистый растворитель, так и р-р, содержащий все компоненты анализируемого р-ра за исключением определяемого вещества. В ряде случаев в качестве р-ра сравнения целесообразнее использовать р-р определяемого вещества известной концентрации (обычно более низкой, чем в анализируемых пробах). При проведении такого рода измерений говорят о дифференциальной С.
Нередко проводят регистрацию производных спектров поглощения. Производную С. применяют в основном в качественном анализе с целью выявления сильно перекрывающихся спектральных линий, при определении точного положения максимума размытых полос поглощения, идентификации малопоглощаю-щих примесей, установлении структуры органических соединений и т. д.
С. проводится в инфракрасной (ПК), УФ и видимой областях спектра. К приборам, работающим в видимой области, относятся также спектрофотометры комбинационного рассеяния (КР-спектрофотометры). С помощью С. комбинационного рассеяния изучают колебательные энергетические уровни молекул (см. Спектральный анализ, Молекула), к-рые могут быть использованы для определения числа S — S-связей в белках, числа спаренных и неспаренных оснований в нуклеиновых к-тах, относительного содержания альфа- и бета-спирализованных участков в полипептидах и др.
С. микрообъектов, или микроспектрофотометрия, — относительно самостоятельная область исследования (см. Микроспектральный анализ). Микроспектрофотометры, как и микроспектрофлюориметры, обычно предназначены для работы в видимой области спектра, реже в УФ-области и выполняются по одно лучевой схеме. Для регистрации распределения поглощающего вещества по площади микрообъекта используют различного рода сканирующие устройства: систему оптических зондов, перемещающиеся по заданной программе предметные столики, телевизионную (электронную) развертку изображения и проч. Приборы совр. конструкций снабжаются микрокомпьютерами, автоматически обрабатывающими получаемую информацию и позволяющими анализировать форму микрообъектов (напр., при автоматическом анализе мазков крови), и др. В проточных микрофлюориметрах проводится скоростной анализ флюоресцентных характеристик индивидуальных клеток крови, окрашенных соответствующими красителями. Наметилась тенденция к разработке узкоспециализированных микроспектрофотометров и микроспектрофлюориметров, предназначенных для работы в условиях клин, лабораторий.
Приборы для спектрального анализа комплектуются электронными устройствами обработки и управления, блоками автоматической подачи проб, самописцами, блоками цифро-печати, устройствами автоматической развертки спектра, позволяют определять в одной пробе несколько элементов.
С. широко применяется в биол. исследованиях. Она используется для количественного определения самых разнообразных биол. соединений: ферментов, витаминов, гормонов, белков и других азотистых веществ, нуклеиновых к-т, углеводов, спиртов, альдегидов, фенолов, кетонов, органических к-т, липидов, пигментов, ряда неорганических веществ (напр., натрия, калия, кальция, железа, цинка, хлора, серы) и др.
Приборы
Основными узлами спектрофотометров обычно являются: источник излучения; монохроматор, предназначенный для выделения из спектра излучения источника узких спектральных интервалов; приемник излучения; отсчетное устройство. Спектрофотометры подразделяются на однолучевые и двухлучевые, нерегистрирующие и регистрирующие. Распространенные в мед. лабораториях однолучевые нерегистрирующие спектрофотометры представляют собой достаточно простые и дешевые приборы с оптикой из оптического стекла или кварца. Использование кварцевой оптики дает возможность проводить измерения в области 200—1100 нм, охватывающей ультрафиолетовый, видимый и ближний инфракрасный участки спектра. Исследуемый образец и эталон последовательно вводят в световой пучок. Результаты сравнения пучков в величинах пропускания (в %) или оптической плотности (D) указываются на стрелочном или цифровом приборе.
Оптическая схема спектрофотометров чаще всего автоколлимационная. Источником света обычно служит водородная лампа (для работы в области спектра 220—320 нм) или лампа накаливания (для работы в области спектра 320—1100 нм). Луч света через систему зеркал попадает на диспергирующую призму, к-рая разлагает его, образуя спектр. Вращая призму, можно получать на выходе монохроматора свет волн различной длины; затем лучи проходят эталон (образец) и попадают на регистратор — светочувствительный слой фотоэлемента. Оценка производится либо с помощью калибровочного графика, либо на основе построения функциональной зависимости между величинами оптической плотности и длины волны.
К однолучевым нерегистрирующим спектрофотометрам относятся спектрофотометры СФ-4, СФ-4А, СФД-2, СФ-16, СФ-26. В частности, спектрофотометр СФ-26 имеет расширенный в ультрафиолетовой области (до 186 нм) спектральный диапазон, высокое разрешение в ультрафиолетовой области спектра и обеспечивает по сравнению с аналогами лучшую сходимость результатов измерения коэффициентов пропускания. Диапазон измерения коэффициента пропускания от 0 до 100%. Основная погрешность градуировки шкалы волн в ультрафиолетовой области 0,1 нм, в видимой области 0,5 нм, в ближней инфракрасной области 5,0 нм.
В двухлучевых регистрирующих спектрофотометрах поток от источника излучения разделяется на два пучка: основной и пучок сравнения (эталонный). В основной пучок устанавливается исследуемый образец, в пучок сравнения — эталон. При измерениях коэффициента пропускания веществ в растворе обычно используют две идентичные кюветы, одна из к-рых заполняется исследуемым образцом, а другая эталоном.
Принцип действия двух лучевых приборов (рис. ) основан на нулевом методе. Приемник излучения освещается поочередно промодулированным (с помощью зеркальных секторных дисков — модуляторов) пучком света, прошедшим через исследуемый образец (или отраженный от него), и пучком сравнения. Если световые потоки в основном и эталонном каналах равны, то освещенность приемника излучения будет постоянна в любой момент времени и сигнала переменного тока на входе усилительной системы не будет. При поглощении образцом части светового потока суммарный световой поток на приемнике (стоит на выходе сканирующего монохроматора) будет изменяться с частотой модуляции, на входе усилителя появится сигнал такой же частоты. Напряжение сигнала усиливается и подается на сервомотор, приводящий в движение устройство, ослабляющее пучок сравнения, работающее до тех пор, пока не исчезнет разность световых потоков, т. е. пока не исчезнет сигнал на входе усилителя. Ослабление пучка сравнения осуществляется поворотом находящейся в пучке поляризационной призмы или введением в него компенсирующего оптического клина. Одновременно с движением компенсирующего устройства перемещается перо самописца по бланку. Автоматический поворот диспергирующего устройства (чаще всего призмы) позволяет непрерывно регистрировать эти величины.
К регистрирующим спектрофотометрам относятся приборы видимого диапазона спектра СФ-8, СФ-10, СФ-14, СФ-18 и инфракрасные спектрофотометры одно лучевые ИКС-12, ИКС-21, а также двухлучевые ИКС-14, ИКС-22, ИКС-29, ИКС-31. Инфракрасные спектрофотометры со сменными призмами позволяют измерять коэффициент пропускания веществ в области спектра 1 — 25 мкм и дальше. Они обеспечивают автоматическую запись спектра с высокой точностью и разрешающей силой. Однако при исследовании мед.-биол. объектов инфракрасные спектрофотометры применяются ограниченно из-за сильного поглощения ИК-излучения водой, являющейся основным компонентом живой ткани.
Асатиани B.C. Новые методы биохимической фотометрии, М., 1965; Бабушкин А. А. и др. Методы спектрального анализа, М., 1962; Берштейн И. Я. и Каминский Ю. Л. Спектрофотометрический анализ в органической химии, Л., 1975; Введение в количественную цитохимию, пер. с англ., под ред. В. Я. Бродского и Н. И. Полякова, М., 1969; 3айдель А. Н., Островская Г. В. и Островский Ю. И. Техника и практика спектроскопии, М., 1976, библиогр.; Пейсахсон И. В. Оптика спектральных приборов, Л., 1975.
Р. Р. Лидеман; И. М. Арефьев (техн.).
Спектрофотометрия в биохимических исследованиях
Спектрофотометр измеряет пропускание света, т.е. снижение интенсивности падающего света I 0 до интенсивности I при прохождении через кювету с раствором. Изменение интенсивности света связано с концентрацией анализируемого вещества в растворе законом Бугера-Ламберта-Бера:
где d – длина оптического пути, ε – коэффициент поглощения, которая является константой для анализируемого вещества, с — концентрация анализируемого вещества. Интенсивность падающего света I 0 определяется как общая интенсивность света и принимается за 100%. Экспоненциальная зависимость может быть преобразована в линейную форму, где отрицательный логарифм пропускания заменен на поглощение А:
Область применения спектрофотометрических методов в химической или биохимической лаборатории довольно широка. На определении оптического поглощения основаны различные методы количественного анализа аминокислот, белков, коферментов, НАДФ, нуклеиновых кислот, липидов, углеводов и др. соединений. Большая часть методов ферментативного анализа также связано с измерением оптического поглощения. Кроме того, спектрофотометрия может быть использована для установления зависимости между спектрами поглощения различных соединений и их химическим строением, т.е. проведения не только количественного, но и качественного анализа. С помощью спектрофотометрии можно также проводить турбидиметрический анализ, т.е. проводить измерение света, прошедшего через суспензии, эмульсии и коллоидные растворы. В этом случае свет не поглощается, а преимущественно рассеивается, тем не менее уменьшение интенсивности света может быть определено на обычном спектрофотометре. Поэтому спектрофотометрия может быть также использована при анализе клеточных культур, жировых эмульсий, мицелл и других полимерных структур.
В спектрофотометрии выделяют две основные группы методов: абсорбционные методы, в которых количество вещества определяется из его собственного поглощения, и колориметрические методы, в которых используются дополнительны окрашивающие соединения, а интенсивность окраски анализируемого образца оценивают по калибровочной кривой для соответствующего красителя. Для осуществления всех этих методов могут быть использованы одни и те же инструменты.
Количественное определение белков
Измерение концентрации белка в жидких пробах является обычной процедурой во многих научных лабораториях. Точная количественная оценка имеет большое значение для всех экспериментов, связанных с белками во множестве научно-исследовательских тем в области биохимии, молекулярной биологии, клеточной биологии, биологии развития и генетике. Существуют различные методы для количественного определения белка, многие из которых основаны на измерении спектра поглощения белков или белковых комплексов при определённых значениях длин волн.
С помощью спектрофотометрических методов может быть проведено прямое определение белка путём измерения оптического поглощения при 280 нм, основанное на присутствии в составе белка остатков ароматических аминокислот тирозина и триптофана. Этот способ прост и требует очень небольшого объема образца. Кроме того, после измерения образец можно использовать вновь. В то же время чувствительность метода невысокая, измерению мешает присутствие любых веществ, поглощающих в ультрафиолетовом диапазоне, в первую очередь остатков нуклеиновых кислот, чей пик поглощения на длине волны 260 нм в значительной степени перекрывает пик белков при 280 нм.
Для количественного и качественного определения белка используют также различные цветные реакции, основанные на взаимодействии определенных аминокислотных остатков с окрашивающими соединениями. К наиболее распространённым методам количественного определения белка относятся анализ на основе бицинхониновой кислоты, анализ методом Брэрдфорда и анализ методом Лоури.
Метод на основе бицинхониновой кислоты использует реакции окислениия ионов меди Cu 2+ до Cu + в щелочной среде под действием аминокислот и образование окрашенного комплекса между ионами Cu + и бицинхониновой кислотой, имеющего пик поглощения при длине волны 562 нм.
Аналитический метод Брэдфорда является одним из самых распространенных методов определения концентрации белка. Метод основан на образовании комплекса между красителем Кумасси бриллиантовым синим G-250 и белками в растворе. Кумасси связывается с главным образом с аргинином, триптофаном, тирозином, гистидином, фенилаланином. Образующиеся комплексы имеют оптическую плотность при 590—595 нм.
Метод Лоури также основан на окислении ионов меди Cu 2+ до Cu + в щелочной среде под действием аминокислот. Далее происходит реакция между ионами меди Cu + и реактивом Фолина с образованием молибденовой сини, имеющей максимум адсорбции при 500—800 нм.
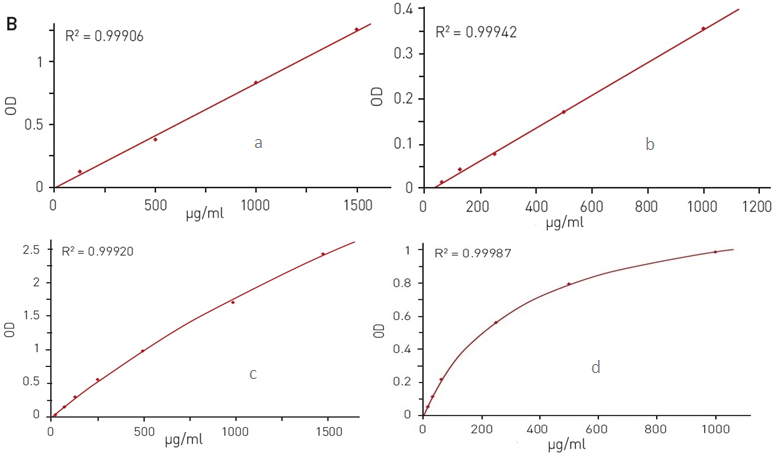
Количественное определение белка: А) путём измерения абсорбции на длине волны 280 нм; Б) методом Брэдфорда; В) методом на основе бицинхониновой кислоты; Г) методом Лоури.
Эксперименты по количественному определению белка могут выполняться в кюветах, а также в микропланшетных ридерах, которые позволяют обрабатывать большое количество образцов за один промежуток времени. Недавно появилась статья, посвящённая применению многорежимных планшетных ридеров BMG Labtech для определения количества белка различными методами. Исследователями было проведено испытание приборов SPECTROstar Nano, FLUOstar Omega, PHERAstar FSX и CLARIOstar. Было проведено четыре эксперимента, основанных на описанных выше методах количественного определения белка. Для детекции использовался широко применяемый в лабораторной практике бычий сывороточный альбумин.