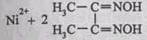Что такое специфическая реакция приведите пример
Типы аналитических реакций и реагентов
Аналитические реакции и аналитические реагенты часто (обычно) подразделяют на специфические (специфичные, характерные), селективные (избирательные) и групповые.
Специфические реагенты и реакции позволяют обнаруживать данное вещество или данный ион в присутствии других веществ или ионов.
Так, например, если в растворе присутствует молекулярный иод I2 , (точнее, более сложное соединение – трииодид-ион I3 – ), то при прибавлении свежеприготовленного водного раствора крахмала исходный раствор окрашивается в синий цвет. Процесс – обратимый; при исчезновении в растворе молекулярного иода (например, при его восстановлении до иодид-ионов I – ) синяя окраска также исчезает и раствор обесцвечивается. Эта реакция широко используется в качественном и количественном химическом анализе. Впервые ее описал в 1815 г. немецкий химик Ф. Штромейер.
Синее окрашивание раствора крахмала в присутствии иода (именно трииодид-ионов, т.к. чистый молекулярный иод I2 даже в отсутствии иодид-ионов I – не окрашивает крахмал) объясняют образованием адсорбционного комплекса между коллоидными макромолекулами крахмала (фракциями неразветвленной амилозы) и трииодид-ионами.
Специфическим реагентом на нитрит-ионы NO2, является реактив Грисса – Илошвая (Илосвая), представляющий собой смесь α-нафтиламина С10H7NH2 и сульфаниловой кислоты НО3SC6Н4NH2), с которым нитрит-ион (обычно в присутствии уксусной кислоты) образует азокраситель НО3SС6Н4N = NС10Н6NН2 красного цвета:
Смесь α-нафтиламина с сульфаниловой кислотой в качестве специфического реагента на нитриты была впервые предложена в 1879 г. немецким химиком П.Гриссом. Позднее эта реакция изучалась венгерским химиком Л. Илошваем (Илосваем). В современной аналитической химии указанную смесь обычно называют «реактив (реагент) Грисса – Илосвая» или просто «реактив Грисса», а соответствующую реакцию – «реакцией Грисса – Илосвая» или «реакцией Грисса». Вместо α-нафтиламина применяют также нафтолы.
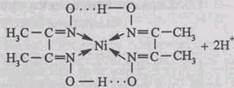
В качестве специфического реагента на ионы никеля Ni 2+ часто используют реактив Чугаева – диметилглиоксим, который в присутствии катионов Ni 2+ в аммиачной среде образует малорастворимый в воде комплекс красного цвета – бисдиметилглиоксимат никеля(П), который традиционно называют никельдиметилглиоксимом:
Диметилглиоксим как специфический и очень чувствительный реагент на ионы никеля Ni 2+ был впервые предложен русским химиком Л.А. Чугаевым в 1905 г. и назван впоследствии его именем («реактив Чугаева»).
Специфических аналитических реагентов и реакций известно довольно мало.
Селективные реагенты и реакции позволяют обнаруживать (одновременно!) несколько веществ или ионов (например, кристаллографические реакции, когда под микроскопом одновременно видны несколько типов кристаллов). Таких реагентов и реакций известно значительно больше, чем специфических.
Групповые реагенты и реакции (частный случай селективных) позволяют обнаруживать все ионы определенной аналитической группы (но при этом их аналитические эффекты суммируются).
Ca 2+ + SO4 2— → CaSO4 ↓
Sr 2+ + SO4 2— → SrSO4 ↓
Ba 2+ + SO4 2— → BaSO4 ↓
Существуют групповые реагенты и для других групп катионов и анионов, а также органических соединений, имеющих в своей структуре одну и ту же функциональную группу (например, амино-группу, гидрокси-группу и др.).
Дата добавления: 2016-01-09 ; просмотров: 7972 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Требования предъявляемые к аналитическим реакциям. Чувствительность и специфичность аналитических реакций
1. Реакции должны протекать быстро.
2. Реакции должны быть практически необратимы.
3. Реакции должны сопровождаться внешним эффектом.
4. Реакция должна отличаться высокой чувствительностью и по возможности специфичностью.
Чувствительность аналитических реакций определяет возможность обнаружения вещества (ионов, молекул) в растворе. Она характеризуется предельным разбавлением, предельной концентрацией, минимальным объемом предельно разбавленного раствораи открываемым минимумом
Предельное разбавление (Vlim, мл/г) – максимальный объем раствора, в котором может быть обнаружен 1 г данного вещества при помощи данной аналитической реакции.
Предельная концентрация (Clim (Cmin), г/мл) – наименьшая концентрация, при которой определяемое вещество может быть обнаружено в растворе данной аналитической реакцией.
Предельная концентрация является обратной величиной предельного разбавления:
Минимальный объем предельно разбавленного раствора (Vmin, мл) – наименьший объем анализируемого раствора, необходимый для обнаружения открываемого вещества данной аналитической реакцией.
Открываемый минимум (m, мкг) – наименьшая масса определяемого вещества, которую при определенных условиях можно открыть действием данного реагента в минимальном объеме предельно разбавленного раствора.
Взаимосвязь между показателями чувствительности реакции выражается формулой:
Аналитическая реакция тем чувствительнее, чем меньше ее открываемый минимум, минимальный объем предельно разбавленного раствора и чем больше предельное разбавление.
Чувствительность аналитических реакций не является постоянной величиной и во многих случаях зависит от условий их выполнения, а также свойств образовавшихся продуктов реакции:
1. Соответствующая среда раствора.
Например, осадки, растворимые в кислотах, не могут выпадать из растворов в присутствии кислот, а осадки, растворимые в щелочах, не выпадают из растворов в щелочной среде. Если осадок растворим в кислотах и щелочах, его можно получить только в нейтральной среде. Таким образом, среда раствора оказывает существенное влияние на ход реакции.
2. Достаточная концентрация обнаруживаемого иона.
От концентрации определяемого иона непосредственно зависит чувствительность реакции, и с возрастанием ее чувствительность реакции обычно повышается.
3. Температура раствора.
Осадки, растворимые при нагревании, могут образоваться только при комнатной температуре. Некоторые аналитические реакции протекают лишь при нагревании. Осадки, растворимость которых возрастает с повышением температуры, выпадают из нагретого раствора не полностью или совсем не выпадают. Такая реакция должна выполняться на холоду.
4.Присутствие в растворе посторонних ионов.
Даже если они и не взаимодействуют с прибавляемым реагентом, обычно снижает чувствительность аналитической реакции. Для устранения мешающего влияния посторонних ионов используют маскирование. В качестве маскирующих неорганических веществ наиболее часто применяют фториды и фосфаты щелочных металлов и аммония. Из органических соединений маскирующим действием обладают винная, лимонная, щавелевая и некоторые другие кислоты. Эти вещества образуют с мешающими ионами прочные комплексные соединения, в результате чего их мешающее действие устраняется.
Наряду с чувствительностью реакций, большое значение для анализа имеет их специфичность.
Специфическими называют реакции, аналитический эффект которых характерен только для одного иона в присутствии других ионов. Примером специфической реакции является образование темно-синего осадка «берлинской лазури» при действии гексацианоферрата(II) калия
Специфические реакции представляют большой интерес для аналитической химии, так как они позволяют открывать нужный ион в присутствии других ионов.
13.Основные положения качественного анализа. Условия проведения аналитических реакций. Обнаружение ионов в смеси: дробный и систематический анализ.
1. Сущность и методы качественного анализа
Основной задачей качественного анализа является установление химического состава, т.е. обнаружение ионов (катионов и анионов), содержащихся в анализируемом веществе.
Химические методы обнаружения и идентификации веществ основаны на проведении аналитических реакций.
Образованием или растворением осадка.
Ba 2+ + SO4 2- → BaSO4↓ (белый кристаллический)
Ba 2+ + CO3 2- → BaCO3↓ (белый кристаллический)
BaSO4 не растворяется в кислотах, BaCO3 растворяется в кислотах.
Образованием характерных кристаллов.
Кристаллы CaSO4⋅2H2O в виде пучков или звездочек. Кристаллы
натрийуранилацетата CH3COONa⋅UO2(CH3COO)2 правильной тетраэдрической
или октаэдрической формы.
Появлении или изменении окраски растворов.
Водные растворы солей железа (III) окрашены в желтый цвет. При взаимодействии ионов Fe 3+ c тиоцианат-ионами раствор приобретает темно-красную окраску:
Выделение газа.
Реакции выделения газов используются для обнаружения анионов летучих и неустойчивых кислот, а также катионов аммония:
Обнаружение ионов проводят дробным и систематическим методом.Анализ, основанный на применении качественных специфических реакций называется дробным. В отдельных порциях раствора в произвольной последовательности проводят открытие отдельных катионов. Так на практическом занятии проводим анализ смеси катионов 4, 5 и 6 групп.
Однако, специфических реакций известно немного. Поэтому в качественном анализе применяют систематический ход анализа, при котором открытие ионов ведется в строгой последовательности, путем выделения групп катионов и анионов с помощью групповых реагентов. После чего внутри каждой группы с помощью тех или иных реакций разделяют и открывают индивидуальные катионы и анионы.
Систематический анализ используют в основном для обнаружения ионов в сложных многокомпонентных смесях. Он очень трудоемок и в настоящее время часто применяют дробно-систематический метод. При таком подходе используется минимальное число групповых реактивов, что позволяет наметить ход анализа в общих чертах, который затем осуществляется дробным методом.
14.Основные положения качественного анализа. Реактивы: специфические, избирательные, групповые. Требования к химическим реактивам в аналитической химии.
1. Сущность и методы качественного анализа
Основной задачей качественного анализа является установление химического состава, т.е. обнаружение ионов (катионов и анионов), содержащихся в анализируемом веществе.
Химические методы обнаружения и идентификации веществ основаны на проведении аналитических реакций.
Образованием или растворением осадка.
Ba 2+ + SO4 2- → BaSO4↓ (белый кристаллический)
Ba 2+ + CO3 2- → BaCO3↓ (белый кристаллический)
BaSO4 не растворяется в кислотах, BaCO3 растворяется в кислотах.
Образованием характерных кристаллов.
Кристаллы CaSO4⋅2H2O в виде пучков или звездочек. Кристаллы
натрийуранилацетата CH3COONa⋅UO2(CH3COO)2 правильной тетраэдрической
или октаэдрической формы.
Появлении или изменении окраски растворов.
Водные растворы солей железа (III) окрашены в желтый цвет. При взаимодействии ионов Fe 3+ c тиоцианат-ионами раствор приобретает темно-красную окраску:
Выделение газа.
Реакции выделения газов используются для обнаружения анионов летучих и неустойчивых кислот, а также катионов аммония:
Реактивы, используемые в химическом анализе, делят на группы, относительно реакций в которых они участвуют:
1) Специфический реактив(характерный)—реактив, с помощью которого в исследуемом растворе обнаруживают один ион.
2)Избирательный реактив – реактивы, позволяющие обнаружить несколько ионов.
3) Групповой реактив – (общий, селективный) реактив взаимодействует в растворе одновременно с несколькими ионами, имеющими общие химические свойства и объединенные в одну группу.
Основными требованиями к химическим реактивам является их чистота. При использовании загрязненных реактивов, содержащих примеси, результаты анализа получаются неверными. По степени чистоты химические реактивы классифицируют на технические (т), чистые(ч) – содержат примеси до 2,0%, чистые для анализа (чда) – до 1,0%, химически чистые (хч) – менее 0,1%, высоко чистые (вэч) и особо чистые (осч). Две последние группы реактивов характеризуются высокой чистотой: 0,01-0,00001% примесей. Чистота реактивов регламентируется ГОСТами и техническими условиями.
Для проведения большинства аналитических работ пользуются реактивами с марками хч и чда. В химические лаборатории реактивы поступают в соответствующей таре, которая снабжена этикеткой. На этикетке указаны название и химическая формула соединения, а также степень чистоты и количественное присутствие допустимых примесей.
Что такое специфическая реакция приведите пример
Специфичные реакции. В качественном анализе практическое значение имеют не все химические реакции. Особенное значение в качественном анализе имеют специфичные реакции.
Специфичными реакциями (или реактивами) называют реакции (или реактивы), при помощи которых можно в определенных условиях обнаруживать одни ионы в присутствии других ионов по специфическому изменению цвета, образованию характерного осадка, выделению газа и т. п. Например, при действии роданида аммония на соли кобальта образуются соединения, окрашенные в ярко-синий цвет, а при действии того же реактива на соли железа (III) образуются соединения, окрашенные в красный цвет. Ионы никеля можно обнаружить по образованию розово-красного осадка при добавлении диметилглиоксима и др.
Чувствительность реакции. Чувствительность реакции определяется наименьшим количеством искомого вещества, которое может быть обнаружено данным реактивом в капле раствора 
Чувствительность реакции выражают рядом взаимно связанных величин: открываемым минимумом, минимальной (предельной) концентрацией, предельным разбавлением.
Открываемым минимумом называют наименьшее количество вещества, содержащееся в исследуемом растворе и открываемое данным реактивом при определенных условиях выполнения реакции. Величина открываемого минимума обычно очень мала, она составляет миллионные доли грамма (0,000001 г или 




Минимальная (предельная) концентрация показывает, при какой наименьшей концентрации раствора данная реакция позволяет еще однозначно открывать обнаруживаемое вещество в небольшой порции (обычно в одной капле) анализируемого раствора.
Например, предельная концентрация 









Предельное разбавление выражается предельным числом миллилитров водного раствора, содержащего 1 г обнаруживаемого вещества, еще открываемого при помощи данной реакции (реактива). Это означает, что в предельно разбавленном растворе, содержащем 1 г открываемых ионов в определенном объеме, данные ионы могут быть обнаружены с помощью избранного реактива в одной капле исследуемого раствора.
Например, предельное разбавление, допускаемое при обнаружении 


Предельное разбавление есть величина, обратная предельной концентрации.
Другими словами, возможность обнаружения того или иного вещества ограничена концентрацией его раствора. Лучшей аналитической реакцией следует считать такую, которая дает возможность обнаруживать не абсолютно малые, а относительно малые количества вещества.
Величина предельного разбавления увеличивается по мере увеличения чувствительности реакции. Очень удобно выражать чувствительность реакции с помощью логарифмов величин предельного разбавления. Для двух сравниваемых реакций, отличающихся друг от друга различными величинами предельного разбавления (10000 и 100000), логарифмы их величин предельного разбавления соответственно равны 4 и 5. Это указывает, что вторая реакция более чувствительна, чем первая.
Следовательно, аналитическая реакция тем чувствительней, чем меньше открываемый минимум, чем меньше минимальная (предельная) концентрация анализируемого раствора, чем больше предельное разбавление.
Требуемые величины вычисляют по формулам:
где 




Пример 1. Вычислить минимальный объем раствора, требуемый для обнаружения 




Решение. Минимальный объем вычисляют по формуле (1):
Таким образом, для обнаружения 



Пример 2. Вычислить величины минимальной концентрации и предельного разбавления соли натрия, если известно, что открываемый минимум ионов натрия в 


Решение. Предельное разбавление вычисляют по формуле (2):
Минимальную (предельную) концентрацию вычисляют по формуле (3):
Пример 3. Вычислить открываемый минимум 



Решение. Открываемый минимум рассчитывают по формуле
Чувствительность реакйии определяется также временем, в течение которого протекает реакция. Более чувствительными считаются реакции, в которых реактив реагирует с обнаруживаемым ионом за более короткий промежуток времени.
Например 





Ионы калия можно открыть действием платинохлористоводородной кислоты, винной кислоты или гексанитрокобальтата (III) натрия. Платинохлористоводородная кислота не осаждает хлорплатинат калия из 


Следовательно, наиболее чувствительной является последняя реакция. Еще более чувствительна на 
Чувствительность реакции зависит от условий ее проведения и остается постоянной только при точном соблюдении всех условий. Чувствительность реакции изменяется в присутствии посторонних веществ.
Отношение количества исследуемого вещества, которое еще может быть обнаружено в присутствии постороннего вещества, к количеству постороннего вещества, изменяющего чувствительность данной реакции, называют предельным отношением.
Интервал концентраций данного иона, в пределах которого пробы с данным реактивом дают то положительную, то отрицательную реакцию, называют областью ненадежной реакции.
Следует иметь в виду, что область ненадежной реакции сильно расширяется, если реакция проводится не при строго определенных условиях. Например, бесполезно пытаться осаждать растворимые в кислотах осадки в сильнокислой среде (при 

Интересно отметить, что согласно исследованиям профессора Флорентийского университета Джоржио Пиккарда, самый опытный эспериментатор в самых строгих лабораторных опытах способен контролировать лишь только некоторые условия проведения реакций (температуру, давление, концентрацию реагирующих веществ, 
Например, течение реакций зависит также от напряжения окружающего магнитного поля, меняющегося в зависимости от времени в соответствии с характером движения Земли в космическом пространстве.