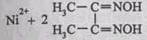Что такое специфические реакции и реактивы приведите примеры специфических реакций объясните
Большая Энциклопедия Нефти и Газа
Специфический реактив
Специфические реактивы предназначаются для обнаружения искомых ионов в присутствии других ионов. Например, К4 [ Ре ( СМ) б ] является специфическим реактивом на железо ( III), с которым он образует синий осадок берлинской лазури; K3 [ Fe ( CN) 6 ] является специфическим реактивом на железо ( II), реагируя с которым, он образует синий осадок турнбулевой сини; диметилглиоксим ( реактив Л. А. Чугаева) является наиболее специфическим реактивом на ионы никеля и образует с Ni в аммиачной среде кристаллический осадок диметилглиоксимата никеля розово-красного цвета. [1]
Специфические реактивы предназначаются для обнаружения искомых ионов в присутствии других ионов. Например, K4 [ Fe ( CN) e ] является специфическим реактивом на ионы железа ( III), с которыми он образует синий осадок берлинской лазури; K3 [ Fe ( CN) 6l является специфическим реактивом на ионы железа ( II), реагируя с которыми он образует синий осадок турнбулевой сини; диметилглиоксим ( реактив Л. А. Чугаева) является наиболее специфическим реактивом на ионы никеля и образует с Ni в аммиачной среде кристаллический осадок диметилглиок-симата никеля розово-красного цвета. [2]
Селективные и специфические реактивы применяют главным образом при открытии отдельных ионов. Но если при реакциях отделения самым существенным является полнота этого отделения, то при реакциях открытия это обстоятельство не имеет решающего значения. Здесь важно выбрать такую реакцию и создать такие условия, чтобы реакция протекала быстро, чтобы окраска раствора была наиболее интенсивна, чтобы осадок выделялся крупнозернистый и был бы легко заметен. Полное превращение веществ при открытии ионов часто бывает излишним. [3]
Специфических реактивов известно очень мало. Они дают характерные реакции с одним каким-либо ионом в присутствии других ионов. Примером могут служить диметилглиоксим, который образует с ионом № 2 кристаллический осадок ало-красного цвета, или феррон, который дает с ионом Fe3 интенсивно зеленое окрашивание. [4]
Специфическими реактивами обнаруживают определенный вид ионов, содержащихся в растворе вместе с другими ионами. [5]
Специфическими реактивами являются такие реактивы, которые взаимодействуют с одним ионом. Такие реактивы позволяют обнаружить искомый ион в присутствии любых других ионов. [6]
Специфическими реактивами называются такие реактивы, которые дают в определенных условиях характерную реакцию только с одним каким-либо ионом. [9]
Специфическими реактивами являются такие реактивы, которые взаимодействуют с одним ионом. Такие реактивы позволяют обнаружить искомый ион в присутствии любых других ионов. [10]
Другим специфическим реактивом на меркаптаны является изатин-лак-там о-аминофенилглиоксалевой кислоты, который используют при фотометрическом определении меркаптанов в воздухе рабочей зоны. [11]
Приготовление специфических реактивов обычно не представляет особых затруднений. [13]
Отсутствие специфического реактива на ССС и сходство реакций на ССС и эндогенные холин и бетаин делает затруднительным его определение весовым или колориметрическим методами без предварительного его выделения. [14]
Отсутствие строго специфических реактивов на шестичлеиное ктонное кольцо требует снятия для этих веществ УФ спектров, е они показывают характерную полосу поглощения при 300 нм. [15]
Аналитические реакции (общие и частные) и требования, предъявляемые к ним. Способы и условия выполнения аналитических реакций.
Аналитические реакции –это реакции, которые сопровождаются выпадением или растворением осадка, изменением окраски анализируемого раствора, выделением газообразных веществ.
Различают общиеичастные аналитические реакции.
Частные реакции характерны для определенного иона или соединения, например, образование газообразного аммиака при нагревании со щелочью – частная реакция для обнаружения катиона аммония:
Количество частных реакций, позволяющих обнаружить, или «открыть», отдельный ион в сложной смеси, весьма ограничено. Поэтому чаще всего открытию индивидуального иона предшествует разделение ионов на группы с помощью общих, или групповых реакций, затем удаление ионов, мешающих открытию индивидуального иона.
Требования, предъявляемые к аналитическим реакциям. Аналитическая реакция должна протекать достаточно быстро, необратимо и быть достаточно простой по выполнению.Для аналитических реакций также важнейшими требованиями являютсяспецифичность и чувствительность.
Чем меньшее количество ионов вступает в реакцию с данным реактивом, тем более специфична данная реакция.
Специфичными (или специфическими) называют реакции или реактивы, при помощи которых можно в определенных условиях обнаруживать одни ионы в присутствии других ионов по специфическому изменению цвета, образованию характерного осадка, выделению газа и т.д.Чем меньшее количество вещества может быть определено с помощью данного реактива, тем более чувствительна эта реакция.
Чувствительность реакции определяется наименьшим количеством искомого вещества, которое может быть обнаружено данным реактивом в капле (0,02-0,04 мл) раствора по данной методике. Количественно чувствительность характеризуется тремя взаимосвязанными показателями: пределом обнаружения, предельной концентрацией, предельным разбавлением
Предельная (минимальная) концентрация показывает, при какой наименьшей концентрации раствора данная реакция еще позволяет однозначно открывать обнаруживаемое вещество в небольшой порции (обычно в одной капле) анализируемого раствора.
Качественная аналитическая реакция должна иметь четкие визуальные признаки. Аналитическими признаками являются: образование осадка характерного вида,растворимость (или нерастворимость) веществ в различных средах, возникновение или исчезновение окраски, окрашивание пламени горелки в определенный цвет, выделение газа и т.п.
Выполняя аналитическую реакцию, нужно строго соблюдать определенные условия.
Одним из условий выполнения реакций является среда анализируемого раствора. Например, нельзя обнаруживать ион Са2+ действием оксалата аммония (NH4)2C2O4 в присутствии сильной кислоты, так как оксалат кальция СаС2О4 растворим в сильных кислотах.
Другим условием выполнения реакций является поддержание необходимой температуры раствора. Большинство аналитических реакций выполняют „на холоду”, т. е. при комнатной температуре или даже при охлаждении пробирки водой под краном.
Типы аналитических реакций и реагентов
Аналитические реакции и аналитические реагенты часто (обычно) подразделяют на специфические (специфичные, характерные), селективные (избирательные) и групповые.
Специфические реагенты и реакции позволяют обнаруживать данное вещество или данный ион в присутствии других веществ или ионов.
Так, например, если в растворе присутствует молекулярный иод I2 , (точнее, более сложное соединение – трииодид-ион I3 – ), то при прибавлении свежеприготовленного водного раствора крахмала исходный раствор окрашивается в синий цвет. Процесс – обратимый; при исчезновении в растворе молекулярного иода (например, при его восстановлении до иодид-ионов I – ) синяя окраска также исчезает и раствор обесцвечивается. Эта реакция широко используется в качественном и количественном химическом анализе. Впервые ее описал в 1815 г. немецкий химик Ф. Штромейер.
Синее окрашивание раствора крахмала в присутствии иода (именно трииодид-ионов, т.к. чистый молекулярный иод I2 даже в отсутствии иодид-ионов I – не окрашивает крахмал) объясняют образованием адсорбционного комплекса между коллоидными макромолекулами крахмала (фракциями неразветвленной амилозы) и трииодид-ионами.
Специфическим реагентом на нитрит-ионы NO2, является реактив Грисса – Илошвая (Илосвая), представляющий собой смесь α-нафтиламина С10H7NH2 и сульфаниловой кислоты НО3SC6Н4NH2), с которым нитрит-ион (обычно в присутствии уксусной кислоты) образует азокраситель НО3SС6Н4N = NС10Н6NН2 красного цвета:
Смесь α-нафтиламина с сульфаниловой кислотой в качестве специфического реагента на нитриты была впервые предложена в 1879 г. немецким химиком П.Гриссом. Позднее эта реакция изучалась венгерским химиком Л. Илошваем (Илосваем). В современной аналитической химии указанную смесь обычно называют «реактив (реагент) Грисса – Илосвая» или просто «реактив Грисса», а соответствующую реакцию – «реакцией Грисса – Илосвая» или «реакцией Грисса». Вместо α-нафтиламина применяют также нафтолы.
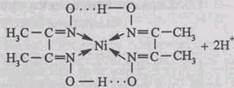
В качестве специфического реагента на ионы никеля Ni 2+ часто используют реактив Чугаева – диметилглиоксим, который в присутствии катионов Ni 2+ в аммиачной среде образует малорастворимый в воде комплекс красного цвета – бисдиметилглиоксимат никеля(П), который традиционно называют никельдиметилглиоксимом:
Диметилглиоксим как специфический и очень чувствительный реагент на ионы никеля Ni 2+ был впервые предложен русским химиком Л.А. Чугаевым в 1905 г. и назван впоследствии его именем («реактив Чугаева»).
Специфических аналитических реагентов и реакций известно довольно мало.
Селективные реагенты и реакции позволяют обнаруживать (одновременно!) несколько веществ или ионов (например, кристаллографические реакции, когда под микроскопом одновременно видны несколько типов кристаллов). Таких реагентов и реакций известно значительно больше, чем специфических.
Групповые реагенты и реакции (частный случай селективных) позволяют обнаруживать все ионы определенной аналитической группы (но при этом их аналитические эффекты суммируются).
Ca 2+ + SO4 2— → CaSO4 ↓
Sr 2+ + SO4 2— → SrSO4 ↓
Ba 2+ + SO4 2— → BaSO4 ↓
Существуют групповые реагенты и для других групп катионов и анионов, а также органических соединений, имеющих в своей структуре одну и ту же функциональную группу (например, амино-группу, гидрокси-группу и др.).
Дата добавления: 2016-01-09 ; просмотров: 7975 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Что такое специфические реакции и реактивы приведите примеры специфических реакций объясните
Специфичные реакции. В качественном анализе практическое значение имеют не все химические реакции. Особенное значение в качественном анализе имеют специфичные реакции.
Специфичными реакциями (или реактивами) называют реакции (или реактивы), при помощи которых можно в определенных условиях обнаруживать одни ионы в присутствии других ионов по специфическому изменению цвета, образованию характерного осадка, выделению газа и т. п. Например, при действии роданида аммония на соли кобальта образуются соединения, окрашенные в ярко-синий цвет, а при действии того же реактива на соли железа (III) образуются соединения, окрашенные в красный цвет. Ионы никеля можно обнаружить по образованию розово-красного осадка при добавлении диметилглиоксима и др.
Чувствительность реакции. Чувствительность реакции определяется наименьшим количеством искомого вещества, которое может быть обнаружено данным реактивом в капле раствора 
Чувствительность реакции выражают рядом взаимно связанных величин: открываемым минимумом, минимальной (предельной) концентрацией, предельным разбавлением.
Открываемым минимумом называют наименьшее количество вещества, содержащееся в исследуемом растворе и открываемое данным реактивом при определенных условиях выполнения реакции. Величина открываемого минимума обычно очень мала, она составляет миллионные доли грамма (0,000001 г или 




Минимальная (предельная) концентрация показывает, при какой наименьшей концентрации раствора данная реакция позволяет еще однозначно открывать обнаруживаемое вещество в небольшой порции (обычно в одной капле) анализируемого раствора.
Например, предельная концентрация 









Предельное разбавление выражается предельным числом миллилитров водного раствора, содержащего 1 г обнаруживаемого вещества, еще открываемого при помощи данной реакции (реактива). Это означает, что в предельно разбавленном растворе, содержащем 1 г открываемых ионов в определенном объеме, данные ионы могут быть обнаружены с помощью избранного реактива в одной капле исследуемого раствора.
Например, предельное разбавление, допускаемое при обнаружении 


Предельное разбавление есть величина, обратная предельной концентрации.
Другими словами, возможность обнаружения того или иного вещества ограничена концентрацией его раствора. Лучшей аналитической реакцией следует считать такую, которая дает возможность обнаруживать не абсолютно малые, а относительно малые количества вещества.
Величина предельного разбавления увеличивается по мере увеличения чувствительности реакции. Очень удобно выражать чувствительность реакции с помощью логарифмов величин предельного разбавления. Для двух сравниваемых реакций, отличающихся друг от друга различными величинами предельного разбавления (10000 и 100000), логарифмы их величин предельного разбавления соответственно равны 4 и 5. Это указывает, что вторая реакция более чувствительна, чем первая.
Следовательно, аналитическая реакция тем чувствительней, чем меньше открываемый минимум, чем меньше минимальная (предельная) концентрация анализируемого раствора, чем больше предельное разбавление.
Требуемые величины вычисляют по формулам:
где 




Пример 1. Вычислить минимальный объем раствора, требуемый для обнаружения 




Решение. Минимальный объем вычисляют по формуле (1):
Таким образом, для обнаружения 



Пример 2. Вычислить величины минимальной концентрации и предельного разбавления соли натрия, если известно, что открываемый минимум ионов натрия в 


Решение. Предельное разбавление вычисляют по формуле (2):
Минимальную (предельную) концентрацию вычисляют по формуле (3):
Пример 3. Вычислить открываемый минимум 



Решение. Открываемый минимум рассчитывают по формуле
Чувствительность реакйии определяется также временем, в течение которого протекает реакция. Более чувствительными считаются реакции, в которых реактив реагирует с обнаруживаемым ионом за более короткий промежуток времени.
Например 





Ионы калия можно открыть действием платинохлористоводородной кислоты, винной кислоты или гексанитрокобальтата (III) натрия. Платинохлористоводородная кислота не осаждает хлорплатинат калия из 


Следовательно, наиболее чувствительной является последняя реакция. Еще более чувствительна на 
Чувствительность реакции зависит от условий ее проведения и остается постоянной только при точном соблюдении всех условий. Чувствительность реакции изменяется в присутствии посторонних веществ.
Отношение количества исследуемого вещества, которое еще может быть обнаружено в присутствии постороннего вещества, к количеству постороннего вещества, изменяющего чувствительность данной реакции, называют предельным отношением.
Интервал концентраций данного иона, в пределах которого пробы с данным реактивом дают то положительную, то отрицательную реакцию, называют областью ненадежной реакции.
Следует иметь в виду, что область ненадежной реакции сильно расширяется, если реакция проводится не при строго определенных условиях. Например, бесполезно пытаться осаждать растворимые в кислотах осадки в сильнокислой среде (при 

Интересно отметить, что согласно исследованиям профессора Флорентийского университета Джоржио Пиккарда, самый опытный эспериментатор в самых строгих лабораторных опытах способен контролировать лишь только некоторые условия проведения реакций (температуру, давление, концентрацию реагирующих веществ, 
Например, течение реакций зависит также от напряжения окружающего магнитного поля, меняющегося в зависимости от времени в соответствии с характером движения Земли в космическом пространстве.