Что такое специфический иммунитет неспецифический иммунитет
Что такое специфический иммунитет неспецифический иммунитет
Во внутренней среде организма присутствуют клетки и молекулы, которые обеспечивают защитную функцию (иммунитет). Часть из них относятся к факторам врожденного иммунитета, т. е. присутствуют в организме еще до встречи с каким-либо болезнетворным микроорганизмом или чужеродной молекулой. К таким факторам защиты относятся фагоцитирующие клетки крови и тканей, а также большие гранулярные лимфоциты, получившие название «натуральные (естественные) киллеры». Врожденными факторами защиты организма являются также молекулы, продуцируемые и секретируемые вышеназванными клетками, а также лимфоцитами, стромальными и другими клетками. К таким молекулам относятся: белки системы комплемента, медиаторы межклеточного взаимодействия — цитокины и др. Белки системы комплемента продуцируются постоянно и циркулируют в крови, большинство цитокинов начинают продуцироваться и секре-тироваться клетками только в ответ на сигнал активации (например, на контакт с микроорганизмом).
Более эффективным способом защиты внутренней среды организма от проникающих в нее чужеродных агентов (антигенов) является специфический иммунный ответ, в результате которого организм приобретает дополнительные защитные механизмы: активированные клетки и продуцируемые ими молекулы. Защитное действие этих механизмов строго избирательно (специфично) в отношении того конкретного антигена (например, патогенного микроорганизма), контакт с которым вызвал иммунный ответ. Специфический иммунный ответ является функцией клеток и органов иммунной системы.
Главными клетками иммунной системы являются Т- и В-лимфоциты, которые рециркулируют в системе кровотока и лимфотока, постоянно перемещаясь из одних органов иммунной системы в другие, обладают способностью выходить в ткани для выполнения защитных функций (рис. 8.1).
В защитных реакциях специфического иммунитета кроме Т- и В-лим-фоцитов участвуют фагоцитирующие клетки (гранулоциты, моноциты, макрофаги), «естественные киллеры, тучные клетки, эндотелиальные и эпителиальные клетки, которые играют роль вспомогательных, взаимодействуя с Т- и В-лимфоцитами.
Гуморальный иммунитет
Чтобы понять, как именно человеческий организм защищается от болезней, необходимо разобраться в таком понятии как гуморальный иммунитет.
Что такое гуморальный иммунитет?
Гуморальный иммунитет входит в так называемый специфический иммунитет организма. Перед тем, как он начинает работать, срабатывает другой, первый ответ — неспецифический. В чем разница между ними и почему так важен специфический иммунитет?
Неспецифический и специфический иммунитет — особенности и отличия
В ситуации, когда есть риск заразиться инфекцией, организм запускает иммунный ответ. Первый этап, предшествующий ему, — это неспецифический иммунитет, нейтрализация действия опасного возбудителя.
Неспецифический иммунитет — это особенности организма, которые влияют на его способность защищаться от инфекции. Например, кожный барьер, который предотвращает проникновение патогена в организм, или пот, который является кислым и убивает некоторые бактерии. Слизистые оболочки и содержащиеся в них ферменты также обладают неспецифическим иммунитетом.
Гуморальный ответ, или специфический иммунитет, работает иначе. Он — второй защитник, который действует, когда первый терпит неудачу и не может побороть патогенный микроорганизм. В игру вступают лимфоциты, которые оценивают, нужна ли соответствующая иммунная реакция, то есть диагностируют, имеет ли данный патоген, попадая в организм, чужеродный антиген (характеристика данной клетки) или, наоборот, — это собственный антиген организма, и поэтому полностью безопасен. При обнаружении угрозы происходит соответствующая иммунная реакция, так называемый гуморальный иммунный ответ.
Распознавание чужеродных антигенов — в игру вступает гуморальный
Когда лимфоциты-помощники распознают антиген как чужеродный, вступает гуморальный ответ, направленный на уничтожение вредных клеток, патогенов. В хорошем варианте развития ситуации болезнь не наступает, поскольку организм справился с проблемой.
Что делать, если гуморальный и клеточный ответы не работают?
Гуморальный и клеточный ответ не всегда работает успешно и не всегда могут уберечь организм от болезней. В мире много людей, чьи гуморальные и клеточные реакции не работают должным образом. Организм теряет иммунитет, что делает его более восприимчивым к разного рода инфекциям.
Иногда гуморальный иммунитет разрушается под действием сильнодействующих препаратов, иногда из-за аллергии, во время которой человеческий организм считает безопасные вещества вредными и реагирует на них совершенно без надобности, т. е. тоже не работает должным образом.
Людям с ослабленным гуморальным ответом стоит сосредоточиться на том, как эффективно повысить иммунитет, чтобы усилить работу всей иммунной системы.
Эффективные способы укрепить ослабленный иммунитет
Как уже сказано, иммунная система не всегда работает идеально. Иммунитет может быть снижен в определенное время, особенно в осенне-зимний период, необходимо сделать все, чтобы его укрепить.
Если вы хотите повысить свой иммунитет, нужно вести здоровый образ жизни (правильное питание, занятия спортом, достаточное количество сна, соблюдение правил гигиены) и принимать лекарства, стимулирующие иммунную систему — стоит использовать те, которые содержат водный экстракт алоэ, африканской герани или эхинацеи.
Знание того, как работает иммунная система, помогает понять ту важную роль, которую она играет в организме. Ведя правильный образ жизни, человек помогает своему организму бороться с патогенами и снижает количество и тяжесть болезней.
Как устроен иммунитет: Объясняем по пунктам
Андрей Смирнов СПИД.ЦЕНТР
«Йогурт для укрепления иммунитета», «Иммуностимулирующие витамины», «Да простудился, наверное, иммунитет упал»… Мы слышим слово «иммунитет» так часто, что уже почти не задумываемся, как он устроен и работает. На уроках биологии нам рассказывали, что иммунитет защищает от микробов, но только ли этим ограничивается его функция и как именно он понимает, от кого нужно нас защищать? СПИД.ЦЕНТР объясняет, как устроена иммунная система.
Наш организм непрерывно меняется, но при этом очень «любит» постоянство и может нормально работать только при определенных параметрах своей внутренней среды. Например, нормальная температура тела колеблется между 36 и 37 градусами по Цельсию. Вспомните последнюю простуду и то, как плохо вы себя чувствовали, стоило температуре подняться всего на полградуса. Такая же ситуация и с другими показателями: артериальным давлением, рН крови, уровнем кислорода и глюкозы в крови и другими. Постоянство значений этих параметров называется гомеостазом, а поддержкой его стабильного уровня занимаются практически все органы и системы организма: сердце и сосуды поддерживают постоянное артериальное давление, легкие — уровень кислорода в крови, печень — уровень глюкозы и так далее.
Иммунная же система отвечает за генетический гомеостаз. Она помогает поддерживать постоянство генетического состава организма. То есть ее задача — уничтожать не только все чужеродные организмы и продукты их жизнедеятельности, проникающие извне (бактерии, вирусы, грибки, токсины и прочее), но также и клетки собственного организма, если «что-то пошло не так» и, например, они превратились в злокачественную опухоль, то есть стали генетически чужеродными.
Как клетки иммунной системы уничтожают «врагов»?
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
Иммунитет бывает врожденным (он же неспецифический) и приобретенным (он же адаптивный, или специфический). Врожденный иммунитет одинаков у всех людей и идентичным образом реагирует на любых «врагов». Реакция начинается немедленно после проникновения микроба в организм и не формирует иммунологическую память. То есть, если такой же микроб проникнет в организм снова, система неспецифического иммунитета его «не узнает» и будет реагировать «как обычно». Неспецифический иммунитет очень важен — он первым сигнализирует об опасности и немедленно начинает давать отпор проникшим микробам.
по теме
Мнение
«Иммунитет пациента с ВИЧ похож на иммунитет пожилого человека»
Однако эти реакции не могут защитить организм от серьезных инфекций, поэтому после неспецифического иммунитета в дело вступает приобретенный иммунитет. Здесь уже реакция организма индивидуальна для каждого «врага», поэтому «арсенал» специфического иммунитета у разных людей различается и зависит от того, с какими инфекциями человек сталкивался в жизни и какие прививки делал.
Специфическому иммунитету нужно время, чтобы изучить проникшую в организм инфекцию, поэтому реакции при первом контакте с инфекцией развиваются медленнее, зато работают гораздо эффективнее. Но самое главное, что, один раз уничтожив микроба, иммунная система «запоминает» его и в следующий раз при столкновении с таким же реагирует гораздо быстрее, часто уничтожая его еще до появления первых симптомов заболевания. Именно так работают прививки: когда в организм вводят ослабленных или убитых микробов, которые уже не могут вызвать заболевание, у иммунной системы есть время изучить их и запомнить, сформировать иммунологическую память. Поэтому, когда человек после вакцинации сталкивается с реальной инфекцией, иммунная система уже полностью готова дать отпор, и заболевание не начинается вообще или протекает гораздо легче.
Кто отвечает за работу различных видов иммунитета?
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.
Как клетки иммунной системы отличают «своих» от «чужих» и понимают, с кем нужно бороться?
В этом им помогает главный комплекс гистосовместимости первого типа (MHC-I). Это группа белков, которая располагается на поверхности каждой клетки нашего организма и уникальна для каждого человека. Это своего рода «паспорт» клетки, который позволяет иммунной системе понимать, что перед ней «свои». Если с клеткой организма происходит что-то нехорошее, например, она поражается вирусом или перерождается в опухолевую клетку, то конфигурация MHC-I меняется или же он исчезает вовсе. Натуральные киллеры и Т-киллеры умеют распознавать MHC-I рецептор, и как только они находят клетку с измененным или отсутствующим MHC-I, они ее убивают. Так работает клеточный иммунитет.
по теме
Эпидемия
Учёные выяснили, как вирусы обманывают иммунитет
Но у нас есть еще один вид иммунитета — гуморальный. Основными защитниками в этом случае являются антитела — специальные белки, синтезируемые B-лимфоцитами, которые связываются с чужеродными объектами (антигенами), будь то бактерия, вирусная частица или токсин, и нейтрализуют их. Для каждого вида антигена наш организм умеет синтезировать специальные, подходящие именно для этого антигена антитела. Молекулу каждого антитела, также их называют иммуноглобулинами, можно условно разделить на две части: Fc-участок, который одинаков у всех иммуноглобулинов, и Fab-участок, который уникален для каждого вида антител. Именно с помощью Fab-участка антитело «прилипает» к антигену, поэтому строение этого участка молекулы зависит от строения антигена.
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
Рассмотрим этот процесс на примере развития бактериальной инфекции. Например, вы поцарапали палец. При повреждении кожи в рану чаще всего попадают бактерии. При повреждении любой ткани организма сразу же запускается воспалительная реакция. Поврежденные клетки выделяют большое количество разных веществ — цитокинов, к которым очень чувствительны нейтрофилы и макрофаги. Реагируя на цитокины, они проникают через стенки капилляров, «приплывают» к месту повреждения и начинают поглощать и переваривать попавших в рану бактерий — так запускается неспецифический иммунитет, но до синтеза антител дело пока еще не дошло.
Расправляясь с бактериями, макрофаги выводят на свою поверхность разные их кусочки, чтобы познакомить Т-хелперов и B-лимфоцитов со строением этих бактерий. Этот процесс называется презентацией антигена. Т-хелпер и B-лимфоцит изучают кусочки переваренной бактерии и подбирают соответствующую структуру антитела так, чтобы потом оно хорошо «прилипало» к таким же бактериям. Так запускается специфический гуморальный иммунитет. Это довольно длительный процесс, поэтому при первом контакте с инфекцией организму может понадобиться до двух недель, чтобы подобрать структуру и начать синтезировать нужные антитела.
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
Понятие иммунитета. Справка
Иммунитет (от латинского Immunitas – освобождение) – невосприимчивость, сопротивляемость организма инфекциям и вторжению чужеродных организмов (в том числе — болезнетворных микроорганизмов) и относительная устойчивость к вредным веществам.
Различают несколько видов иммунитета:
Специфический и неспецифический иммунитет
Для возникновения подобной реакции чужеродный агент должен иметь поверхность, т.е. быть частицей (например, заноза).
Если же вещество молекулярно-дисперсное (например, белок, полисахарид, вирус), не токсичное и не обладает физиологической активностью, оно не может быть нейтрализовано и выведено организмом по вышеописанной схеме.
Первичный и вторичный иммунный ответ
Вторичный иммунный ответ развивается при последующем контакте с тем же самым антигеном. Основная особенность – быстрое развитие лимфоцитов с дифференцировкой их в зрелые клетки и быстрая выработка большого количества антител, которые высвобождаются в кровь и тканевую жидкость, где могут встретиться с антигеном и эффективно побороть болезнь.
Естественный и искусственный иммунитет
К факторам естественного иммунитета относят иммунные (система комплемента, лизоцим и др. белки) и неиммунные механизмы (кожа, слизистая, секрет потовых, сальных, слюнных желез, желез желудка, нормальная микрофлора).
Искусственный иммунитет вырабатывается при введении в организм вакцины или иммуноглобулина.
Активный и пассивный иммунитет
Активная иммунизация стимулирует собственный иммунитет человека, вызывая выработку собственных антител. После инфекции в организме остаются «клетки памяти», и в случае последующих столкновений с возбудителем они начинают снова (уже быстрее) продуцировать антитела.
При пассивной иммунизации в организм вводятся уже готовые антитела (гаммаглобулин). Введенные антитела при столкновении с возбудителем «расходуются» (связываются с возбудителем в комплекс «антиген-антитело»).
Пассивная иммунизация показана, когда необходимо в короткие сроки создать иммунитет на непродолжительное время (например, после контакта с больным).
Стерильный и нестерильный иммунитет
Регуляция иммунитета
Работа иммунитета во многом определяется состоянием нервной и эндокринной систем организма. Стресс, депрессии угнетают иммунитет, что сопровождается не только повышенной восприимчивостью к различным заболеваниям, но и создает благоприятные условия для развития злокачественных новообразований.
Материал подготовлен на основе информации открытых источников
Что такое специфический иммунитет неспецифический иммунитет
Развитие иммунологического направления в биологических исследованиях психических заболеваний всегда было тесно связано с прогрессом в фундаментальной иммунологии. Оно отражало все этапы развития иммунологии — от первых концепций гуморального иммунитета до современных теорий клеточно-гуморальных взаимодействий при формировании иммунного ответа в организме человека. Здесь мы кратко изложим основные положения современной иммунологии.
СТРОЕНИЕ И ПРИНЦИПЫ ФУНКЦИОНИРОВАНИЯ ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА
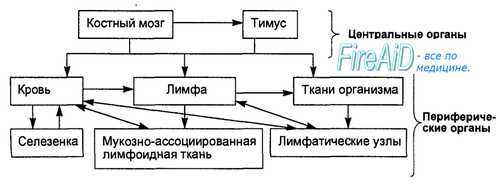
Иммунологическая функция осуществляется специализированной системой клеток, тканей и органов, которая называется иммунной (рис. 19). Главными особенностями иммунной системы являются ее распространенность по всему организму, постоянная рециркуляция соответствующих иммунных клеток и их способность вырабатывать специфические молекулы — антитела в отношении каждого антигена. Функционирование иммунной системы обеспечивается ее морфологическим субстратом, основными компонентами которого являются центральные и периферические лимфоидные органы, кровеносные и лимфатические сосуды. Все перечисленные компоненты функционируют как единое целое и это единство обеспечивается внутрисистемными связями, генетической обусловленностью и механизмами нейроэндокринной регуляции.
Иммунную систему в морфологическом аспекте можно рассматривать как совокупность лимфоцитов, макрофагов, ряда сходных с макрофагами клеток, включая дендритные клетки и эпителиальные клетки Лангерганса (эпидермоциты белые отростчатые). Клеточные элементы иммунной системы организованы в тканевые и органные структуры, к которым относятся селезенка, лимфатические узлы, групповые лимфатические фолликулы (пейеровы бляшки) кишечника, миндалины, вилочковая железа (тимус) и костный мозг. К иммунной системе относятся также лимфоциты и макрофаги, которые составляют рециркулирующую популяцию иммунных клеточных элементов.
Иммунная реакция может быть неспецифической (неспецифический иммунитет) и специфической (специфический иммунитет).
Неспецифический иммунитет обеспечивает первую линию зашиты от чужеродных частиц и организмов и осуществляется несколькими типами клеток. Например, фагоциты — моноциты крови и тканевые Макрофаги — поглощают и разрушают многие чужеродные частицы. Полиморфно-ядерные лейкоциты вместе с тучными клетками участвуют в защите от микроорганизмов, являясь важнейшими компонентами реакции острого воспаления. Кроме того, еще один класс клеток, названный естественными киллерами (от англ., kill — убивать), обеспечивает первую линию защиты организма, поражая инфицированные вирусами или неопластическим процессом клетки собственного организма. В формировании реакций неспецифического иммунитета важную роль играют так называемые белки острой фазы воспаления и система комплемента.
Специфический иммунитет отличается от неспецифического наличием специфичности, обучаемости и памяти. Как уже говорилось, отдельный лимфоцит имеет на своей поверхности только один тип рецептора (антигенсвязывающего центра) и поэтому отвечает только на один или несколько родственных антигенных структур выработкой антител. Если однажды индивидуум встречался со специфическим антигеном, то соответствующие лимфоциты запоминают его структуру. Повторная встреча с этим же антигеном ведет к тому, что иммунная система вспоминает его и ответ на него бывает более быстрым и сильным. Феномены обучения и памяти осуществляются по законам так называемой клональной селекции. Лимфоцит, который распознает антиген, пролиферирует в клон идентичных клеток, каждая из которых несет на себе рецепторы той же специфичности, т.е. способна продуцировать соответствующие этой специфичности антитела. В последнем случае лимфоциты дифференцируются в антителопродуцирующие плазматические клетки, другие же лимфоциты остаются длительно живущими клетками памяти. Клетки памяти сохраняют готовность активироваться при каждой последующей встрече с идентичным антигеном, оставаясь неактивными («отдыхающими») клетками. В результате последующей активации происходит значительное увеличение числа лимфоцитов, способных распознать данный антиген за счет быстрой и широкой пролиферации лимфоцитов. Таким образом, вторичная иммунная реакция по сравнению с первичной всегда более быстрая и сильная (феномен обучения на уровне клеточных популяций).
Лимфоциты различаются между собой не только по специфичности своих рецепторов, но и по их функциональным свойствам. Согласно последним, различают два основных класса лимфоцитов: В-лимфоциты и Т-лимфоциты. В соответствии с этим различают Т- и В-системы иммунитета. Формирование их происходит по путям, изображенным на рис.19: стволовая кроветворная клетка (СКК), или клетка-предшественник лимфопоэза, мигрируя из костного мозга (КМ) в тимус, или вилочковую железу (ВЖ), дифференцируется под влиянием микроокружения этого органа в Т-клетку. При миграции СКК в сумку Фабрициуса (СФ) у птиц или неизвестный аналог данного органа у млекопитающих происходит дифференцировка в клетки В-ряда. Из центральных органов иммунитета клетки расселяются в периферические органы иммунной системы — селезенку (С), лимфатические узлы (ЛУ) и др., где они приобретают функциональные особенности, свойственные зрелым Т- и В-лимфоцитам (Т,В). Т-лимфоциты представлены киллерами (Тк), Т-супрессорами (Тс) и Т-хелперами (Тх). К зрелым клеточным популяциям относятся также плазмоциты (ПЦ). Конечная клетка В-клеточного пути дифференцировки активно синтезирует и секретирует антитела.
В-лимфоциты происходят из клеток-предшественников костного мозга ( bone marrow ). Место их созревания у человека остается неизвестным. В-лимфоциты являются антителообразующими клетками. Т-лимфоциты, или тимусзависимые лимфоциты, также происходят из клеток-предшественников костного мозга, но затем созревают и дифференцируются в вилочковой железе — тимусе ( thymus ). Т-лимфоциты подразделяются на ряд подклассов. Часть из них опосредуют важные регуляторные функции: «помогают» — хелперы (от англ., help ) или «подавляют» — супрессоры (от англ., supress ) развитие иммунного ответа, в том числе и образование антител. Т-лимфоциты выполняют также эффекторные функции, например вырабатывают растворимые вещества, запускающие разнообразные воспалительные реакции, или осуществляют прямое разрушение клеток, несущих на себе антигены (киллерная функция). В соответствии с этим различают следующие подклассы Т-лимфоцитов: Т-хелперы, Т-супрессоры, Т-киллеры и Т-клетки, участвующие в реакции замедленной гиперчувствительности и связанных с нею иммунологических явлениях.
На мембранах зрелой В-клетки имеются рецепторы для антигена. При связывании антигена с этими рецепторами клетка активируется. Для такой активации обычно нужно, чтобы В-клетка одновременно со связыванием антигена вступила во взаимодействие со специфической хелперной Т-клеткой или чтобы последняя синтезировала растворимые факторы роста и дифференцировки. В противном случае, когда связывание антигена не сопровождается поступлением сигналов от растворимых факторов роста или от хелперных Т-клеток, может произойти инактивация В-лимфоцита, т.е. может развиться состояние иммунологической толерантности.
Иммунологическая толерантность представляет собой явление, обратное иммунному ответу. Она является, в частности, основой для понимания того, почему иммунная система в норме не развивает иммунный ответ против антигенов собственного организма (аутоантигенов): иммунная система находится в состоянии толерантности по отношению к антигенам клеток и тканей данного организма («своих» антигенов). Вместе с тем малые количества антител против многих аутоантигенов обнаруживаются в крови практически у всех людей. Последнее дает основание предполагать, что клетки, способные вырабатывать аутоантитела, в организме все же существуют, но их или очень мало, или их активность супрессирована.
Аутоиммунными заболеваниями называют такие состояния, при которых в организме появляются антитела или сенсибилизированные лимфоциты против нормальных антигенов собственного организма. Одна из первых гипотез аутоиммунизации была основана на том, что нормальная иммунная система реагирует на измененные антигены собственного организма. Причиной изменения тканевых антигенов могут быть химические, в том числе лекарственные, воздействия, влияние физических (например, радиационных или термических) факторов, а также микробные или вирусные агенты. В этих случаях предполагается следующее: возникновение измененного тканевого антигена приводит к реакции иммунной системы на этот аутоантиген и выработке аутоантител или появлению сенсибилизированных лимфоцитов, которые оказывают деструктивное влияние последних на те или иные ткани. Эта гипотеза, несмотря на ее логичность и простоту, не могла объяснить два момента. Во-первых, каким образом антитела против модифицированного антигена могут повреждать нормальные ткани? Антитела ведь строго специфичны и следовало бы ожидать, что они должны взаимодействовать только с модифицированным антигеном, вступать с ним в связь и играть не деструктивную, а защитную роль. Во-вторых, выполнив защитную роль и обеспечив таким образом элиминацию из организма модифицированного антигена, иммунный ответ должен привести к быстрому самоизлечению организма от аутоиммунного заболевания. В действительности эти заболевания имеют длительный само поддерживающий характер.
В соответствии с гипотезой запрещенных клонов предполагается следующее: возникновение генетически измененных лимфоидных клеток, способных реагировать на нормальные антигены организма, приводит к накоплению запрещенного клона клеток и иммунной реакции этого клона против тех или иных тканевых антигенов с появлением аутоантител или сенсибилизированных лимфоцитов, оказывающих деструктивное влияние на соответствующие ткани. Концепция запрещенных клонов произвела аутоиммунные расстройства в ранг болезней иммунной системы. Таким образом, впервые был поставлен вопрос о том, что для эффективной борьбы с аутоиммунными заболеваниями необходимо искать способы лечения не пораженных аутоантителами тканей, а иммунной системы в целом. В последние годы идея о запрещенных клонах обогатилась фактами, установившими возможность поликлональной активации В-клеток. Было показано, что ряд веществ может вызвать пролиферацию и дифференцировку всех В-клонов отдельных клеточных популяций. Предполагается, что процесс такого типа может привести к активации и аутоагрессивного клона. Эта гипотеза хорошо объясняет провоцирующую роль инфекционных и других экзогенных воздействий при наследственной предрасположенности к аутоиммунным расстройствам.
Одна из последних гипотез, объясняющих механизмы аутоиммунизации, возникла после открытия Т-супрессоров. Речь идет об иммунодефиците по Т-супрессорам, которые подавляют функцию В-лимфоцитов. При дефиците Т-супрессоров В-клетки начинают реагировать на тканевые аутоантигены, вырабатывают аутоантитела, которые и обеспечивают развитие аутоиммунного заболевания.
Активация В-лимфоцита состоит из двух фаз — пролиферации и дифференцировки. В результате пролиферации увеличивается число В-клеток, способных реагировать с введенным в организм чужеродным антигеном. Процесс пролиферации необходим, поскольку в спокойном состоянии в организме специфичных для одного антигена В-лимфоцитов мало. В результате пролиферации увеличивается число клеток, способных немедленно дифференцироваться в антителообразующие лимфоциты, а также накапливаются В-лимфоциты памяти, способные активироваться при повторной иммунизации.
Обладающие различными функциями Т-лимфоциты продуцируют много различных растворимых медиаторов, известных под названием цитокины. К ним можно отнести интерлейкины, интерфероны, факторы роста и дифференцировки Т- и В-клеток, хемотаксические и цитотоксические факторы — лимфотоксин и фактор, некротизирующий опухоль. Клетки различных подклассов обладают различными эффекторными функциями. Цитолитические Т-лимфоциты способны разрушить тканевый трансплантат, инфицированные вирусом и внутриклеточными паразитами собственные клетки организма; кроме того, они могут разрушать и опухолевые клетки. Регуляторные функции Т-клеток проявляются в активации иммунной реакции (Т-хелперы) и в ее подавлении (Т-супрессоры).
Проблема HLA человека в клиническом отношении первоначально разрабатывалась исключительно в рамках трансплантологии. Дальнейшие исследования показали, что гены, кодирующие антигены гистосовместимости, являются многофункциональными; клиническое значение их не ограничивается рамками трансплантологии, а связано также с предрасположенностью к определенным заболеваниям.
Взаимодействие иммунной, нервной и эндокринной систем. В последние годы значительное развитие получило направление исследований, связанное с изучением взаимодействия и взаимообусловленности функционирования иммунной, нервной и эндокринной систем. До недавнего времени считалось, что основная роль в реализации взаимодействия между нейроэндокринной и иммунной системами принадлежит катехоламинам, ацетилхолину и глюкокортикоидным гормонам. В дальнейшем появилось достаточное количество экспериментальных данных о модулирующем влиянии на иммунный ответ таких пептидных гормонов, как АКТГ, соматотропин, аргинин-вазопрессин, окситоцин, тиреотропин, вещество P, вазоактивный интестинальный пептид и др. Доказано, что в иммунорегуляции принимают участие эндорфины и энкефалины.
Установлено, что функция иммунной системы регулируется такими мозговыми структурами, как гипоталамус, гипофиз, миндалина, вентральное поле покрышки и др., а также нейрохимическими системами мозга — дофаминергической, серотонинергической и др. На основе соответствующих данных возникло предположение о существовании иммунных расстройств, обусловленных нарушением нервной регуляции [Крыжановский Г.Н., Магаева С.М., 1998].
Ключевым звеном аппарата регуляции является гипоталамус. Он связан со всеми звеньями аппарата и дает начало сложному эфферентному пути передачи центральных нейрорегуляторных влияний на иммунокомпетентные клетки, которые обладают соответствующими рецепторами к нейро-трансмиттерам, нейропептидам, а также к гормонам эндокринных желез [Говырин Н.В., Ложкина А.Н., 1991; Шхинек Э.К., 1993].
Выявлены конкретные медиаторы, с помощью которых реализуется взаимосвязь между иммунокомпетентными и нервными клетками. Как уже упоминалось, большое значение имело открытие в мозге эндогенных морфиноподобных соединений и рецепторов к ним. Речь идет о группе нейропептидов — опиоидных пептидов.
Принципиально важными явились также работы по изучению нейротропной активности медиаторов иммунитета. Показано, что такие медиаторы, как интерлейкин 1 (ИЛ-1), интерлейкин 2 (ИЛ-2), интерферон (ИФ), тимозин, фактор некроза опухоли (ФНО) обладают способностью регулировать функции ЦНС.
Пептидные лиганды, осуществляющие нейроиммунное взаимодействие, имеют общие для обеих систем рецепторы. Так, иммунокомпетентные клетки могут синтезировать нейропептиды и отвечать на большинство, если не на все, соединения этой группы. Клетки нейроэндокринной системы продуцируют некоторые лимфокины и монокины и отвечают на них. Структурная родственность рецепторов показана, например, для АКТГ, эндорфинов, ИЛ-1 и ИЛ-2.
Итак, можно сказать, что эти системы имеют и используют одинаковый набор сигнальных молекул в виде физиологически активных субстанций, таких как лимфокины и монокины для внутрисистемной и межсистемной связи. Кроме того, они обладают одинаковым спектром рецепторов для общих лигандов.