Что такое средняя соль
Как классифицировать соли
Содержание статьи
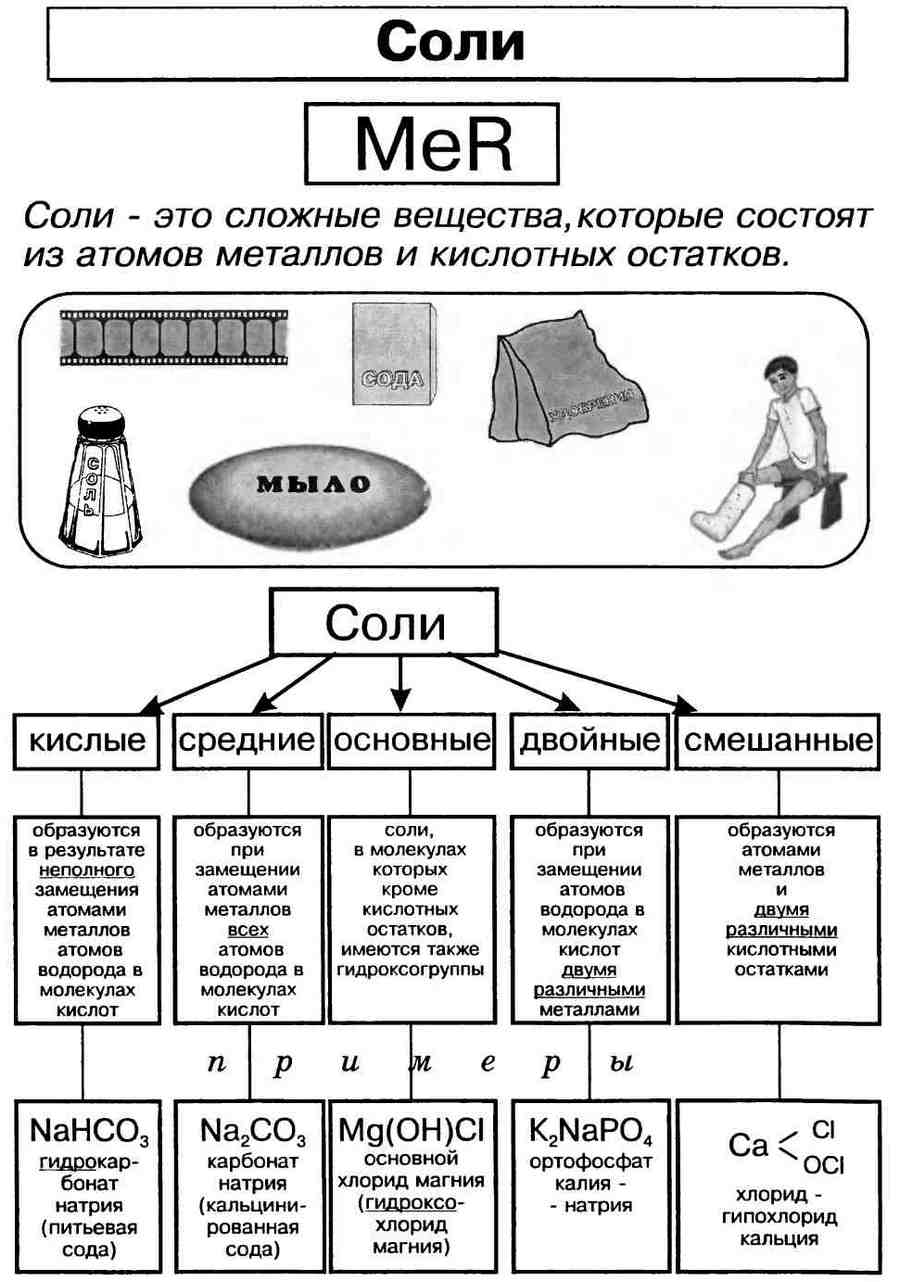
Соли – это химические соединения, в которых атом металла связан с кислотным остатком. Отличие солей от других соединение состоит в том, что у них явно выражен ионный характер связи. Поэтому связь так и называют – ионной. Ионная связь характеризуется ненасыщенностью и ненаправленностью. Примеры солей: хлорид натрия или кухонная соль – NaCl, сульфат кальция или гипс – СаSO4. В зависимости от того, насколько полно заменяются атомы водорода в кислоте или гидроксо-группы в гидроксиде различают средние, кислые и основные соли. В состав соли может входить несколько катионов металла – это двойные соли.
Средние соли
Средние соли – это соли, в которых происходит полное замещение атомов водорода ионами металла. Кухонная соль и гипс – примеры таких солей. Средние соли охватывают большое количество соединений, часто встречающихся в природе, например, цинковая обманка – ZnS, пиррит – FeS2 и т.д. Этот вид солей самый распространенный.
Средние соли получают реакцией нейтрализации, когда кислота и основание взяты в эквимолярных соотношениях, например:
H2SO3 + 2 NaOH = Na2SO3 + 2 H2O
Получается средняя соль сульфит натрия. Если взять 1 моль гидроксида натрия, то реакция пойдет следующим образом:
H2SO3 + NaOH = NaHSO3 + H2O
Получается кислая соль гидросульфит натрия.
Кислые соли
Кислые соли – соли, в которых не все атомы водорода замещены металлом. Такие соли способны образовывать только многоосновные кислоты – серная, фосфорная, сернистая и прочие. Одноосновные кислоты, такие как соляная, азотная и другие, кислых солей не дают.
Примеры кислых солей: гидрокарбонат натрия или пищевая сода – NaHCO3, дигидрофосфат натрия – NaH2PO4.
Кислые соли можно также получить взаимодействием средних солей с кислотой:
Na2SO3+ H2SO3 = 2NaHSO3
Основные соли
Двойные соли
Двойные соли – соли, в которых два металла замещают атомы водорода в кислотном остатке. Такие соли возможны для полиосновных кислот. Примеры солей: карбонат натрия калия – NaKCO3, сульфат алюминия калия – KAl(SO4)2.. Самыми распространенными в быту двойными солями являются квасцы, например, алюмокалиевые квасцы – KAl(SO4)2 12Н2О. Их применят для очистки воды, дубления кожи, для разрыхления теста.
Смешанные соли
Что такое средняя соль
Соли – это класс химических соединений, состоящие из ионов металлов и ионов кислотных остатков.
В начале XIX века шведский химик Й. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.

Средние, или нормальные, соли – это продукты полного замещения атомов водорода в кислоте на металл. Например: Na2SO4, K3PO4,CaCO3 и т.д.
Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл. Например: Ca(HCO3)2, Mg(HSO4)2 и т.д.
Оснoвные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например: (СuOH)2CO3, AlOHCl2 и т.д.
Нормальные, кислые и основные соли являются наиболее важными типами солей. Кратко рассмотрим другие типы солей.
Смешанными солями называют такие соли, молекулы которых состоят из катионов одного металла и анионов двух различных кислотных остатков. Например: PbFCl – фторид-хлорид свинца, Ca(ClO)Cl – хлорид-гипохлорит кальция.
Двойными солями называются такие соли, в состав молекул которых входят катионы двух различных металлов (или катион металла и катион аммония) и анионы одного кислотного остатка.
Двойные соли являются продуктами совмествной кристаллизации двух разных нормальных солей, образованных одной и той же кислотой; например, сульфата калия K2SO4 и сульфата алюминия Al2(SO4)3. Поэтому их формулы записывают так:
Большинство солей — твердые вещества белого цвета: KCl, NaCl, KNO3, BaSO4 и т.д.
Некоторые соли имеют окраску. Например, дихромат калия K2Cr2O7 – оранжевого, хромат калия K2CrO4 – желтого, сульфат никеля (II) NiSO4 – зеленого, хлорид кобальта (III) CoCl3 – розового, сульфид меди (II) CuS – черного цвета.
По растворимости в воде соли делятся на растворимые (р), малорастворимые (м) и нерастворимые (н).
Растворимость в воде важнейших солей указана в данной таблице.
Химические свойства солей
а) средние соли диссоциируют на катионы металлов и анионы кислотных остатков:
б) кислые соли диссоциируют на катионы металла и сложные анионы:
в) основные соли диссоциируют на сложные катионы и анионы кислотных остатков:
Металл + соль = новый металл + новая соль
Раствор соли + раствор щелочи = новая соль + новое основание
Соль + кислота = новая соль + новая кислота
При взаимодействии соли с кислотой, образующей данную соль, получается кислая соль (это возможно в том случае, если соль образована многоосновной кислотой). Например:
Соль 1 + соль 2 = соль 3 + соль 4
Основная соль + кислота = средняя соль + вода
Кислая соль + щелочь = средняя соль + вода
Получение солей
NaOH + HCl = NaCl + H2O
Водород выделяется при взаимодействии металлов со всеми кислотами, кроме азотной кислоты и концентрированной серной кислоты.
Кроме этих общих способов получения солей возможны и некоторые частные способы:
С водными растворами щелочей реакция идет по уравнению:
Соль + кислотный оксид = соль + кислотный оксид
Cl2 + 2KOH = KCl + KClO + H2O (на холоде)
3Сl2 + 6KOH = 5KCl + KClO3 + 2H2O (при нагревании)
Соль + галоген 1 = новая соль + галоген 2(при условии, что галоген 1 более активный, чем галоген 2).

Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Что такое средняя соль
ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ
И ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка. Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
При обычных условиях все соли – твёрдые вещества. Многие соли не имеют цвета, но некоторые ионы придают солям характерную окраску:
Растворимость солей различна. Практически все нитраты, соли натрия, калия, рубидия, цезия и аммония NH4 + растворимы. Среди сульфидов и фосфатов растворимы только фосфаты и сульфиды щелочных металлов.
ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ
В этом примере ионы меди Cu 2+ являются окислителем, а цинк – восстановителем.
Активность металла определяется его положением в электрохимическом ряду напряжений металлов:
Li, Cs, К, Ва, Са, Na, Mg, Al, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Ag, Pt, Au.
Щелочные (Li, Na, K, Rb, Cs) и щёлочноземельные металлы (Ca, Sr, Ва) реагируют с растворами солей иначе. Сначала щелочной или щёлочноземельный металл реагирует с водой раствора соли:
2Na + 2H2O = 2NaOH + H2↑
Образовавшаяся щёлочь реагирует с раствором соли:
Так как в ходе первой реакции выделяется достаточное количество тепла, гидроксид меди (II) разлагается (свойство нерастворимых гидроксидов):
Cu(OH)2 = CuO + H2O
Поэтому вместо меди в такой реакции образуется смесь её оксида и гидроксида.
Разложение нитратов при нагревании рассмотрено в конспекте «Нитраты».
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
MgO + H2SO4 = MgSO4 + H2O
MgO + SO3 = MgSO4
а) по реакции замещения:
б) по реакции обмена (см. взаимодействие солей друг с другом):
MgI2 + HgSO4 = MgSO4 + HgI2↓
ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
2NaOH + H3РO4 = Na2HPO4 + 2H2O
(в результате неполной нейтрализации образовался гидрофосфат натрия);
NaOH + H3РO4 = NaH2PO4 + H2O
(в результате неполной нейтрализации образуется дигидрофосфат натрия).
4NaOH + Р2O5 = 2Na2HPO4 + H2O
(в результате неполной нейтрализации образовался дигидрофосфат натрия);
2NaOH + Р2O5 + H2O = 2NaH2PO4
(в результате неполной нейтрализации образовался гидрофосфат натрия).
Na2SO4 + H2SO4 = 2NaHSO4
NaCl (тв.) + H2SO4 (конц.) = NaHSO4 + HCl↑
СаСO3 + СO2 + H2O = Са(НСО3)2
(в данном примере взвесь СаСO3 постепенно исчезает, так как образуется хорошо растворимый гидрокарбонат кальция).
Кислые соли, как правило, растворимы лучше соответствующих им средних. Так, например, гидрокарбонат кальция Са(НСО3)2 растворим в воде, в то время как карбонат кальция практически нерастворим.
Образец выполнения задания ОГЭ
Задание. И сульфат меди (II), и нитрат серебра взаимодействуют
Решение. Хлорид калия, сульфат меди (II), нитрат серебра – соли. Растворимые соли взаимодействуют друг с другом, если в результате реакции один из продуктов реакции выпадает в осадок (т. е. образуется малорастворимое в воде вещество). В случае взаимодействия нитрата серебра с хлоридом калия действительно образуется осадок (белый творожистый осадок хлорида серебра):
Но сульфат меди (II) с хлоридом калия не взаимодействует, в данном случае связывания ионов в растворе не происходит. Таким образом, вариант 1 не подходит.
Соляная кислота – сильный электролит. Сильные кислоты взаимодействуют с солями слабых кислот, вытесняя их из солей. Но сульфат меди (II) – соль сильной серной кислоты, а нитрат серебра – соль сильной азотной кислоты. Серная кислота может вытеснить азотную и соляную кислоты из кристаллических солей (не в растворах), так как HNO3 и НCl – летучие кислоты, а серная – нелетучая. Соляная кислота вытеснить серную или азотную не может. Поэтому вариант 2 не подходит.
С оксидами соли взаимодействуют в редких случаях. Например, карбонаты при сплавлении взаимодействуют с оксидом кремния (IV). Средние соли при взаимодействии в растворе с кислотными оксидами соответствующих кислот превращаются в кислые соли (если такие для данных кислот существуют). В данном примере оксид магния не взаимодействует ни с сульфатом меди (II), ни с нитратом серебра. Ответ 3 не подходит.
Обе соли взаимодействуют с железом. Железо находится в электрохимическом ряду напряжений металлов до меди и до серебра:
Правильный ответ – 4 (с железом).
Конспект урока по химии в 8 классе «Соли: классификация, свойства, получение». Выберите дальнейшее действие:
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Ca + S → CaS
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Смешанные соли диссоциируют также одноступенчато.
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Некоторые кислые соли могут реагировать со своими средними солями.
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся: