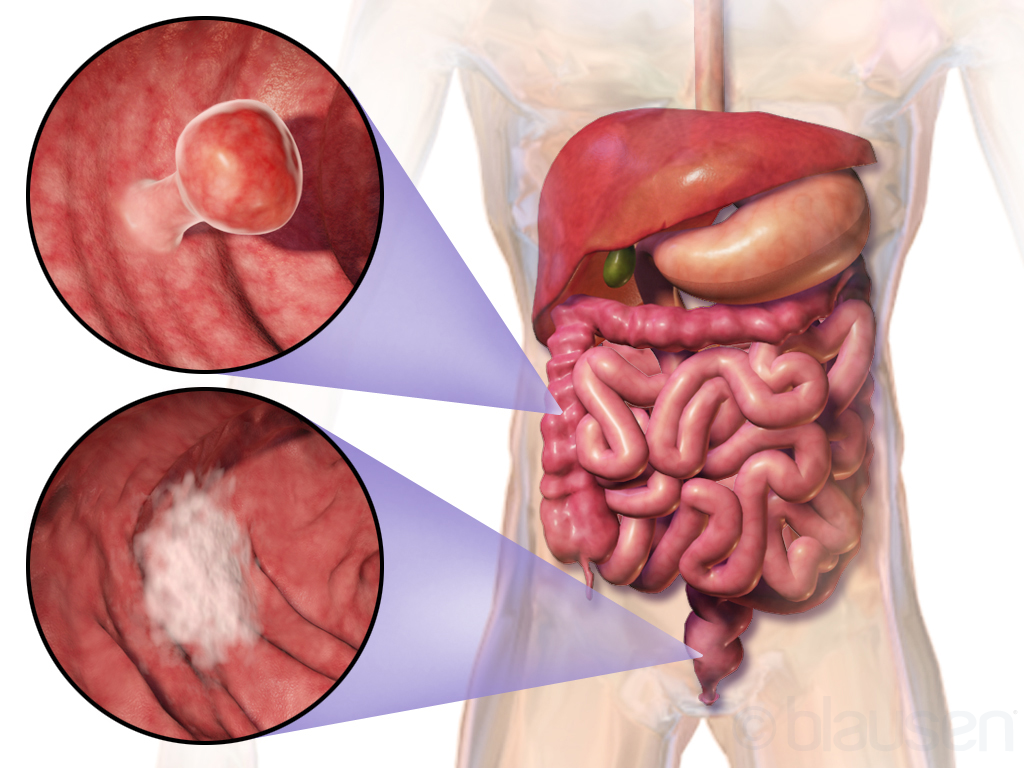
Что такое стенозирующая опухоль
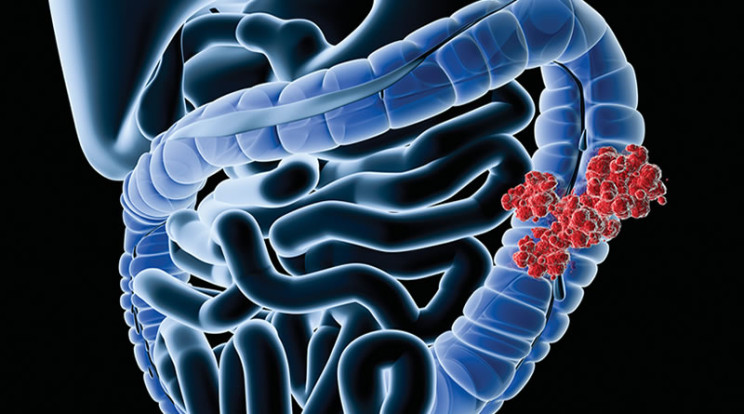
Рак сигмовидной кишки
Рак сигмовидной кишки — это онкологическое поражение эпителиальных клеток S-образного элемента ободочной кишки. Первой причиной заболевания, как правило, является нарушение питания и неправильный образ жизни. Из-за скрытого характера в большинстве случаев обнаружить онкологию удается поздно, когда симптомы мешают полноценной жизни. Своевременная диагностика помогает выявить болезнь до критической стадии и провести лечение рака сигмовидной кишки с полным восстановлением пациента.
Волнянкина Татьяна Владимировна
Ведущий пластический хирург высшей квалификации, член ОПРЭХ, ОСЭМ
Самарцев Виктор Иванович
Ведущий пластический хирург, врач высшей квалификации, член ОПРЭХ
Варванович Маргарита Сергеевна
Челюстно-лицевой хирург, пластический хирург
Широкопояс Александр Сергеевич
Врач-эндоскопист первой категории, гастроэнтеролог, колопроктолог, хирург первой категории, терапевт, кандидат медицинских наук
Ракинцев Владислав Сергеевич
Северцев Алексей Николаевич
Чудаев Дмитрий Борисович
Онколог, врач-хирург, ведущий хирург
Причины развития рака и его осложнения
Сигмовидная кишка расположена на конечном этапе желудочно-кишечного тракта, где переработанная пища формируются в твердые каловые массы. Слабая перистальтика кишечника часто приводит к запорам, деформации его стенок и последующей интоксикации организма. Под влиянием токсических продуктов распада воспаление тканей способно переходить в серьезные патологии строения органов.
Аномальный рост клеток и рак сигмовидного отдела толстой кишки, могут вызвать несколько факторов:
Рак сигмовидной ободочной кишки имеет разную этиологию развития. Повлиять на изменения в клетках может как серьезная патология, так и небольшие, но регулярные нарушения в обмене веществ. Даже при наследственной склонности к проблемам с органами ЖКТ, решающее влияние оказывает образ жизни пациента.
Отсутствие лечения опухоли рака со временем приводит к кишечной непроходимости, внутреннему кровотечению, перфорации органов. В результате воспалительной реакции организма и обширной интоксикации пациенту грозит анемия и шок.
Основные симптомы, показания к лечению
По симптоматике опухоль сигмовидной кишки сложно определить на начальном этапе. Обратиться к врачу следует при появлении явных признаков недомогания:
Для достоверной диагностики, а также определения схемы лечения используют колоноскопию, анализ кала, крови, биопсию для гистологического анализа. В качестве дополнительных способов исследования клинической картины рака применяют томографию брюшной полости, УЗИ.
Виды рака кишки
При диагностике рака основной признак классификации опухоли — это доброкачественность. Исходя из категории патологии, врач определяет прогнозы для больного, варианты лечения, возможные осложнения.
Злокачественная опухоль сигмовидной кишки, охватывающая толстую кишку, определяется как колоректальный рак. Он способен поражать значительную часть ЖКТ и опасен склонностью к распространению метастаз по лимфатической и кровеносной системе.
Методы лечения рака
Схема лечения полностью зависит от стадии рака, гистологической природы и наличия осложнений. В обязательную программу входит удаление опухоли и облучение для предотвращения метастазирования.
В онкологии используют следующие методы воздействия на опухоль:
После удаления поврежденной части для восстановления функции кишечника накладывают анастамоз. Если сложность лечения не позволяет его сформировать, устанавливается колостома – временный искусственный канал.
Эндоскопическим методом чаще лечат рак сигмовидной кишки 2 стадии без метастаз. Опухоль охватывает не более 0,5 части поперечника сигмы и неглубоко проникает в стенку слизистой. В остальных случаях используется лапароскопия или резекция.
Запишитесь на прием по телефону
+7 (495) 021-12-26 или заполнив форму online
Администратор свяжется с Вами для подтверждения записи.
Конфиденциальность Вашего обращения гарантирована.
Восстановление и профилактика
Сразу после операции питание в течение первой недели осуществляется внутривенно. Послеоперационный период сопровождается медикаментозной терапией, направленной на укрепление организма, защиту иммунной системы от внешних бактерий. Пациенту назначают антибактериальные и противовоспалительные средства, анестетики, витаминно-минеральные комплексы.
Питание после выписки ограничивается диетой, основанной на следующих правилах:
Эффективное лечение опухоли сигмовидной кишки позволит сохранить полноценную жизнь на будущие несколько лет. Для профилактики рецидива рака необходимо следить за пищеварением, при запорах использовать слабительные средства. Активный образ жизни и сбалансированное питание помогут восстановить регулярный обмен, нормализовать режим ЖКТ. Для контроля состояния раз в год проводится исследование кала на скрытую кровь, а колоноскопия каждые 5 лет. При появлении проблем с кишечником важно своевременно пройти обследование у гастроэнтеролога и проктолога.
В нашем медцентре проводиться устранение любых проявлений данного заболевания. Вы можете пройти консультацию в «Клинике ABC». Для записи вам необходимо воспользоваться телефоном или формой обратной связи на сайте. Администратор подберет наиболее удобное для вас время визита.
Приводим сравнительную таблицу цен на данную процедуру клиник г. Москвы*.
*В соответствии с Федеральным законом о рекламе, мы не указываем название клиник.
Рак ободочной кишки
Рак ободочной кишки является наиболее часто встречаемой патологией в онкологической практике и занимает третью позицию среди всех злокачественных раковых образований органов системы пищеварения. Как правило, заболевание поражает различные слои населения, преимущественно в возрастной категории старше 55-ти лет, независимо от половой принадлежности.
Ведущую роль в образовании атипичных клеток играют предраковые патологические процессы в органах системы пищеварения, а также употребляемая пища с низким содержанием клетчатки. К предраковым состояниям относятся полипы (полипоз), хронический неспецифический язвенный колит, дивертикулярная болезнь и болезнь Крона.
Что представляет собой рак ободочной кишки?
В большинстве случаев злокачественное новообразование образуется в результате трансформации полипов, возникших в толстой кишке. Таким образом, своевременное удаление полипов снижает вероятность развития онкологического заболевания и является хирургической профилактикой рака.
Опухоль ободочной кишки формируется в одном из ее отделов:
Несмотря на возможность формирования рака в любом из отделов ободочной кишки, частота поражения в каждом из участков значительно отличается. Так, в 50% случаев опухоль поражает сигмовидную кишку, более 20% приходится на слепую, 10% на поперечную ободочную и около 15% на участки физиологических изгибов кишки. И только в 2% случаях рак первоначально поражает несколько отделов ободочной кишки.
О заболевании
Распространение опухолевых клеток по организму происходит несколькими путями:
Гематогенные метастазы локализуются преимущественно в печени, иногда в легких.
Классификация рака ободочной кишки
Различают несколько клинических проявлений опухолевого процесса и их признаки:
Симптомы рака ободочной кишки
Первые симптомы патологического процесса практически отсутствуют, но при этом отмечается незначительное ухудшение общего самочувствия, снижение активности и аппетита. На ранних этапах развития болезни человек начинает прибавлять в весе.
Симптомы рака ободочной кишки полностью зависят от места расположения опухоли, размеров, степени распространения, наличия других заболеваний ЖКТ и возникающих осложнений.
Клинический комплекс проявляется ощущением болезненности и дискомфорта, запорами либо поносами, кровяными и слизистыми выделениями при опорожнении кишечника, ухудшением самочувствия.
Более подробная характеристика проявляющихся симптомов:
Фото рака ободочной кишки
Диагностика ракового заболевания ободочной кишки
Диагностика рака ободочной кишки состоит из комплекса мероприятий:
Методы лечения рака ободочной кишки
Основным методом лечения рака ободочной кишки является хирургический, иногда с проведением в послеоперационном периоде химиотерапии.
Метод оперативного лечения определяется после проведения соответствующих диагностических мероприятий для выявления степени распространения опухолевого процесса:
После проведения операции в течение первых 24 часов запрещается употреблять пищу, в это время проводится противошоковая терапия, а также мероприятия для устранения интоксикации и обезвоживания организма.
Начиная со второго дня больному разрешается принимать жидкую, полумягкую пищу и употреблять теплое питье. Со временем в дневной рацион включают такие блюда, как нежирные бульоны, протертые каши, пюре из овощей, омлет на пару, чаи на травяных отварах, различные соки и компоты из свежих либо замороженных фруктов и ягод.
Возможные последствия
Рак ободочной кишки — это серьезное заболевание, которое требует оперативного вмешательства. При отсутствии лечения на ранних стадиях существует риск развития осложнений:
Прогноз выживаемости
Прогноз при опухолях ободочной кишки во многом зависит от стадии патологического процесса, распространения атипических клеток на близлежащие органы, ткани и лимфатические узлы, а также от гистологической структуры злокачественного новообразования.
Лечебные мероприятия после операции
Лечение опухолевого процесса после операции продолжается с помощью химиотерапии.
Применение химиотерапии
Основными препаратами являются фторафур и 5-фторурацил. Большинство пациентов переносят лечение хорошо, реже возникают побочные эффект в виде тошноты, аллергических высыпаниях, рвоте и изменений анализа крови.
Онкология сигмовидной кишки
Рак сигмовидной кишки часто в течение продолжительного времени не проявляется клиническими симптомами. По этой причине зачастую диагноз устанавливают на поздней стадии опухолевого процесса. Врачи Юсуповской больницы рекомендуют даже при незначительных проявлениях кишечного дискомфорта незамедлительно обращаться за помощью.
В Юсуповской больнице онкологи применяют новейшие методы диагностики заболеваний сигмовидной кишки. Обследование пациентов проводят с помощью новейшей аппаратуры ведущих мировых производителей. Лаборанты выполняют исследование крови, кала и других биологических материалов, используя качественные реагенты, что позволяет получить точные результаты анализов.
Хирурги клиники онкологии виртуозно выполняют традиционные и инновационные оперативные вмешательства. Химиотерапевты назначают пациентам эффективнейшие противоопухолевые препараты, которые оказывают минимальное побочное действие. Радиологи проводят лучевую терапию современными аппаратами, позволяющими прицельно воздействовать на патологический очаг, не повреждая окружающие опухоль ткани.
Причины опухолей
Рак сигмовидной кишки происходит из клеток железистого эпителия. Составляет 34% от общего количества случаев колоректального рака. В 60% случаев злокачественную опухоль выявляют у пациентов в возрасте 40-60 лет. Мужчины страдают в 1,5 раза чаще женщин.
Высокая вероятность развития рака сигмовидной кишки обусловлена особенностями органа. Сигмовидная кишка располагается в левой части живота, над прямой кишкой. Она имеет S-образную форму. Если замедляется продвижение содержимого по кишечнику, оно продолжительное время остается в сигмовидной кишке. Это увеличивает время контакта токсических продуктов переработки пищи со слизистой органа.
Рак сигмовидной кишки может развиться под воздействием следующих неблагоприятных факторов:
Несбалансированного питания – употребление в пищу большого количества жирной и мясной пищи, недостаточного потребления фруктов и овощей, продуктов, богатых клетчаткой;
Отягощённой наследственности – риск развития злокачественного новообразования увеличивается, если близкие родственники болели раком сигмовидной кишки;
Хронических воспалительных процессов в кишечнике – неспецифического язвенного колита, дивертикулеза, болезни Крона;
Малоподвижного образа жизни, вследствие чего замедляется эвакуация содержимого кишечника;
Возрастной атонии кишечника.
К развитию рака сигмовидной кишки приводит курение, злоупотребление спиртными напитками, употребление продуктов, содержащих канцерогенные пищевые добавки.
Классификация
С учётом особенностей роста опухоли онкологи выделяют два типа рака сигмовидной кишки: экзофитный и эндофитный. Экзофитные опухоли растут в просвет кишечника. Они представляют собой выступающие узлы на толстой ножке. При прогрессировании патологического процесса рак сигмовидной кишки часто изъязвляется. Возникает кровотечение и инфицирование.
Эндофитный рак сигмовидной кишки растёт преимущественно вглубь кишечника. Опухоль распространяется по кишечной стенке и может циркулярно охватывать кишку. В её центре возникают участки изъязвления. Вследствие циркулярного роста рака сигмовидной кишки происходит сужение просвета кишечника, затрудняется движение каловых масс. Этот тип роста наиболее характерен для рака сигмовидной кишки.
Гистологи различают три вида рака сигмовидной кишки:
Рак ректо-сигмоидного отдела толстой кишки представлен двумя формами: скирром и аденокарциномой.
Стадии
Онкологи различают 4 стадии рака сигмовидной кишки:
При первой стадии опухоли размер новообразования не превышает двух сантиметров. Опухоль располагается в пределах подслизистого слоя или слизистой оболочки. Регионарные лимфатические узлы не поражены атипичными клетками.
Опухоль в случае второй А стадии рака занимает размер менее половины окружности кишки, не прорастает стенку. Метастазы в лимфатических узлах и внутренних органах отсутствуют. Раковая опухоль при 2В стадии располагается в стенке кишечника, но не выходит за его пределы. Онкологи выявляют метастазы в лимфатических узлах. Отдалённые метастазы отсутствуют.
При 3А стадии рака сигмовидной кишки размер опухоли превышает половину длины окружности кишки. Атипичные клетки в регионарных лимфатических узлах отсутствуют. При 3В стадии опухоли метастазами поражаются регионарные лимфатические узлы.
Опухоль при 4 стадии рака перекрывает просвет сигмовидной кишки. Выявляются гематогенные метастазы в других органах. При 4 стадии рака сигмовидной кишки поражаются близлежащие органы, образуются кишечно-пузырные свищи и конгломераты.
Симптомы
Вначале рак сигмовидной кишки нередко протекает бессимптомно либо малосимптомно, что усложняет своевременную диагностику. При прогрессировании опухоль распространяется на близлежащие органы, дает регионарные и гематогенные метастазы (в печень, легкие, позвоночник, реже – в другие органы).
В нижнем отделе кишечника – сигмовидной кишке – окончательно формируются каловые массы, всасывается вода и питательные вещества. При неправильном питании каловые массы задерживаются в этом сегменте толстого кишечника. Скопившийся кал давит на стенки кишки, в результате чего нарушается кровообращение, через стенки сигмовидной кишки в организм поступают токсические вещества. Постоянные запоры отрицательно воздействуют на весь организм. В результате застоя кишечного содержимого развиваются предраковые заболевания, злокачественные опухоли сигмовидной кишки.
Довольно долго опухоль сигмовидной кишки не проявляется клиническими симптомами, что усложняет своевременную диагностику. Первый симптом рака сигмовидной кишки – кишечный дискомфорт. Вначале он возникает периодически, а с ростом новообразования приобретает выраженный характер. Более поздние стадии рака сигмовидной кишки проявляются следующими симптомами:
Метеоризмом, отрыжкой, тошнотой, запором или поносом, болью;
Появлением прожилок слизи и крови в кале;
Интенсивными, тупыми или схваткообразными болями, не зависящими от приёма пищи;
Развитием кишечной непроходимости;
У пациентов поносы чередуются с запорами. Нередко в левой половине живота врачам удаётся прощупать опухолевидное образование. Иногда первым проявлением опухолевого процесса становится развитие кишечной непроходимости. При прогрессировании опухоль распространяется на близлежащие органы, дает регионарные и гематогенные метастазы (в печень, легкие, позвоночник, реже – в другие органы).
У больных раком сигмовидной кишки врачи выявляют следующие симптомы:
При развитии кишечной непроходимости возникают приступообразные схваткообразные боли, которые повторяются через каждые 10-15 минут, отмечается вздутие живота, задержка газов и стула. Возможна рвота. В случае разрушения стенки кишки развивается перитонит. Рак сигмовидной кишки 4 степени с метастазами в печени проявляется кахексией (раковым истощением), анемией (малокровием), желтухой и увеличением печени. При появлении гематогенных метастазов присоединяются симптомы, которые свидетельствуют о нарушении функций поражённых органов.
Диагностика
Диагноз опухоли сигмовидной кишки онкологи Юсуповской больницы устанавливают с учетом анамнеза, жалоб, данных объективного осмотра и результатов дополнительных исследований. Наиболее информативными при раке сигмовидной кишки являются эндоскопические методы (ректороманоскопия и колоноскопия). Они позволяют визуально оценить объём и локализацию новообразования, взять материал для последующего гистологического исследования.
В процессе обследования пациентов с подозрением на рак сигмовидной кишки врачи Юсуповской больницы используют ирригоскопию (рентгеновское исследование с применением бариевой взвеси) и анализ кала на скрытую кровь. Чтобы детализировать стадию опухолевого процесса проводят магнитно-резонансную и компьютерную томографию. Все инструментальные методы исследования выполняются с помощью новейшей аппаратуры ведущих фирм-производителей США, Японии и европейских стран.
Для выявления метастазов применяют другие диагностические методики:
Онкологи Юсуповской больницы выставляют окончательный диагноз на основании результатов гистологического исследования. Проводят дифференциальную диагностику злокачественных новообразований сигмовидной кишки с предраковыми и воспалительными болезнями кишечника, неподвижными опухолями забрюшинного пространства и подвижными новообразованиями брыжейки.
Комплексная терапия
Онкологи Юсуповской больницы проводят комбинированное лечение злокачественных опухолей сигмовидной кишки. Оно включает оперативное вмешательство, радиотерапию и химиотерапию. Ведущая роль отводится хирургическому лечению, которое направленно на радикальное удаление опухоли. Объём оперативного вмешательства зависит от распространённости рака сигмовидной кишки. На ранних стадиях заболевания в отдельных случаях применяют эндоскопические методики. Для этого применяется резекция сигмовидной кишки.
При распространённых опухолевых процессах хирурги выполняют резекцию сигмовидной кишки с участком брыжейки и близлежащими лимфатическими узлами. Поражённый участок сигмовидной кишки удаляют с пятью сантиметрами неизменённого отдела кишечника, расположенного выше и ниже опухоли. Хирургическое вмешательство при раке сигмовидной кишки бывает одноэтапным или двухэтапным. При проведении одноэтапных операций после удаления опухоли хирург восстанавливая непрерывность кишечника путём накладывания анастомоза. В запущенных случаях кишку резецируют и формируют колостому. Целостность кишечника восстанавливают через несколько месяцев с момента первой операции.
Оперативное вмешательство может быть типичным, комбинированным, расширенным или сочетанным. Типичная операция представляет собой резекцию участка кишечника с опухолью. Комбинированный метод лечения применяют в случае необходимости провести операцию на поражённом раком сегменте кишечника и других органах, в которые проросла опухоль. Расширенную операцию проводят при разрастании опухоли или наличии синхронных новообразований. Сочетанная операция подразумевает удаление пораженного сегмента кишечника вместе с другими органами из-за сопутствующих заболеваний.
При наличии метастазов рака врачи клиники онкологии проводят химиотерапию. Лечение противоопухолевыми препаратами при раке сигмовидной кишки после операции применяют с осторожностью – в некоторых случаях она может вызвать отрицательные результаты. Чаще всего применение химиотерапии целесообразно при неоперабельных опухолях – она помогает уменьшить размер новообразования. Рак сигмовидной кишки плохо поддаётся лучевому лечению. Радиоактивные лучи могут повредить нормальные ткани, поэтому этот метод не применяют в лечении рака сигмовидной кишки.
В запущенных случаях рака проводят паллиативную терапию для уменьшения болевого синдрома и обеспечения проходимости кишечника. Иногда при раке сигмовидной кишки выполняют экстренные оперативные вмешательства. Они направлены на санацию брюшной полости при перитоните, устранение кишечной непроходимости.
Питание после операции
После операции на сигмовидной кишке пациентов Юсуповской больницы обеспечивают диетическим питанием. Повара готовят блюда из качественных продуктов. В них достаточное количество витаминов и минералов. В меню вводят кефир, йогурт, бифидопродукты, свежие овощи и фрукты. Все блюда готовят с применением щадящих технологий: на пару, отваривают, запекают в духовке или на гриле. При наличии показаний пищу измельчают. Пациенты питаются регулярно, дробно, малыми порциями.
Прогноз
Прогноз выживаемости больных раком сигмовидной кишки зависит от гистологического типа новообразования, уровня дифференцировки клеток, распространённости злокачественного процесса, наличия сопутствующих заболеваний и возраста пациента.
Средняя пятилетняя выживаемость – 65,2%. Боле оптимистичный прогноз после операции по поводу аденокарциномы сигмовидной кишки, поскольку опухоль растёт медленно и практически не метастазирует. При выявлении рака сигмовидной кишки первой стадии пятилетний рубеж преодолевает 93,2% пациентов, второй – 82,5%, третьей – 59,5%. До пяти лет доживает 8,1% больных раком сигмовидной кишки 4 стадии. Поэтому обращайтесь к врачу при появлении первых признаков дисфункции кишечника.
Чтобы установить точный диагноз на ранних стадиях рака сигмовидной кишки, при появлении первых признаков кишечных расстройств, звоните по телефону Юсуповской больницы. После комплексного обследования в случае подтверждения диагноза онкологи проведут адекватную терапию. После проведенного лечения врачи клиники онкологии проводят диспансерное наблюдение, цель которого – своевременное выявление и лечение ранних метастазов. Это позволяет улучшить качество и увеличить продолжительность жизни пациентов, у которых выявлен рак сигмовидной кишки.
Лазерная реканализация опухоли толстой кишки
Лазерная реканализация опухоли толстой кишки
ВВЕДЕНИЕ
Колоректальный рак занимает третье место в структуре онкологической патологии в большинстве развитых стран мира, а количество пациентов с запущенными формами заболевания достигает 70% [2]. Наибольшая смертность при этом регистрируется в странах Западной Европы (34,3 человека на 100 000 населения), а наименьшая – в США (15,2 человек на 100 000 населения) [1, 6, 9, 21, 24]. В Республике Беларусь также отмечается рост заболеваемости колоректальным раком. За последние 11 лет (с 1990 по 2011 гг.) число пациентов с впервые установленным диагнозом рака данной локализации увеличилось с 12,9 до 19,5 человек на 100 тысяч населения [4].
До 70% пациентов доставляется в стационар в экстренном порядке (при этом в абсолютном большинстве случаев развившиеся осложнения стали первым проявлением болезни). Самое частое осложнение колоректального рака – обтурационная кишечная непроходимость. Она развивается у 26,4–69% больных [7, 17]. Наиболее характерно это осложнение для опухолей левых отделов толстой кишки (67–72%), что связано с особенностями местного роста (эндофитный, циркулярный), спецификой интрамурального лимфооттока, а также большей плотностью опухоли этой локализации и меньшим диаметром кишки [16, 18, 19, 20, 23]. От колоректального рака ежегодно в мире погибает более ста тысяч человек [22]. По официальным данным, в Республике Беларусь в 2009 г. всего от рака толстой кишки умерло 2173 человека, или 22,9 на 100 тысяч населения (городских жителей – 1628, или 23,1 на 100 тысяч населения, сельских жителей – 545 или 22,2 на 100 тысяч населения); в 2011 г. от этой локализации рака умерло 2278 человек или 24,0 на 100 тысяч населения (городских жителей – 1750 или 24,5 на 100 тысяч населения, сельских жителей – 528 или 22,7 на 100 тысяч населения) [13, 14]. При этом в большинстве экономически развитых стран мира на сто вновь выявленных больных раком ободочной и прямой кишки приходится более 70 умерших, из которых на первом году с момента установления диагноза погибает около 40% пациентов. Эта закономерность обусловлена тем, что при первичном обращении пациентов к врачу запущенные формы рака (III–IV стадия) диагностируются у 71,4% пациентов с раком ободочной кишки и у 62,4% – в случаях заболевания раком прямой кишки [15].
Развитые страны мира несут огромные экономические потери в связи с поражением населения колоректальным раком. Например, в США стоимость комплексного лечения больных с этой локализацией рака занимает второе место по затратам на лечение онкобольных, составляя 6,5 миллиарда долларов в год [6].
До настоящего времени хирургическая тактика при обтурационной толстокишечной непроходимости на фоне колоректального рака продолжает оставаться предметом оживленной дискуссии. Нет общепринятых подходов к выбору методов хирургического пособия и завершения операции, что требует дальнейшего научного поиска и изучения возможности реализации новых направлений решения проблемы.
В хирургии и онкологии набирает силу направление комплексного лечения, опирающееся на концепцию «быстрого (ускоренного) выздоровления», так называемого «Fast-Track Recovery», или «Fast-Track Surgery» [5, 18, 23]. В отношении осложненного колоректального рака реализация концепции «Fast-Track Recovery» заключается в трансформации многоэтапного хирургического лечения (операций типа Цейдле- ра–Шлоффера) в одномоментные вмешательства с предварительным малоинвазивным разрешением явлений кишечной непроходимости и радикальным удалением опухоли с первичным восстановлением целостности пищеварительного тракта [6]. Данный подход приводит не только к быстрому выздоровлению с существенным сокращением общих сроков лечения и реабилитации, но и к значительному уменьшению экономических затрат на лечение, имеет весомый социальный эффект вследствие более быстрого и эффективного восстановления качества жизни пациента [9].
Авторами этой статьи начато успешное применение данной технологии в комплексном лечении стенозирующего колоректального рака по технологии «Fast-Track Recovery» [5]. Вместе с тем достаточно высокая стоимость этой методики и отсутствие производства отечественных стентов ограничивают широкое использование данной технологии в практической хирургии.
Одним из способов реканализации зоны стеноза является лазерная вапоризация центральной части раковой опухоли. Для эффективного испарения и коагуляции ткани опухолей желудочно-кишечного тракта используют различные модели высокоэнергетических лазеров, совместимые с эндоскопическим комплексом. При этом наибольшую популярность приобрели аргоновый лазер (длина волны 514 нм), полупроводниковый лазерный скальпель (970 нм) и неодимовый лазер на алюмоиттриевом гранате (Nd:YAG-лазер,1064 нм) [3, 8, 10, 11, 23]. Достаточно быстрое достижение порога вапоризации при контактном методе применения лазерного излучения способствует быстрому испарению патологической ткани, которое, в свою очередь, обеспечивает эффективное охлаждение и предупреждение глубокого ожога тканей кишки [3].
В настоящее время методической информации по применению лазерного излучения в хирургической эндоскопии явно недостаточно. Хирургами используются различные по своей технике и режимам инсталляции лазерного излучения приемы фотодеструкции патоло- гических тканей. Это отрицательно сказывается на частоте, эффективности и безопасности применения лазерного излучения в практике внутрипросветной гастроинтестинальной эндоскопии, вызывает обоснованную неуверенность у большинства практических эндоскопистов, не имеющих надлежащих условий для отработки оптимальных методик в эксперименте и на практике [3, 10, 12].
Повысить эффективность комплексного лечения стенозирующего колоректального рака путем разработки и внедрения технологии лазерной реканализации опухоли и ускоренной подготовки пищеварительного тракта к радикальному хирургическому лечению с первичным восстановлением непрерывности пищеварительного тракта.
МАТЕРИАЛЫ И МЕТОДЫ
Для реализации целей и задач первого этапа реализации концепции «Fast-Track Recovery» в лечении стенозирующего колоректального рака, осложненного толстокишечной непроходимостью, авторами использовано высокоинтенсивное импульсное лазерное излучение длиной волны 1,06 мкм и мощностью 20–25 Вт. В работе использован твердотельный импульсный лазер для эндоскопического применения «Фотэк ЛК-50» («Медиола-Эндо», ЧУП «Фотек», Республика Беларусь) в составе эндоскопической стойки для исследования толстой кишки (длина волны 1,064 мкм, максимальная средняя мощность – 60 Вт, час- тота повторения импульсов на максимальной мощности излучения – не более 50 Гц, максимальная энергия импульса – 1,2 Дж, длительность импульса – 300 мсек, класс лазерной опасности – IV, максимальная потребляемая мощность – 2,5 кВт).
Проведено проспективное клиническое исследование с оценкой результатов лечения 24 пациентов со стенозирующим колоректальным раком, обусловившим развитие непроходимости кишечника. Возраст пациентов варьировал от 54 до 81 года (в среднем 62,4 ± 7,32 года). Женщин было 13 (54,2%), мужчин – 11 (45,8%). У всех пациентов имели место признаки толстокишечной непроходимости: неотхождение стула и газов в течение последних 2–4 суток, вздутие живота, пневматоз толстой кишки (выявляемый перкуторно и рентгенологически) с дилятацией ее просвета в 2–2,5 раза, пневматоз тонкой кишки. Пациенты разделены на 2 группы (таблица).
Таблица. Распределение пациентов по локализации опухолевого процесса в основной и контрольной группах
| Локализация стенозирующей опухоли | Основная группа (n=10) | Контрольная группа (n=14) |
|---|---|---|
| Рак прямой кишки | 3 | 4 |
| Рак ректосигмоидного отдела толстой кишки | 3 | 5 |
| Рак сигмовидной кишки | 2 | 3 |
| Рак нисходящего отдела | 2 | 3 |
В первой (основной) группе при поступлении пациентов в стационар (до 24 часов) всем им выполняли лечебно-диагностическую ректо- или колоноскопию, во время которой (после установления диагноза стенозирующей опухоли толстой кишки и биопсии) производили лазерную вапоризацию внутренней части опухоли с восстановлением просвета пищеварительной трубки в зоне опухоли не менее чем на 0,8–1 см. После лазерной реканализации пациентам выполняли сифонную клизму, которая в 100% случаев приводила к эффективному антеградному опорожнению толстой кишки. Пациентам назначали слабительные и вазелиновое масло. В комплекс лечения включали ежедневную инфузионную терапию (кристаллоидные и коллоидные растворы, калий-поляризующую смесь, по показаниям – препараты парентерального питания), внутривенно вводили диаветол 15–20 мг/кг (по сухому веществу), эмоксипин 1,5–2,5 мг/кг, пентоксифиллин 0,2%-ный раствор 200–400 мл/сутки и реамберин 400–800 мл/сутки (или цитофлавин 10 мл раствора в 100 мл 0,9%-ного раствора хлорида натрия). Через 4–6 суток, не выписывая пациента из стационара, в состоянии клинико-метаболической компенсации выполняли радикальную операцию с первичным восстановлением непрерывности пищеварительного тракта (только у 1 пациента реканализация опухоли стала окончательной симптоматической операцией ввиду тяжести фоновой патологии с декомпенсацией функции сердечно-сосудистой системы). В качестве радикальных вмешательств выполнены резекция сигмовидной кишки (2), передняя низкая резекция прямой кишки (6), левосторонняя гемиколэктомия (1) с первичным восстановлением непрерывности пищеварительного тракта с помощью циркулярного механического шва.
Во второй (контрольной) группе при безуспешности консервативных мероприятий после предоперационной подготовки (от 6 до 25 ча- сов) выполнены неотложные вмешательства: левосторонняя гемиколэктомия с концевой трансверзостомией (2), операция типа Гартмана – обструктивная резекция сигмовидной кишки с концевой сигмостомией (6), петлевая сигмостомия (4), трансверзостомия (2).
В сравнительном аспекте оценены особенности течения послеоперационного периода, наличие осложнений, проведено изучение качества жизни оперированных больных перед выпиской из стационара и через 1 месяц после вмешательства путем анкетирования с использованием опросника «SF-36» (The Medical Outcomes Study Short Form 36 Items Health Survey) на основе оценки широкого спектра показателей физического и психологического благополучия, характеристик социальной адаптации и стиля жизни, определяющихся состоянием здоровья. Количественные и качественные показатели, полученные в результате исследования, проанализированы с использованием пакета прикладных статистических программ «STATISTICA» (Version 6-Index, StatSoft Inc., США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
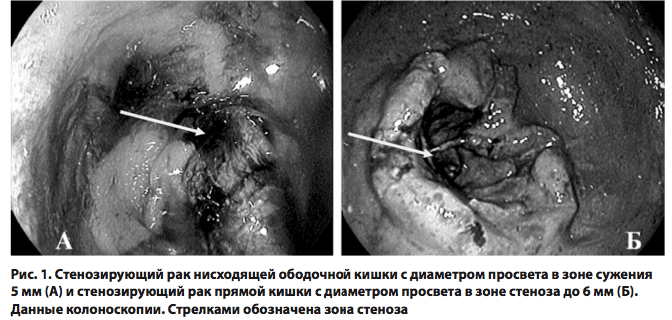
При выполнении ректо- или колоноскопии во время реализации первого этапа концепции «Fast-Track Recovery» у пациентов первой группы во время эндоскопического обследования выявлено, что сужение просвета ободочной и прямой кишок варьировало от 5 до 8 мм (средний диаметр в зоне стеноза составил 7,32 ± 2,11 мм). Протяженность зоны стеноза при этом колебалось от 5 до 100 мм (в среднем 7,12 ± 1,97 мм) (рис. 1). Во время лазерной вапоризации стенозирующей части опухоли с помощью лазерного аппарата «Фотэк ЛК-50» («Медиола Эндо») использован импульсный режим генерации энергии (длина волны 1,064 мкм, мощность – 20–25 Вт, частота повторения импульсов на максимальной мощности излучения – до 50 Гц, максимальная энергия импульса – 1,2 Дж, длительность импульса – 300 мсек).
Отрабатывая режим вапоризации, было установлено, что наиболее эффективное расстояние от торца кварцевого световода до облучаемой ткани составляет 3–5 мм. При этом обработку выступающей части опухоли производили в сканирующем режиме по периметру стенозирующей опухолевой ткани. Контакт торца световода с тканью приводил к обгоранию световода с последующим снижением эффективности вапоризации.
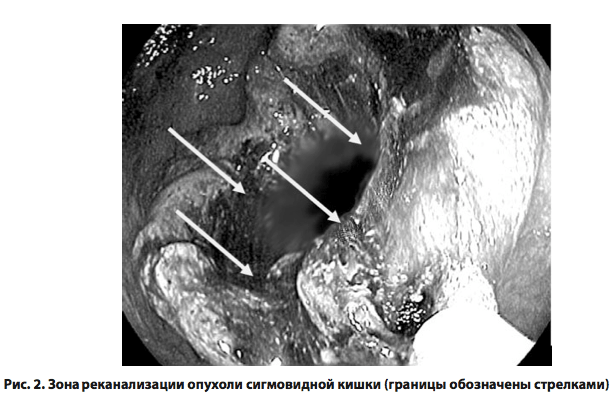
Процедура лазерной реканализации продолжалась от 25 до 65 ми- нут (в среднем 40,0 ± 11,4 минуты). Лазерную вапоризацию внутренней части опухоли проводили до восстановления просвета пищеварительной трубки в зоне опухоли не менее чем до 0,8–1 см. В 5 случаях (50%) потребовалась повторная лазерная вапоризация опухолевой ткани для достижения целевых размеров реканализации. Даже при неполном восстановлении просвета толстой кишки в зоне опухоли уже в первые сутки после манипуляции у пациентов обильно отходили газы, у 40% был самостоятельный стул. Через сутки у всех пациентов отсутствовали клинико-рентгенологические признаки непроходимости толстой кишки. Максимальный эффект реканализации отмечен спустя 3–4 дня после лазерной процедуры (рис. 2), что было обусловлено постепенным отторжением некротических тканей в просвет кишки. Кровотечений, связанных с отторжением девитализированных опухолевых тканей, отмечено не было.
Технически сложной лазерная реканализация была в случаях плохой видимости устья канала в опухоли, при преимущественно инфильтративном характере ее роста, невозможности зафиксировать эндоскоп на одной оси с опухолевым каналом, а также выраженной болезненности при инсуфляции и «перераздувании» вышележащих отделов толстой кишки из-за формирования клапана в зоне опухолевого канала.
Проведенная лазерная реканализация позволила провести адекватную подготовку толстой кишки и выполнить плановую радикальную резекцию сигмовидной кишки без осложнений. После лазерной деструкции и восстановления просвета толстой кишки в зоне опухоли ставили сифонную клизму, проведение которой приводило к обильному отхождению стула и газов. Пациентам назначали слабительные и вазелиновое масло. В комплекс лечения включали ежедневную инфузионную терапию (кристаллоидные и коллоидные растворы, калий- поляризующую смесь, по показаниям – препараты парентерального питания), внутривенно вводили диаветол 15–20 мг/кг (по сухому веществу), эмоксипин 1,5–2,5 мг/кг, пентоксифиллин 0,2%-ный раствор 200–400 мл/сутки и реамберин 400–800 мл/сутки (или цитофлавин 10 мл раствора в 100 мл 0,9%-ного раствора хлорида натрия). Последние позволили в 90% случаев в течение 2–3 суток добиться клинико- метаболической компенсации и восстановления моторно-эвакуаторной функции пищеварительного тракта.
Через 4–6 суток, не выписывая пациента из стационара, в состоянии клинико-метаболической компенсации выполняли радикальную операцию с первичным восстановлением непрерывности пищеварительного тракта (только у 1 пациента 83 лет реканализация опухоли стала окончательной симптоматической операцией ввиду тяжести фоновой патологии с декомпенсацией функции сердечно-сосудистой системы на фоне ИБС, постинфарктного крупноочагового кардиосклероза с недостаточностью кровообращения 2А, аневризмой восходящего отдела аорты, артериальной гипертензией III, риск 4). В качестве радикальных вмешательств в этой группе пациентов выполнены резекция сигмовидной кишки (2), передняя низкая резекция прямой кишки (6), левосторонняя гемиколэктомия (1) с первичным восстановлением непрерывности пищеварительного тракта с помощью циркулярного механического шва. Осложнений в послеоперационном периоде зарегистрировано не было. Все пациенты были выписаны из стационара в удовлетворительном состоянии для реабилитации в амбулаторных условиях. Средний койко-день (с учетом первого этапа лечения) составил 17,3 ± 6,72.
В группе сравнения при безуспешности консервативных мероприятий после предоперационной подготовки (от 6 до 25 часов) выполнены неотложные вмешательства: левосторонняя гемиколэктомия с концевой трансверзостомией (2), операция типа Гартмана – обструктивная резекция сигмовидной кишки с концевой сигмостомией (6), петлевая сигмостомия (4), трансверзостомия (2). Выраженные признаки непроходимости кишечника потребовали интраоперационного использования различных методик зондовой декомпрессии кишечника в 71,4% случаев. Послеоперационный период у всех пациентов протекал тяжело. Во всех наблюдениях он требовал применения дополнительных способов восстановления моторно-эвакуаторной функции пищеварительного тракта (интестинального диализа, фармакологической стимуляции кишечника), проведения вспомогательных методик афферентной терапии и системного антибактериального лечения. Несмотря на интенсивное лечение, у ряда пациентов этой группы зарегистрированы послеоперационные осложнения: пневмония (14,3%), инфекция области послеоперационного вмешательства (35,7%), тромбофлебит глубоких вен (7,1%). Средний койко-день у пациентов этойгруппы составил 28,7 ± 9,28 дней.
Оценка качества жизни по шкале SF-36 выявила существенные различия у пациентов групп сравнения во все анализируемые сроки. Так, средний балл по показателю общего здоровья у пациентов через 10 суток после хирургического вмешательства у пациентов основной группы (леченных по технологии «Fast-Track Recovery») составил 68,9 ± 7,3, в то время как в группе сравнения – 56,4 ± 5,2 (различия между группами достоверны при р = 0,02). Через 1 месяц после выписки из стационара по большинству показателей (доменов) [PF, ВР, GH, VT, SF и МН] шкалы SF-36 качество жизни пациентов основной группы (леченных по технологии «Fast-Track Recovery») было на несколько порядков (на 32,4–50,7%) выше, чем в группе сравнения (p = 0,0006?0,0346 по U-тесту Mann–Whitney).
ВЫВОДЫ
1. Лазерная реканализация опухоли толстой кишки позволяет в условиях непроходимости кишечника выполнить раннюю антеградную декомпрессию пищеварительного тракта с быстрым восстановлением его моторно-эвакуаторной функции и раннейклинико-метаболической компенсацией (без лапаротомии и формирования кишечного свища). Предлагаемый подход позволяет в ограниченные сроки осуществить подготовку пациента к радикальному вмешательству, не выписывая его из стационара, способствует повышению надежности хирургического лечения и эффективности одномоментного восстановления непрерывности пищеварительного тракта.
2. Ранняя эндоскопическая декомпрессия кишечника как первый этап реализации концепции «Fast-Track Recovery» в сочетании с комплексной программой медикаментозной коррекции нарушений гомеостаза и внутристеночной кишечной гемоциркуляции позволяют в сжатые сроки устранить морфофункциональные нарушения со стороны приводящих отделов кишечника и выполнить радикальное хирургическое лечение колоректального рака по принципам планового вмешательства при отсутствии проблем с приводящим отделом кишечника и возможностью надежного одномоментного восстановления непрерывности пищеварительного тракта.
3. Лазерная реканализация опухоли позволяет успешно реализовать основные принципы концепции «Fast-Track Recovery», что в сочетании с радикальным хирургическим лечением и первичным восстановлением непрерывности пищеварительного тракта существенно сокращает сроки пребывания пациентов в стационаре, избавляет от необходимости дальнейшей хирургической реабилитации при наложении колостомы. Она способствует получению достаточного экономического и социального эффекта (за счет сокращения сроков госпитализации, уменьшения частоты послеоперационных осложнений, снижения частоты выхода на инвалидность, исключения необходимости повторного хирургического лечения, а также значительно более раннего восстановления оптимального качества жизни пациентов).
4. В условиях запущенности онкологического процесса или наличия абсолютных противопоказаний к хирургическому лечению лазерная реканализация (изолированная или в сочетании со стентированием просвета толстой кишки) может стать окончательным вариантом лечебного пособия в условиях прогрессирования признаков кишечной непроходимости.