Что такое степень дисперсности
Степень дисперсности. Дисперсная фаза. Дисперсионная среда
Большинство окружающих нас веществ представляют собой смеси различных субстанций, поэтому изучение их свойств играет важную роль в развитии химии, медицины, пищевой промышленности и других отраслей народного хозяйства. В статье рассматриваются вопросы, что такое степень дисперсности, и как она влияет на характеристики системы.
Что такое дисперсные системы?
Прежде чем перейти к обсуждению вопроса о степени дисперсности, необходимо пояснить, к каким системам может применяться это понятие.
Представим себе, что у нас имеются два различных вещества, которые могут отличаться друг от друга химическим составом, например, поваренная соль и чистая вода, или же агрегатным состоянием, например, та же вода в жидком и твердом (лед) состояниях. Теперь необходимо взять и смешать эти две субстанции и интенсивно их перемешать. Какой будет результат? Он зависит от того, прошла при смешивании химическая реакция или нет. Когда речь ведут о дисперсных системах, то полагают, что при их образовании никакой реакции не происходит, то есть исходные вещества сохраняют свое строение на микроуровне и присущие им физические свойства, например, плотность, цвет, электропроводность и другие.

Гомогенные и гетерогенные системы
Понятно, что названные две составляющие дисперсной системы будут отличаться по своим физическим свойствам. Например, если бросить в воду песок и размешать его, то понятно, что существующие в воде песчинки, химическая формула которых SiO2, ничем не будут отличаться от того состояния, когда они не находились в воде. В таких случаях говорят о гетерогенности. Иными словами, гетерогенная система представляет собой смесь из нескольких (двух и более) фаз. Под последней понимают некоторый конечный объем системы, который характеризуется определенными свойствами. В примере выше имеем две фазы: песок и вода.

Однако размеры частиц дисперсной фазы при их растворении в какой-либо среде могут стать настолько маленькими, что они перестанут проявлять свои индивидуальные свойства. В этом случае говорят о гомогенных или однородных субстанциях. В них хотя и находится несколько компонентов, но все они образуют одну фазу по всему объему системы. Примером гомогенной системы является раствор NaCl в воде. При его растворении из-за взаимодействия с полярными молекулами H2O кристалл NaCl распадается на отдельные катионы (Na+) и анионы (Cl-). Они однородно смешиваются с водой, и уже невозможно в такой системе найти границу раздела между растворимым веществом и растворителем.
Размер частиц
Что такое степень дисперсности? Эту величину необходимо рассмотреть подробнее. Что она собой представляет? Она обратно пропорциональна размеру частиц дисперсной фазы. Именно эта характеристика лежит в основе классификации всех рассматриваемых субстанций.
Общепринятая классификация
Классификация дисперсных систем по степени дисперсности приведена ниже:
Касательно приведенной классификации проясним два момента: во-первых, приведенный цифры являются ориентировочными, то есть система, в которой размер частиц будет 3 нм, не обязательно является коллоидом, она может представлять собой и истинный раствор. Это можно установить, изучив ее физические свойства. Во-вторых, можно заметить, что в списке используется фраза «условный размер». Связано это с тем, что форма частиц в системе может быть совершенно произвольной, и в общем случае имеет сложную геометрию. Поэтому говорят о некотором среднем (условном) их размере.
Далее в статье дадим краткую характеристику отмеченных типов дисперсных систем.
Истинные растворы
Как выше было сказано, степень дисперсности частиц в настоящих растворах настолько велика (их размер очень маленький, Вам будет интересно: Формулы площади сектора круга и длины его дуги
Атомы, которые находятся на поверхности частиц дисперсной фазы, обладают ненасыщенными химическими связями. Это означает, что они могут образовывать соединения с другими молекулами. Как правило, эти соединения возникают за счет ван-дер-ваальсовых сил либо водородных связей. Они способны удержать несколько слоев молекул на поверхности коллоидных частиц.
Степень дисперсности и удельная поверхность
Расчет величины S/m является непростой задачей. Дело в том, что частицы в коллоидном растворе имеют различные размеры, форму, а также поверхность каждой частицы обладает уникальным рельефом. Поэтому теоретические методы решения этой задачи приводят к качественным результатам, а не к количественным. Тем не менее, полезно привести от степени дисперсности формулу удельной поверхности.
Экспериментальный способ определения Sud заключается в вычислении объема газа, который адсорбируется исследуемым веществом, а также в измерении размера пор (дисперсная фаза) в нем.
Системы лиофильные и лиофобные
Важно отметить, что лиофобные (гидрофобные, если растворителем является вода) системы являются термодинамически нестабильными, что их отличает от лиофильных.
Свойства суспензий
Примерами суспензий в природе можно назвать мутную воду в реках или вулканический пепел. Использование человеком суспензий связано, как правило, с медициной (растворы лекарственных препаратов).
Коагуляция
Что можно сказать смесях веществ с различной степенью дисперсности? Частично этот вопрос уже был освещен в статье, поскольку в любой дисперсной системе частицы имеют размер, лежащий в некоторых пределах. Здесь лишь рассмотрим один любопытный случай. Что будет, если смешать коллоид и истинный раствор электролита? Взвешенная система нарушится, и произойдет ее коагуляция. Причина ее заключается во влиянии электрических полей ионов истинного раствора на поверхностный заряд коллоидных частиц.
Х и м и я
Коллоидная химия
Дисперсные системы. Определение. Классификация.
Растворы
В предыдущем параграфе мы говорили о растворах. Здесь коротко напомним об этом понятии.
Растворами называют однородные (гомогенные) системы, состоящие из двух и более компонентов.
Гомогенная система – это однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела).
Такое определение раствора не вполне корректно. Оно скорее относится к истинным растворам.
В тоже время существуют ещё коллоидные растворы, которые являются не гомогенными, а гетерогенными, т.е. состоят из разных фаз, разделённых поверхностью раздела.
Для того чтобы достичь большей чёткости в определениях используют другой термин – дисперсные системы.
Перед рассмотрением дисперсных систем немного расскажем об истории их изучения и о появления такого термина как коллоидные растворы.
История вопроса
Ещё в 1845 г. химик Франческо Сельми, исследуя свойства различных растворов, заметил, что биологические жидкости – сыворотка и плазма крови, лимфа и другие – резко отличаются по своим свойствам от обычных истинных растворов, и поэтому такие жидкости были им названы псевдорастворами.
Коллоиды и кристаллоиды
Дальнейшие исследования в этом направлении, проводившиеся с 1861 г. английским учёным Томасом Грэмом, показали, что одни вещества, быстро диффундирующие и проходящие через растительные и животные мембраны, легко кристаллизуются, другие же обладают малой способностью к диффузии, не проходят через мембраны и не кристаллизуются, а образуют аморфные осадки.
Первые Грэм назвал кристаллоидами, а вторые – коллоидами (от греческого слова kolla – клей и eidos – вид) или клееподобными веществами.
В частности, было выявлено, что вещества, способные к образованию аморфных осадков, как, например, альбумин, желатин, гуммиарабик, гидроокиси железа и алюминия и некоторые другие вещества, диффундируют в воде медленно по сравнению со скоростью диффузии таких кристаллических веществ, как поваренная соль, сернокислый магний, тростниковый сахар и др.
В таблице ниже приведены коэффициенты диффузии D для некоторых кристаллоидов и коллоидов при 18С.
Кристаллоиды
Молекулярный вес
D·10 7 см 2 /сек
Коллоиды
Молекулярный вес
D·10 7 см 2 /сек
Из таблицы видно, что между молекулярным весом и коэффициентом диффузии существует обратная зависимость.
Кромме того у кристаллоидов была обнаружена способность не только быстро диффундировать, но и диализироваться, т.е. проходить через мембранны, в противоположность коллоидам, имеющим больший размер молекул и поэтому медленно диффундирующим и не проникающим через мембраны.
В качестве мембран используют стенки бычьего пузыря, целлофан, плёнки из железисто-синеродистой меди и т.д.
На основании сделанных наблюдений Грэм установил, что все вещества могут быть подразделены на кристаллоиды и коллоиды.
Русские не согласны
Против такого строго разделения химических веществ возражал профессор Киевского университета И.Г. Борщёв (1869). Мнение Борщёва позднее было подтвеждено исследованиями другого русского учёного Веймарна, который доказал, что одно и то же вещество в зависимости от условий может проявлять свойства коллоидов или кристаллоидов.
Так, например, раствор мыла в воде обладает свойствами коллоида, а мыло, растворённое в спирте, проявляет свойства истинных растворов.
Точно также кристаллические соли, например, поваренная соль, растворённая в воде, даёт истинный раствор, а в бензоле – коллоидный раствор и т.п.
Гемоглобин же или яичный альбумин, обладающие свойствами коллоидов, могут быть получены в кристаллическом состоянии.
Д.И. Менделеев полагал, что любое вещество, в зависимости от условий и природы среды, может проявлять свойства коллоида. В настоящее время любое вещество можно получить в коллоидном состоянии.
Таким образом, нет оснований подразделять вещества на два обособленных класса – на кристаллоиды и коллоиды, а можно говорить о коллоидном и кристаллоидном состоянии вещества.
Под коллоидным состоянием вещества подразумевается определённая степень его раздробленности или дисперсности и нахождении коллоидных частиц во взвешенном состоянии в растворителе.
Наука, изучающая физико-химические свойства гетерогенных высокодисперсных и высокомолекулярных систем называется коллоидной химией.
Дисперсные системы
Если одно вещество, находящееся в раздробленном (диспергированном) состоянии, равномерно распределено в массе другого вещества, то такую систему называют дисперсной.
Так, например, система, представляющая собой взмученную глину в воде, состоит из взвешенных мелких частиц глины – дисперсной фазы и воды – дисперсионной среды.
Дисперсные (раздробленные) системы являются гетерогенными.
Дисперсные системы, в отличие от гетерогенных с относительно крупными, сплошными фазами, называют микрогетерогенными, а коллоиднодисперсные системы называют ультрамикрогетерогенными.
Классификация дисперсных систем
Классификацию дисперсных систем чаще всего производят исходя из степени дисперсности или агрегатного состояния дисперсной фазы и дисперсионной среды.
Классификация по степени дисперсности
Все дисперсные системы по величине частиц дисперсной фазы можно разделить на следующие группы:
Вид дисперсности
Размер частиц
Микроскопическая дисперсность (суспензии, эмульсии)
Эти системы содержат в качестве дисперсной фазы наиболее крупные частицы диаметром от 0,1 мк и выше. К этим системам относятся суспензии и эмульсии.
Суспензиями называют системы, в которых твёрдое вещество находится в жидкой дисперсионной среде, например, взвесь крахмала, глины и др. в воде.
Эмульсиями называют дисперсионные системы двух несмешивающихся жидкостей, где капельки одной жидкости во взвешенном состоянии распределены в объёме другой жидкости. Например, масло, бензол, толуол в воде или капельки жира (диаметром от 0,1 до 22 мк) в молоке и др.
Коллоидные частицы при наличии у них электрического заряда и сольватно-ионных оболочек остаются во взвешенном состоянии и без изменения условий очень долго могут не выпадать в осадок.
Примерами коллоидных систем могут служить растворы альбумина, желатина, гуммиарабика, коллоидные растворы золота, серебра, сернистого мышьяка и др.
Такие системы имеют размеры частиц, не превышающие 1ммк. К молекулярно-дисперсным системам относятся истинные растворы неэлектролитов.
Размеры некоторых молекул, частиц, клеток.
Объект
Размеры (ммк)
Частицы коллоидного золота
По мере изменения размеров частиц от наиболее крупных к мелким и обратно будут соответственно меняться и свойства дисперсных систем. При этом коллоидные системы занимают как бы промежуточное положение между грубыми взвесями и молекулярно-дисперсными системами.
Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды.
Пены – это дисперсия газа в жидкости, причём в пенах жидкость вырождается до тонких плёнок, разделяющих отдельные пузырьки газа.
Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена другой, нерастворяющей её жидкостью (например вода в жире).
Суспензиями называют низкодисперсные системы твёрдых частиц в жидкостях.
Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем:
Дисперсная фаза
Дисперсионная среда
Название и пример
Дисперсная система не образуется
Газовые эмульсии и пены
Пористые тела: поролон пемза
Аэрозоли: туманы, облака
Эмульсии: нефть, крем, молоко, маргарин, масло
Капилярные системы: Жидкость в пористых телах, грунт, почва
Аэрозоли (пыли, дымы), поршки
Суспензии: пульпа, ил, взвесь, паста
Твёрдые системы: сплавы, бетон
Золи – другое название коллоидных растворов.
Коллоидные растворы иначе называют золями (от латинского solutus – растворённый).
Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой, а пыль и дым – аэрозоли с твёрдой дисперсной фазой. Дым более высокодисперсная система, чем пыль.
Дисперсные системы с жидкой дисперсионной средой называют лизолями (от греческого «лиос» – жидкость).
В зависимости от растворителя (дисперсионной среды), т.е. воды, спирта бензола или эфира и т.д., различают гидрозоли, алкозоли, бензоли, этерозоли и т.д.
Связнодисперсные системы. Гели.
Дисперсные системы могут быть свободнодисперсными и связнодисперсными в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы.
К свободнодисперсным системам относятся аэрозоли, лизоли, разбавленные суспензии и эмульсии. Они текучи. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести.
Связнодисперсные системы – твердообразны. Они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки.
Такая структура ограничивает текучесть дисперсной системы и придаёт ей способность сохранять форму. Подобные структурированные коллоидные системы называются гелями.
Переход золя в гель, происходящий в результате понижения устойчивости золя, называют гелеобразованием (или желатинированием).
Порошки (пасты), пены – примеры связнодисперсных систем.
Почва, образовавшаяся в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ, также представляет собой связнодисперсную систему.
Сплошную массу вещества могут пронизывать поры и капиляры, образующие капилярнодисперсные системы. К ним относятся, например, древесина, кожа, бумага, картон, ткани.
Лиофильность и лиофобность
Общей характеристикой коллоидных растворов является свойство их дисперсной фазы взаимодействовать с дисперсионной средой. В этом отношении различают два типа золей:
1. Лиофобные (от греческого phobia – ненависть) и
2. Лиофильные (от греческого philia – любовь).
У лиофобных золей частицы не имеют сродства к растворителю, слабо с ним взаимодействуют и образуют вокруг себя тонкую оболочку из молекул растворителя.
В частности, если дисперсионной средой является вода, то такие системы называются гидрофобными, например, золи металлов железа, золота, сернистого мышьяка, хлористого серебра и т.д.
В лиофильных системах между диспергированным веществом и растворителем имеется сродство. Частицы дисперсной фазы, в этом случае, приобретают более объёмную оболочку из молекул растворителя.
В случае водной дисперсионной среды такие системы называются гидрофильными, как, например, растворы белка, крахмала, агар-агара, гуммиарабика и др.
Коагуляция коллоидов. Стабилизаторы.
Вещество на границе раздела фаз.
Все жидкости и твёрдые тела ограничены внешней поверхностью, на которой они соприкасаются с фазами другого состава и структуры, например, с паром, другой жидкостью или твёрдым телом.
Свойства вещества в этой межфазовой поверхности, толщиной в несколько поперечников атомов или молекул, отличаются от свойств внутри объёма фазы.
Внутри объёма чистого вещества в твёрдом, жидком или газообразном состоянии любая молекула окружена себе подобными молекулами.
В пограничном слое молекулы находятся во взаимодействии или с другим числом молекул (другим в сравнении с взаимодействием внутри объёма вещества).
Это происходит, например, на границе жидкости или твёрдого тела с их паром. Либо в пограничном слое молекулы вещества взаимодействуют с молекулами другой химической природы, например, на границе двух взаимно малорастворимых жидкостей.
В результате различия в характере взаимодействия внутри объёма фаз и на границе фаз возникают силовые поля, связанные с этой неравномерностью. (Подробнее об этом в параграфе Поверхностное натяжение жидкости.)
Чем больше различие в напряжённости межмолекулярных сил, действующих в каждой из фаз, тем больше потенциальная энергия межфазовой поверхности, кратко называемой поверхностной энергией.
Коагуляция коллоидов
Все самопроизвольные процессы происходят в направлении уменьшения энергии системы (изобарного потенциала).
Аналогично, на границе раздела фаз самопроизвольно происходят процессы в направлении уменьшения свободной поверхностной энергии.
Свободная энергия тем меньше, чем меньше поверхность раздела фаз.
А поверхность раздела фаз, в свою очередь, связана со степенью дисперсности растворённого вещества. Чем выше дисперсность (мельче частицы дисперсной фазы), тем больше поверхность раздела фаз.
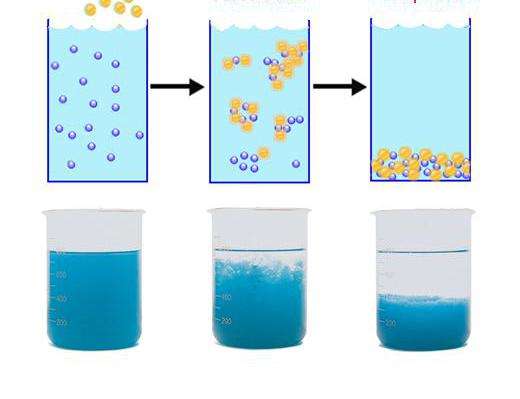
Таким образом, в дисперсных системах всегда существуют силы, приводящие к уменьшению суммарной поверхности раздела фаз, т.е. к укрупнению частиц. Поэтому происходит слияние мелких капель в туманах, дождевых облаках и эмульсиях – агрегация высокодисперсных частиц в более крупные образования.
Всё это приводит к разрушению дисперсных систем: туманы и дождевые облака проливаются дождём, эмульсии расслаиваются, коллоидные растворы коагулируют, т.е. разделяются на осадок дисперсной фазы (коагулят) и дисперсионную среду или в случае вытянутых частиц дисперсной фазы, превращаются в гель.
Способность раздробленных систем сохранять присущую им степень дисперсности называется агрегативной устойчивостью.
Стабилизаторы дисперсных систем
Как было сказано ранее, дисперсные системы принципиально термодинамически неустойчивы. Чем выше дисперсность, тем больше свободная поверхностная энергия, тем больше склонность к самопроизвольному уменьшению дисперсности.
Поэтому для получения устойчивых, т.е. длительно сохраняющихся суспензий, эмульсий, коллоидных растворов, необходимо не только достигнуть заданной дисперсности, но и создать условия для её стабилизации.
Ввиду этого устойчивые дисперсные системы состоят не менее чем из трёх компонентов: дисперсной фазы, дисперсионной среды и третьего компонента – стабилизатора дисперсной системы.
Стабилизатор может иметь как ионную, так и молекулярную, часто высокомолекулярную, природу.
Ионная стабилизация золей лиофобных коллоидов связана с присутствием малых концентраций электролитов, создающих ионные пограничные слои между дисперсной фазой и дисперсионной средой.
Высокомолекулярные соединения (белки, полипептиды, поливиниловый спирт и другие), добавляемые для стабилизации дисперсных систем, называют защитными коллоидами.
Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое сетчатые и гелеобразные структуры, создающие структурно-механический барьер, который препятствует объединению частиц дисперсной фазы.
Структурно-механическая стабилизация имеет решающее значение для стабилизации взвесей, паст, пен, концентрированных эмульсий.