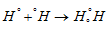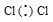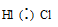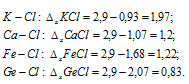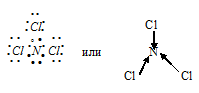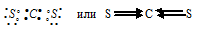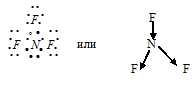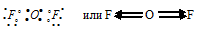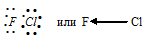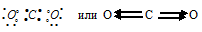Что такое степень ионности
Степень ионности связи – основы материаловедения
Очевидно, что химическая связь в полупроводниковых соединениях является полярной ковалентной связью (ковалентно-ионной). Рассмотрим теперь вопрос о распределении электронной плотности между компонентами соединения.
При «чистой ковалентной» связи электронная плотность распределена совершенно симметрично между одинаковыми атомами, и ее центр симметрии располагается в середине межатомного расстояния. В «чисто ионных» соединениях распределение электронной плотности таково, что она в основном сосредоточена вокруг каждого иона и обладает (приближенно) сферической симметрией. В случае же промежуточной, ковалентно-ионной связи, логично предположить, что центр симметрии электронного облака смещен от середины межатомного расстояния к одному из соседних атомов. Величина этого смещения определяет степень ионности связи δ. Очевидно, что степень ионности связи должна быть пропорциональна разности электроотрицательностей.
Таблица 2.4. Разность электроотрицательностей, степень ионности связи и структура бинарных соединений AN B8−N [20].
а Для обозначения структурных типов использованы следующие обозначения: сф. — сфалерит, в. — вюртцит, NaCl — структура каменной соли.
Найдем степень ионности связи бинарных соединений ANB8−N, где N — номер группы элемента A. Если предположить, что степень ионности связи δ линейно связана с разностью электроотрицательностей
Выделенная многочисленная группа соединений проявляет полупроводниковые свойства. Межатомная связь в этих соединениях представляет собой комбинацию ковалентного и ионного типов связи с преимуществом ковалентного. Соединения этой группы кристаллизуются в структуры типа сфалерита или вюртцита, в которых Zк = 4. Ко второй, небольшой, группе относятся соединения с преимущественно ионным типом
химической связи и кристаллической структурой типа NaCl (Zк = 6). Это — диэлектрики.
Источник: И. А. Случинская, Основы материаловедения и технологии полупроводников, Москва — 2002
Ионный характер ковалентных связей
Величина зарядов, возникающих при образовании полярной ковалентной связи, зависит от различия в способности притягивать электроны у двух атомов, связанных такой ковалентной связью. Способность атома притягивать электроны принято называть его электроотрицательностью. Для количественного определения электроотрицательности предложено несколько шкал. Чаще всего используется шкала электроотрицательности, которую предложил Л. Полинг. Построение этой шкалы основано на экспериментальных значениях энтальпии образования связей в двухатомных молекулах.
Электроотрицательность элементов периодической системы последовательно возрастает при перемещении слева направо вдоль каждого периода. В пределах каждой группы (за исключением части элементов группы Ш) электроотрицательность последовательно убывает при перемещении сверху вниз. В табл. 2.2 указаны электроотрицательности некоторых элементов, вычисленные Полингом. В шкале Полинга электроотрицательность фтора (наиболее электроотрицательного из всех элементов) условно принята равной 4,0. Отметим, что электроотрицательность является безразмерной величиной.
Приведем несколько примеров, показывающих, как пользоваться данными табл. 2.2 для оценки ионного характера ковалентных связей.
Чем больше разность электроотрицательностей, тем больше доля ионного характера, или степень ионности связи. Разность электроотрицательностей, равная 2,1, соответствует приблизительно 50%-ному ионному характеру. Связи с разностью электроотрицательностей больше 2,1 могут считаться ионными. Связи с меньшей разностью электроотрицательностей относят к полярным ковалентным связям. Чем меньше разность электроотрицательностей, тем меньше степень ионности связи. Нулевая разность электроотрицательностей указывает на отсутствие ионного характера и, следовательно, на чисто ковалентную связь.
Положительный заряд на катионе в ионном соединении может притягивать к себе электроны от соседнего аниона. Это приводит к искажению электронного облака аниона (см. рис. 2.11). Такое искажение называется поляризацией. Способность катиона притягивать электроны и поляризовать анион называется его поляризующей способностью. Степень поляризации ионной связи является мерой степени ковалентности связи. Карты электронной плотности чисто ионных соединений, например фторида лития, не обнаруживают никакого искажения.
В 1923 г. К. Фаянс выдвинул предположение, что все соединения характеризуются определенной степенью ковалентности. Далее он предположил, что поляризация ионной
Эти три правила называются правилами Фаянса.
Большая Энциклопедия Нефти и Газа
Степень ионности или ковалентнос-ти связи характеризуется электронной плотностью. [1]
Степень ионности можно оценить несколькими методами, но, вероятно, самым прямым из них является электронная спектроскопия соединений данного элемента. Интервалы между электронными энергетическими уровнями, безусловно, зависят от межатомных взаимодействий, и изменения расположения этих уровней вызовут изменения в спектре. Невзаимодействующие ионы, по-видимому, будут иметь наиболее простые спектры, поскольку они обладают наивысшей симметрией и наименьшими энергиями взаимодействия с соседними ионами. Для ковалентно связанных атомов можно ожидать, что электронные спектры будут сильно зависеть от природы атомов, образующих ковалент-ные связи. Это и наблюдается в действительности. [3]
Степень ионности ( или процент ионности) химической связи определяется как отношение эффективного заряда к заряду электрона. [4]
Степень ионности можно оценить несколькими методами, но, вероятно, самым прямым из них является электронная спектроскопия соединений данного элемента. Интервалы между электронными энергетическими уровнями, безусловно, зависят от межатомных взаимодействий, и изменения расположения этих уровней вызовут изменения в спектре. Невзаимодействующие попы, по-видимому, будут иметь наиболее простые спектры, поскольку они обладают наивысшей симметрией и наименьшими энергиями взаимодействия с соседними ионами. Для ковалентно связанных атомов можно ожидать, что электронные спектры будут сильно зависеть от природы атомов, образующих ковалент-ные связи. Это и наблюдается в действительности. [5]
Степень ионности остается все же неопределенной. [6]
Степенью ионности называют долю ионного характера связи. Ионную связь можно рассматривать как предельную полярную химическую связь, для которой эффективный заряд атома близок к единице. [10]
Степенью ионности соединения : обычно в ионных соединениях, где изменения потенциала особенно ощутимы, подвижность низка; с другой стороны, в кристаллах с ковалентной связью ( где отсутствует чередование положительных и отрицательных ионов) подвижность носителей значительно выше. Сравнение ряда изоморфных кристаллов, таких как, например, PbS, PbSe, PbTe, ясно показывает, как увеличивается подвижность при переходе от ионной к ковалентной связи. [11]
Степенью ионности соединения : обычно в ионных соединениях, где изменения потенциала особенно ощутимы, подвижность низка; с другой стороны, в кристаллах с ковалентной связью ( где отсутствует чередование положительных и отрицательных ионов) подвижность носителей значительно выше. Сравнение ряда изоморфных кристаллов, таких как, например, PbS, PbSe, РЬТе, ясно показывает, как увеличивается подвижность при переходе от ионной к ковалентной связи. [12]
Причем степень ионности переходного состояния выражается по-разному в зависимости от исходного углеводорода, галогена и катализатора. [13]
Ключевая информация
В химической науке существует четыре основных типа связи — ковалентная, ионная, металлическая и водородная. Металлическая возникает между элементами-металлами, водородная — между молекулами, состоящими из водорода и атомов с высокой электроотрицательностью (азотом, кислородом, фтором).
Самые разнообразные соединения относятся к ковалентной и ионной связям, которые представляют по своему составу смешанный тип. Для ионной связи ковалентная в определенном смысле выполняет материнскую функцию.
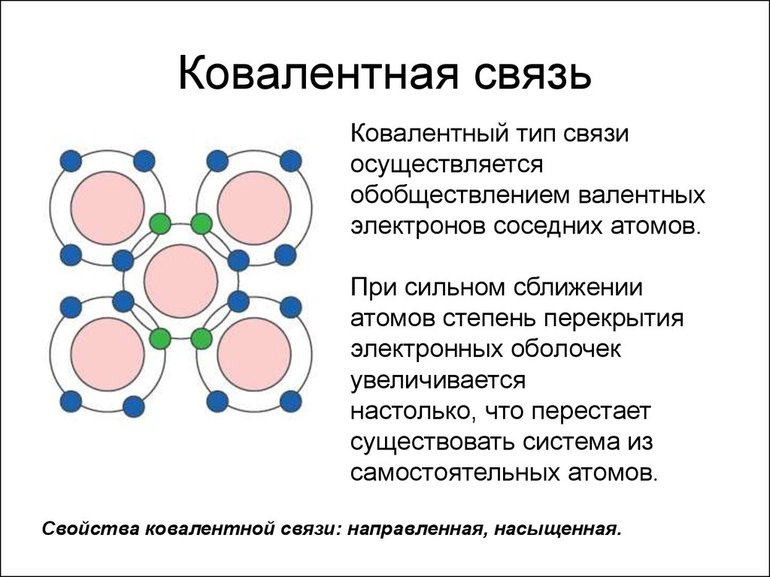
Наиболее частым и распространенным видом химической связи считается именно ковалентная. Это соединение, в процессе формирования которого обобществляется (перекрывается) пара валентных электронных облаков. Количество таких связей, образованных атомом элемента, — это показатель ковалентности.
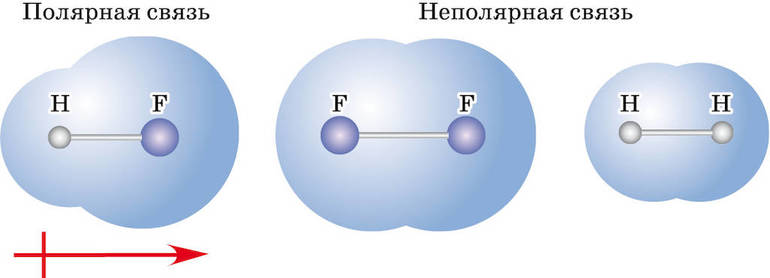
Ковалентная связь бывает двух типов — неполярная и полярная. Определяющими факторами для типа связи служат значения электроотрицательности взаимодействующих атомов химических элементов. Если эти показатели у атомов:
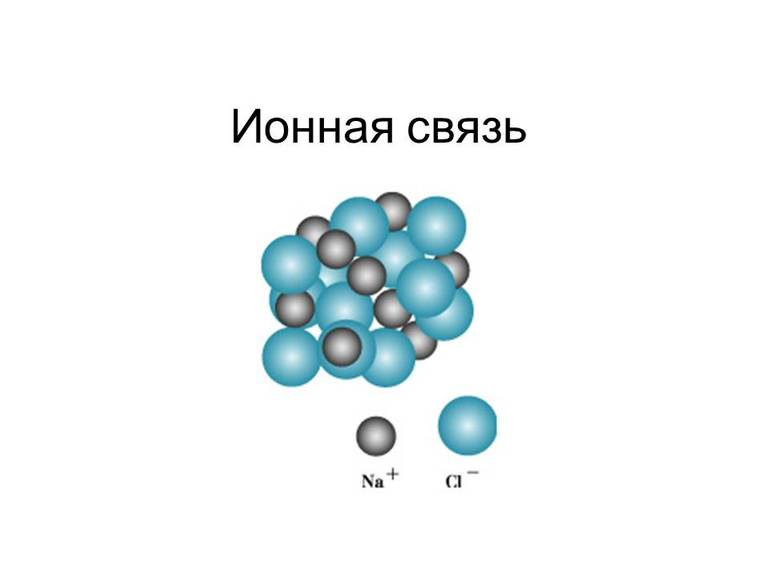
Электростатическое притяжение частиц в ионной связи очень сильное. Эта особенность обусловливает высокие температуры плавления и кипения для веществ с такой связью. Однако стопроцентного ионного соединения не существует. Электронная пара не переходит к более электроотрицательному атому полностью. В качестве яркого примера наиболее сильного смещения электронов стоит привести фторид цезия CsF. Так называемая «степень ионности» в этом соединении достигает 97%.
Заряды частиц и их классификация
По определению ионная химическая связь — это соединение ионов с разным зарядом (положительным и отрицательным). Это частный случай ковалентной полярной связи или, иначе говоря, крайний случай поляризации.
Положительно заряженные ионы называются катионами. Примеры: K+ (ион калия), Fe 2 + (ион железа) и так далее. Катионы образуются в результате отдачи (потери) атомом одного электрона или нескольких. У них положительный заряд ядра превышает число отрицательно заряженных электронов.
По значению заряда ионы классифицируются на соответствующие категории (в скобках приведены примеры ионов, входящих в группу):
Одна из особенностей связи разноименных ионов — при их взаимодействии друг с другом их заряды полностью разделяются. Это связано с большой разностью электроотрицательностей атомов в паре.
Процесс взаимодействия
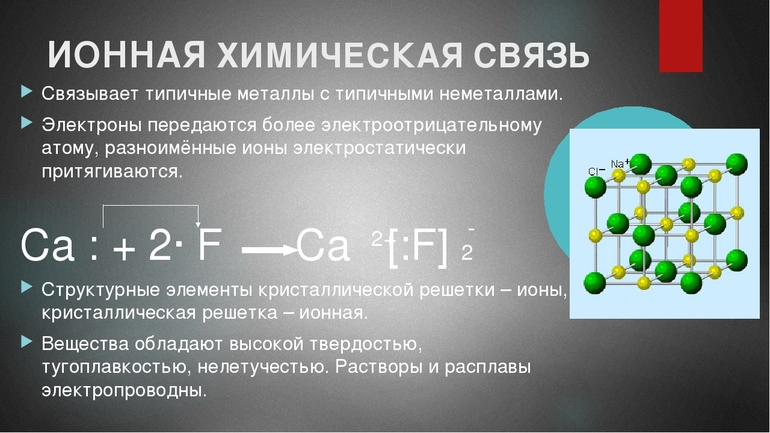
В отличие от металлической связи, где соединение образуется парой элементов-металлов, в процессе образования ионного соединения в качестве участников выступают атомы металлов и неметаллов. Типичные металлы охотно делятся электронами, а типичные неметаллы не менее охотно их принимают. Отдающий атом называется донорным, а принимающий — акцепторным.
При возникновении соединения атом неметалла забирает электроны на свой внешний энергетический уровень, достраивая его таким методом. В результате он приобретает устойчивую конфигурацию из восьми электронов (согласно правилу октета). То есть суть механизма образования ионной связи заключается в следующем: после взаимного притяжения друг к другу противоположно заряженные ионы образуют стабильное соединение.
Атомы с почти полной или почти пустой внешней (валентной) оболочкой вступают в химические реакции максимально охотно. Заполненность этого слоя играет ключевую роль в электронном обмене. Малое количество пустых орбиталей на внешней оболочке повышает шансы атома на получение электронов извне. А мизерное количество электронов, расположенных на валентной оболочке, напротив, увеличивает вероятность отдачи атомом электрона.
Электроотрицательность атома химического элемента выражается в его способности к притяжению электронов к своему внешнему слою. Именно поэтому чем полнее заполнена валентная оболочка атома, тем больше значение его электроотрицательности. Показатели электроотрицательности связаны с расположением элементов в периодической таблице Менделеева — чем дальше они находятся друг от друга (расстояние оценивают в основном по группе), тем больше разница между показателями. По этой причине ионные соединения особенно характерны для металлов и неметаллов, расположенных в системе наиболее удаленно (например, в I и VII группах).
Помимо простой связи ионов, стоит особо отметить ее молекулярную разновидность. Главная особенность такого соединения заключается в том, что в качестве ионов в ней выступают целые молекулы, а не отдельные атомы, как в обычной связи.
Примеры возникновения
Подробно рассмотреть, как взаимодействие атомов с разноименными зарядами приводит к образованию связи ионов, стоит на нескольких простых примерах.
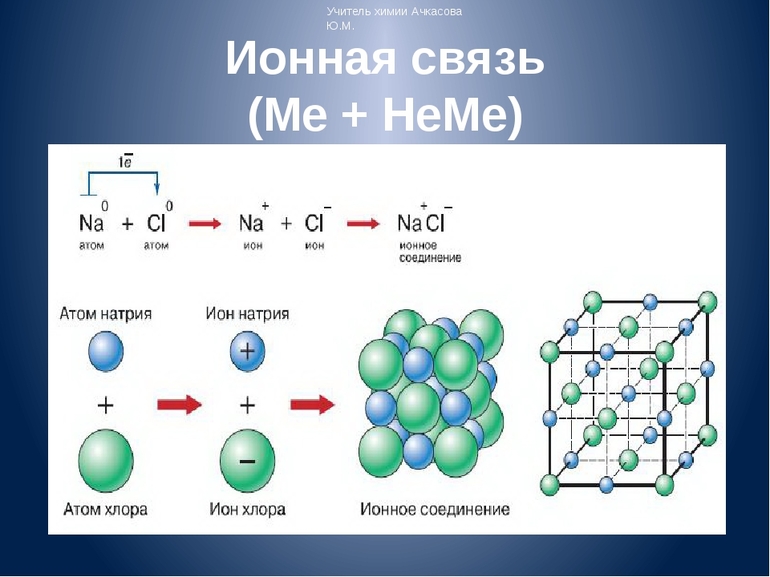
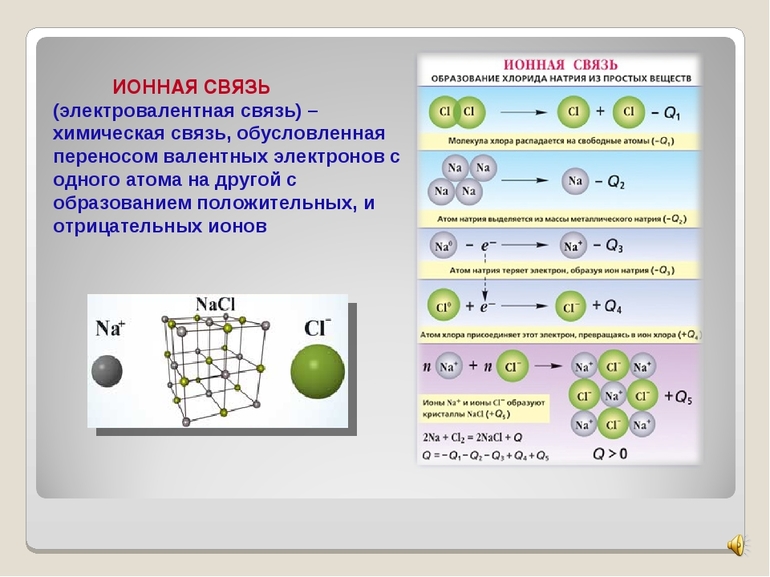
Первый пример — общее описание механизма возникновения. Для этого подойдет химическая реакция формирования такого соединения, как хлорид натрия или, проще говоря, поваренная соль. В процессе участвуют атомы щелочного металла (натрий Na) и галогена (хлор Cl). У первого на внешнем энергетическом уровне находится один электрон, а у второго — семь, то есть ему как раз нужен один электрон для завершения своего внешнего слоя.
Единственный валентный электрон атома металла имеет слабую связь с его ядром, поэтому Na легко отдает эту частицу. В результате у него освобождается место на внешнем энергетическом уровне. Таким образом оба участника соединения получили полностью заполненные внешние оболочки. После отдачи электрона атом металла превращается в катион натрия Na+, а принявший этот электрон атом неметалла преображается в хлорид-ион Cl-. Образовавшиеся ионы притягиваются друг к другу — возникает ионное соединение.
Схема процесса превращения атомов натрия и хлора в ионы соответствующих элементов и образование ими ионного соединения выглядит следующим образом (скобками отмечены электронные слои строения атома): Na 0 )2e)8e)1e + Cl 0 )2e)8e)7e = [Na+)2e)8e] + [Cl-)2e)8e)8e] = [Na+)2e)8e][Cl-)2e)8e)8e]. Этот же процесс в виде формулы выглядит так: Na 0 + Cl 0 = Na+ + Cl- = Na+Cl-
Таким образом, формула вещества с ионной связью (в приведенном примере это поваренная соль) имеет следующий вид: Na+Cl- (то есть один участник в ходе взаимодействия приобретает положительный заряд, а другой, наоборот, отрицательный). Ионные вещества всегда имеют сложный состав — они не состоят из одного элемента. Это соединение характерно для следующих веществ:
Они обладают кристаллическими решетками ионного типа.
Что касается элементов, то для примера ионной связи натрий — один из самых подходящих элементов периодической таблицы Менделеева. Это связано с его низкой электроотрицательностью и наличием на внешней оболочке единственного электрона. Второй пример формирования ионного соединения также будет с натрием. Рассматриваемое вещество — фторид натрия. Участники процесса — натрий Na и фтор F.
По наиболее важным для изучаемого процесса характеристикам фтор схож с хлором — у него высокая электроотрицательность и семь электронов на внешнем слое. Поэтому он также очень подходит для рассмотрения эталонной связи ионов.
Фторид натрия образуется в результате окислительно-восстановительной реакции между атомами натрия и фтора. Металл отдает свой внешний электрон неметаллу. Последняя внешняя орбиталь атома фтора заполняется, валентный слой натрия освобождается. Оба атома, превращаясь в ионы с разноименными зарядами, приобретают стабильную электронную конфигурацию. Затем между ними возникает электростатическое притяжение, в результате чего они образуют ионное соединение.
Особенности связи
Для соединений ионов характерна кристаллическая структура. Яркий пример типичной формы таких веществ — это поваренная соль NaCl.
Эти соединения очень прочные — настолько, что их крайне проблематично разрушить посредством тепловой энергии. Однако из-за довольно низкого радиуса ионного взаимодействия эти соединения получили такую незавидную характеристику, как ломкость. Что касается энергии самой связи, то она прямо пропорциональна кратности соединения, то есть числу общих электронных пар.
Соединения ионов отлично растворяются в полярных растворителях — воде, кислотах и прочих. Эта особенность обусловлена заряженностью частей молекулы. Помимо растворимости, ионные соединения обладают такими характеристиками:
Два последних характерных свойства ионной связи отличают ее от прочих видов химических соединений. Эти особенности обусловливают факт тяготения кристаллов ионных веществ к различным плотнейшим упаковкам соответствующих ионов.
Определение степени ионности связей, направления смещения электронной пары в молекуле вещества
Задача 228.
Энергия ионизации атомов фтора и хлора составляет соответственно 17,4 и 13,0 эВ, а энергия сродства к электрону 3,45 и 3,61 эВ. для какого из этих элементов более характерно образование ионных соединений? Указать знак заряда ионов галогенов в этих соединениях.
Решение:
Энергия ионизации – это энергия, которую необходимо затратить для удаления электрона из изолированного, свободного атома, находящегося в основном состоянии, на бесконечно большое расстояние.
Сродство к электрону – это энергия, которая выделяется в результате присоединения электрона электроотрицательным атомом и превращения его в анион.
Таким образом, фтор, обладая большей энергией ионизации, чем хлор, способен сильнее удерживать неспаренный электрон, т.е. проявляет в большей степени неметаллические свойства. Фтор обладает самой высокой электроотрицательностью из всех химических элементов, поэтому обладает более выраженной способностью к образованию ионных соединений, чем хлор.
Обладая меньшей энергией сродства к электрону фтор в большей степени, чем хлор, способен образовывать ионы.
Таким образом, для фтора более характерно образование ионных соединений, чем для хлора. Фтор и хлор образуют ионы знак заряда, которых -1.
Задача 229.
Указать тип химической связи в молекулах Н2, С12, НСI. Привести схему перекрывания электронных облаков.
Решение:
В молекулах Н2 и Cl2 наблюдается ковалентная неполярная связь, а в HCl – ковалентная полярная.
Ковалентная химическая связь образуется двумя электронами от двух разных атомов, причём электроны с противоположно направленными спинами. Эта электронная пара принадлежит одновременно двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Например:
Схемы перекрывания электронных облаков имеют вид:
а) Для Н2 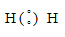
Общая электронная пара расположена на одинаковом расстоянии от центров обоих атомов водорода – связь ковалентная неполярная.
б) Для Cl2
Общая электронная пара расположена на одинаковом расстоянии от центров обоих атомов хлора – связь ковалентная неполярная.
в) Для HCl
Общая электронная пара атомов водорода и хлора смещена в сторону более электроотрицательного атома хлора – связь ковалентная полярная.
Во всех случаях перекрывание атомных орбиталей происходит на межъядерной оси, т.е. образуются 
В молекулах Н2 и Cl2 электронная пара расположена на одинаковом расстоянии от атомных ядер, потому что электроотрицательность атомов в молекулах простых веществ Н2 и Cl2 одинаковая, связь ковалентная неполярная. В молекуле HCl электронная пара смещена в сторону более электроотрицательного атома Cl (электроотрицательность Cl равна 2,9, а Н – 2,16), связь ковалентная полярная, образующаяся между разными атомами.
Задача: 230.
Пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей К — С1, Са — С1, Fе — С1, Gе — С1. Какая из связей характеризуется наибольшей степенью ионности?
Решение:
По данным таблицы «Относительная электроотрицательность элементов» вычисляем разность электроотрицательностей для связей:
Наибольшей разностью электроотрицательности характеризуется связь K—Cl. Таким образом, связь K—Cl характеризуется наибольшей ионностью, так как она более полярная. Диссоциация по связи K—Cl в водных растворах будет проходить легче, чем во всех других случаях, при этом образуются ионы:
Задача 231.
Какой характер имеют связи в молекулах NCl3, СS2, JCl5, NF3, OF2, ClF, СО2? Указать для каждой из них направление смещения общей электронной пары.
Решение:
а) При соединении атома азота с тремя атомами хлора образуется молекула NCl3, в которой каждый из трёх атомов хлора связан с атомом азота парой общих электронов (один электрон от атома хлора, другой – от атома азота). Схема молекулы NCl3 имеет вид:
Разность электроотрицательностей связи N—C равна 0,26 ( 
б) При соединении атома углерода с двумя атомами серы образуется молекула СS2, в которой каждый из двух атомов серы связан с атомом углерода двумя парами электронов (два электрона от атома серы и два других от атома углерода). Схема строения молекулы СS2 имеет вид:
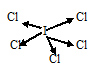
в) При соединении атома йода с пятью атомами хлора образуется молекула JCl5, в которой каждый из пяти атомов хлора связан с атомом йода парой общих электронов (один электрон от атома хлора, другой – от йода). Схема строения молекулы JCl5:
Разность электроотрицательностей связи J—Cl равна 0,62 (
(
г) При соединении атома азота с тремя атомами фтора образуется молекула NF3, в которой каждый из трёх атомов фтора связан с атомом азота парой общих электронов (один электрон от атома фтора, другой – от азота). Электронная схема строения молекулы NF3:
Разность электроотрицательностей связи N—F равна 1,04 (

д) При соединении атома кислорода с двумя атомами фтора образуется молекула OF2, в которой каждый из атомов фтора соединён с атомом кислорода парой общих электронов (один от атома фтора, другой – от кислорода). Электронная схема строения молекулы OF2:
Разность электроотрицательностей связи F—O равна 0,6 (

е) При соединении атома фтора с атомом хлора образуется молекула ClF, в которой атом фтора соединён с атомом хлора электронной парой за счёт одного электрона от атома фтора, другого – от атома хлора. Электронная схема строения молекулы ClF:
Разность электроотрицательностей связи F—Cl равна 1,3 (
ж) При соединении атома углерода с двумя атомами кислорода образуется молекула СО2, в которой каждый из двух атомов кислорода связан с атомом углерода двумя парами электронов (два электрона от атома кислорода, другие два – от углерода). Электронная схема строения молекулы СО2:
Разность электроотрицательностей связи С—О равна 0,5