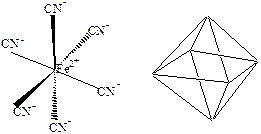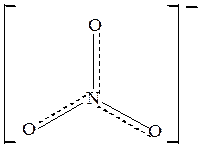Что такое строение молекул геометрическая конфигурация
Большая Энциклопедия Нефти и Газа
Геометрическая конфигурация молекул полностью определяется типом гибридизации орбиталей центрального атома только при условии, что все гибридные АО участвуют в образовании связей. Если же хотя бы на одной из них остается неподеленная электронная пара, то конфигурация, определяемая типом гибридизации, реализуется неполностью. [1]
Геометрическая конфигурация молекулы определяется электрическими силами взаимодействия между положительно заряженными ядрами и отрицательно заряженными электронами. [2]
Геометрическую конфигурацию молекул можно грубо предсказать на основании диаграмм Уолша. Дополнительный электрон в ВН2 должен занять орбиталь для которой ( рис. 72) при угле 90 имеется глубокий минимум. [3]
Какие геометрические конфигурации молекул это определяет. [4]
Понятие геометрической конфигурации молекулы лежит в основе современного учения о строении молекул и определяется равновесной конфигурацией пространственного расположения ядер атомов, образующих молекулу. Эта конфигурация не может быть рассчитана для сколько-нибудь сложной молекулы путем строгого решения соответствующей квантовомеханической задачи. Существует ряд приближенных моделей, методов и теорий, которые используются для систематического анализа накопленных экспериментальных данных по геометрическим конфигурациям молекул. В определенных пределах они часто позволяют не только дать разумное объяснение наблюдаемых конфигураций, но на основе установленных закономерностей и корреляций также правильно предсказывать геометрию еще не изученных молекул, что не раз подтверждалось опытом. [6]
Одинакова ли геометрическая конфигурация молекул BF3 и NF3: а) одинакова; б) различна. [7]
Одинакова ли геометрическая конфигурация молекул ВРз и NF3: а) одинакова; б) различна. [8]
В этом случае геометрическая конфигурация молекулы может определять, произойдет или не произойдет синхронный сдвиг связей. Но это не всегда так, поскольку в переходном состоянии, по-видимому, имеется возможность для значительного пространственного расширения диполярного характера, по крайней мере становится различным эффект растворителя. Конечно, перегруппировка облегчается при наличии в молекуле соответствующих заместителей. В этих случаях не происходит истинного разделения фрагментов. [14]
Гибридизация атомных орбиталей и геометрия молекул
Важной характеристикой молекулы, состоящей более чем из двух атомов, является ее геометрическая конфигурация. Она определяется взаимным расположением атомных орбиталей, участвующих в образовании химических связей.
(s, p, d), все связи равноценны. Для устранения этого противоречия Полинг и Слейтер предложили концепцию гибридизации
Основные положения концепции гибридизации:
1. Гибридные орбитали образуются из различных атомных орбиталей, не сильно отличающиеся по энергиям,
2. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации.
3. Гибридные орбитали одинаковы по форме электронного облака и по энергии.
4 По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков.
Следует отметить, что как физический процесс гибридизация орбиталей не существует. Метод гибридизации представляет собой удобную модель наглядного описания молекул.
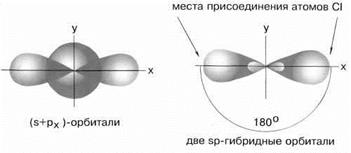
Sp- гибридизация
Рис.5 sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны, и обе связи имеют одинаковую длину.
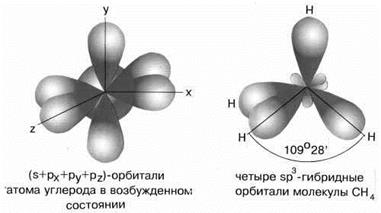
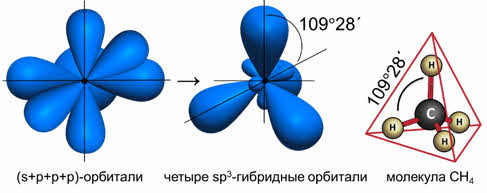
При взаимодействии аммиака с ионом водорода H + + ׃NH3 = NH4 + в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Рис 9sp 3 —гибридизация в молекуле воды
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
Представления о гибридизации дают возможность понять такие особенности строения молекул, которые не могут быть объяснены другим способом. Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в направлении образования связи с другими атомами. В результате области перекрывания гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи увеличивается.
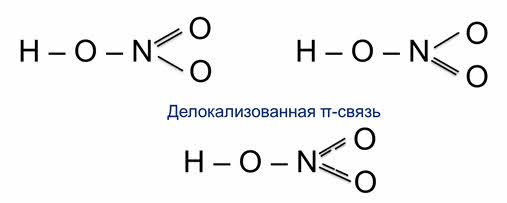
Делокализованная π-связь
По методу МВС электронная структура молекулы выглядит как набор различных валентных схем (метод локализованных пар). Но, как оказалось, нельзя объяснить экспериментальные данные о структуре многих молекул и ионов, оперируя только представлениями о локализованной связи. Исследования показывают, что всегда локализованными являются только σ-связи. При наличии π-связей может иметь место делокализация, при которой связующая электронная пара одновременно принадлежит более чем двум атомным ядрам. Например, экспериментально установлено,что молекула BF3 имеет плоскую треугольную форму(рис.6). Все три связи
Структурную формулу молекулы BF3 с учётом делокализации π- связи можно изобразить следующими образом (нелокализованную связь обозначена пунктиром):
Рис.11 Строение молекулы BF3
Нелокализованная π-связь обусловливает нецелочисленную кратность связи. В данном случае она равна 1 1 /3 поскольку между атомом бора и каждым из атомов фтора осуществляется одна σ–связь и 1 /3часть π-связи.
π-связи (изображены пунктирными линиями) равномерно распределяются между всеми атомами кислорода ( рис.12 )
Рис.13Структурные формулы SO4 2- и PO4 3- с учётом делокализации
Гибридизация атомных орбиталей. Геометрия молекул
Урок 10. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Гибридизация атомных орбиталей. Геометрия молекул»
В образовании ковалентных связей принимают участие как эс-, так и пэ-электроны, орбитали которых имеют различную форму и направленность в пространстве.
Связи, которые образуются между ними, являются равноценными и расположены симметрично.
Это явление объясняется на основе концепции гибридизации атомных валентных орбиталей. Согласно концепции, в образовании химической связи принимают участие гибридные орбитали, то есть это орбитали, усреднённые по форме и размерам, а, следовательно, и по энергии. Число гибридных орбиталей равно числу исходных.
Гибридные орбитали более вытянуты в пространстве, а это обеспечивает их более полное перекрывание с орбиталями соседних атомов.
Из-за своей симметрии гибридные орбитали не участвуют в образовании пи-связи, так как не могут обеспечить перекрывание между собой в двух областях пространства.
Основными условиями устойчивой гибридизации являются:
Первое, в гибридизации могут участвовать орбитали с близкими значениями энергий, то есть эс-, пэ-орбитали внешнего энергетического уровня и дэ-орбитали внешнего или предвнешнего уровня;
второе, гибридная атомная орбиталь должна более плотно перекрываться с орбиталями другого атома при образовании связи;
третье, в гибридизации участвуют орбитали с достаточно высокой электронной плотностью, которыми в большинстве случаев являются орбитали элементов начальных периодов;
четвёртое, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга.
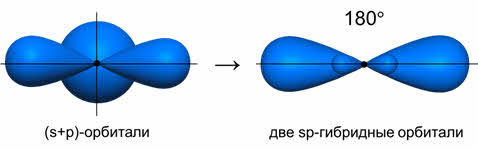
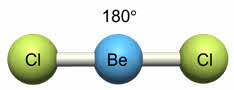
Ориентация гибридных орбиталей определяет геометрическую структуру молекулы. При комбинации одной эс- и одной пэ-орбитали возникает две эс-пэ-гибридные орбитали, расположенные симметрично под углом сто восемьдесят градусов.
Связи, образованные с участием электронов этих орбиталей, также располагаются под углом сто восемьдесят градусов.
Например, у атома бериллия эс-пэ-гибридизация орбиталей проявляется в молекуле хлорида бериллия, которая вследствие этого имеет линейную форму.
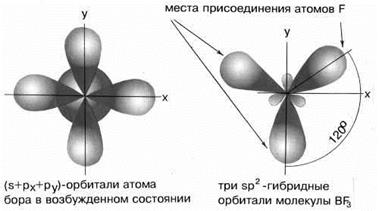
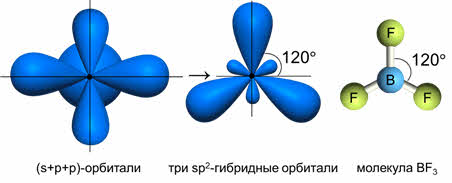
Комбинация трёх орбиталей (одной эс- и двух пэ-орбиталей) приводит к образованию трёх эс-пэ-два гибридных орбиталей, расположенных под углом сто двадцать градусов, как в молекуле фторида бора.
Комбинация четырёх орбиталей (одной эс- и трёх пэ-типа) приводит к эс-пэ-три гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырём вершинам тэтраэдра, то есть под углом сто девять градусов двадцать восемь минут, как в атоме углерода в молекуле метана.
Таким образом, если исходными орбиталями являются эс- и пэ-, то образуется две гибридные орбитали, возникает гибридизация эс-пэ типа, связи при этом расположены под углом сто восемьдесят градусов, в пространстве молекула имеет линейное строение.
Если исходные орбитали одна эс и две пэ-орбитали, то образуется три гибридных орбитали, тип гибридизации при этом эс-пэ-два, валентный угол равен сто двадцать градусов, а форма молекулы треугольная.
Если в гибридизации участвуют одна эс и три пэ-орбитали
то образуется четыре гибридных орбитали, возникает эс-пэ-три гибридизация, валентный угол при этом сто девять градусов двадцать восемь минут, а форма молекулы тэтраэдрическая.
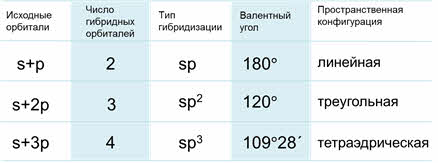
Основные характеристики разных типов гибридизации
Пространственное строение молекул или ионов зависит от типа гибридизации и взаимного расположения в пространстве гибридизированных орбиталей.
Часто в молекулах углы между связями отличаются от углов, соответствующих типу гибридизации. Почему же так происходит?
Во-первых, геометрическая конфигурация молекул определяется в основном пространственной направленностью сигма-связей. Устойчивому состоянию молекулы соответствует такое пространственное расположение электронных облаков валентного слоя, при котором их взаимное отталкивание минимально. Поэтому такие электронные пары стремятся максимально оттолкнуться друг от друга, располагаясь в пространстве под возможно большим углом.
Основными причинами отклонений углов связей от углов, соответствующих типу гибридизации являются:
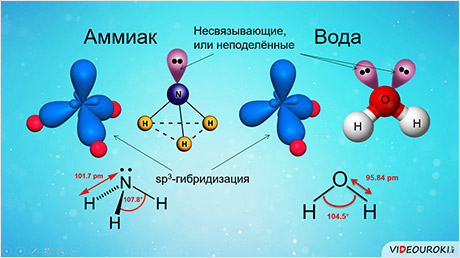
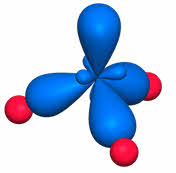
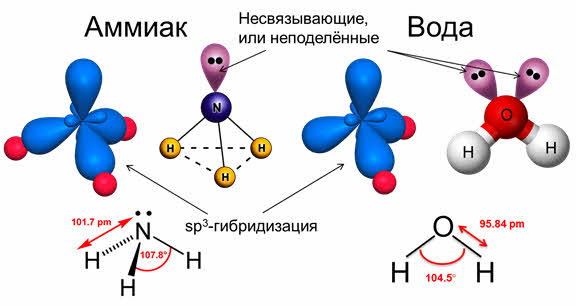
во-первых, не все гибридные орбитали участвуют в образовании связей, часть из них – несвязывающие. Электронные пары, находящиеся на этих орбиталях, называются несвязывающими, или неподелёнными. Так, в молекуле аммиака у атома азота одна пара электронов – не связывающая, в молекуле воды у атома кислорода две пары электронов являются несвязывающими.
Связывающая электронная пара локализована между атомами и поэтому занимает меньше пространства, чем электронное облако несвязывающей пары. Поэтому отталкивающее действие несвязывающей пары проявляется в большей мере, чем связывающей. В молекуле воды и аммиака у атомов азота, и кислорода один и тот же тип гибридизации атомных орбиталей – эс-пэ-три. Однако из-за наличия одной у азота и двух у кислорода несвязывающих пар электронов идеальный угол для этого типа гибридизации, равный сто девять градусов двадцать восемь минут, уменьшается до ста семи градусов у аммиака и ста четырёх с половиной у воды.
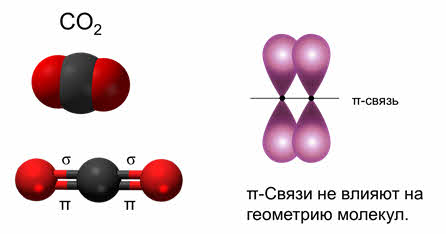
Второй причиной отклонений углов связей является наличие пи-связей, которые влияют на величину валентного угла, но это не сказывается на типе гибридизации и геометрии молекулы.
Предполагают, что электронные пары кратной связи занимают ту же область пространства, что и электронная пара простой связи. Суммарное электронное облако кратной связи занимает больший объём пространства, чем одинарной и поэтому обладает большим отталкивающим действием.
Так, в молекуле углекислого газа две ковалентные связи одинарные, так как являются сигма-связями, а две другие связи – это пи-связи. Пи-связи не влияют на геометрию молекул, поэтому в пространстве молекула углекислого газа имеет линейное строение, и здесь эс-пэ-тип гибридизации.
Виды геометрических конфигураций
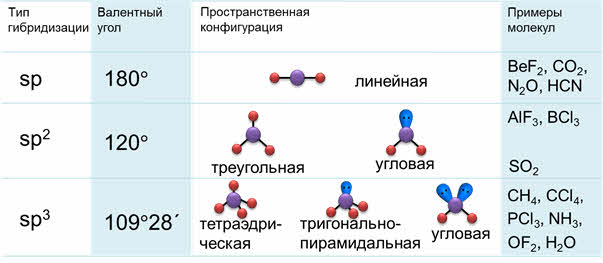
Молекулы с эс-пэ-гибридизацией имеют линейное строение. Валентный угол при этом сто восемьдесят градусов. К таким молекулам относятся фторид бериллия, молекула углекислого газа, оксида азота один, синильной кислоты.
В молекулах с эс-пэ-два-гибридизацией валентный угол сто двадцать градусов, форма молекулы может быть треугольной, как у фторида алюминия, хлорида бора, так и угловой, как у молекулы оксида серы четыре.
В молекулах с эс-пэ-три-гибридизацией валентный угол сто девять градусов двадцать восемь минут. Молекулы могут иметь тэтраэдрическое строение, как молекула метана, тэтрахлорметана, а также тригонально-пирамидальное строение, как у хлорида фосфора три, аммиака, или угловое строение, как у фторида кислорода и воды.
Иногда строение многих молекул нельзя изобразить такой одной графической формулой, потому что истинные свойства молекулы оказываются промежуточными между теми, которые отражаются в каждой отдельной схеме. Так, строение молекулы азотной кислоты можно изобразить двумя равнозначными графическими формулами. Так как в этой молекуле два атома кислорода равноценны, строение молекулы лучше отражает графическая формула с дэлокализованной пи-связью. Пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между одной и другой связями. Эта электронная пара принадлежит не двум, а трём атомам, поэтому образованная таким образом связь является трёхцентровой.
Таким образом, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга. Гибридные орбитали участвуют в образовании только сигма-связи.
Геометрия любой молекулы определяется пространственной направленностью сигма-связью. На пространственное строение молекулы оказывают влияние несвязывающие пары электронов, которые уменьшают углы связей между сигма-связями.
Химия. 11 класс
Конспект урока
Урок № 3. Пространственное строение молекул
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Дельта связь (δ) – связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками.
Двойная связь образуется при наложении π-связи на σ-связь.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Пи связь (π) – связь, образованная перекрыванием атомных орбиталей по обе стороны от линии, соединяющей ядра атомов (боковые перекрывания).
Сигма связь (σ) – связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
Тройная связь образуется при наложении двух π-связей на σ-связь.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Гибридизацией называют образование одинаковых по энергии и форме орбиталей атома в результате сложения различных по энергии и форме орбиталей при возбуждении этого атома. При этом орбитали разной симметрии смешиваются и переходят в гибридные атомные орбитали одинаковой формы и одинаковой усредненной энергии, что обеспечивает равноценность образуемых ими связей.
При смешении s и р-орбиталей образуется две sp-гибридных орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию. Такой тип гибридизации характерен для ацетилена, хлорида цинка, гидрида бериллия.
Форма гибридных атомных орбиталей отличается от формы исходных. В гибридной атомной орбитали электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с атомной орбиталью другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула – более устойчива.
Геометрическая конфигурация молекул полностью определяется типом гибридных орбиталей центрального атома только при условии, что все гибридные атомные орбитали участвуют в образовании связей. Если хотя бы на одной из них остается неподеленная электронная пара, то конфигурация, определяемая типом гибридизации, реализуется не полностью.
Таким образом, пространственная структура молекул зависит от типа гибридизации центрального атома и числа неподеленных пар. Образование p-связей стабилизирует состояние молекулы.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. При сгорании 4,00 г органического соединения образовалось 4,48 л углекислого газа (н.у.) и 2,88 г воды. Вещество обесцвечивает бромную воду и вступает в реакцию с раствором гидроксида бария при нагревании, один из продуктов имеет формулу: СxHyOz+…O2→x CO2+y/2 H2O. На основании данных условия задания:
1) проведите необходимые вычисления и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле.
Шаг 1. Определите количество вещества атомов углерода. Задание на ввод числа.
Шаг 2. Определите количество вещества атомов водорода. Задание на ввод числа.
Решение: n(Н) = 2n(Н2О) = 2m(H2O) / M(H2O) = 2×2,88г/18 г/моль = 0,32 моль
Шаг 3. Определите количество вещества атомов кислорода. Задание на ввод числа.
Решение: m(CxHyOz)= 0,20×12 + 0,32×1+ 16x = 4г, х = 0.08 моль
Шаг 4. Находим соотношение атомов углерода, водорода и кислорода. Определяем количество атомов углерода.
Задание на ввод числа.
Шаг 5. Находим соотношение атомов углерода, водорода и кислорода. Определяем количество атомов водорода.
Задание на ввод числа.
Шаг 6. Находим соотношение атомов углерода, водорода и кислорода. Определяем количество атомов углерода.
Задание на ввод числа.
Шаг 7. Составляем молекулярную формулу искомого вещества.
Геометрия молекул
Геометрия молекул
Российский университет дружбы народов, Москва
ВВедение
Определение пространственного расположения атомов в молекуле, то есть геометрии молекулы, представляет собой в настоящее время задачу, вполне разрешимую даже для достаточно сложной молекулы, путем решения соответствующей квантовохимической задачи.
Вместе с тем существуют приближенные подходы, которые могут быть использованы для анализа экспериментальных данных по геометрическим конфигурациям молекул.
К числу подобных подходов относятся:
— метод валентных связей
— метод трехцентровых связей
— метод отталкивания валентных электронных пар
метод валентных связей
Метод валентных связей наиболее известен и включает рассмотрение таких понятий как валентность, гибридизация атомных орбиталей, направленность ковалентных связей и т. д.
Согласно теории валентных связей химическая связь между двумя атомами А и В образуется с помощь общей пары электронов
А + В = А ¯ В ковалентная связь
А ¯ + В = А ¯ В донорно-акцепторная связь
Валентность характеризует способность атомов, образовывать химические связи, и равна числу химических связей образованных атомом. Согласно методу валентных связей валентность равна числу общих пар электронов, а в случае ковалентной связи валентность равна числу неспаренных электронов на внешнем уровне атомов в основном или возбужденных состояниях.
C 2s22p2 ¯ вал = II C=O
C* 2s12p3 вал = IV О=C=O
S 3s23p4 ¯ ¯ вал = II H-S-H
S* 3s23p33d1 ¯ вал = IV SO2
S** 3s13p33d2 вал = VI SO3
Гибридизация атомных орбиталей – это смешивание АО разных подуровней атома, электроны которых участвуют в образовании эквивалентных s-связей. Для определения типа гибридизации определяют число s-связей, образованных атомом.
 |
Расположение гибридных орбиталей
Три неспаренных электрона на гибридных орбиталях бора взаимодействуют с неспаренными р-электронами фтора с образованием трех ковалентных связей. В силу направленности ковалентных связей эти три связи располагаются под теми же углами 120о, что и гибридные орбитали, и молекула BF3 имеет плоское строение с углами 120о между связями.
Молекула СlF3. Атом хлора в основном состоянии имеет лишь один неспаренный электрон. Для объяснения существующей и равной трем валентности хлора предполагается переход этого атома в возбужденное состояние: Cl 3s23p5 ® Cl* 3s23p43d1, в котором имеются три неспаренных электрона. Поскольку в гибридизации участвуют АО, содержащие как по одному, так и по два электрона, то имеется пять dsp3-ГО, на которых находятся две неподеленные пары и три неспаренных электрона (рис.1.). Подобные гибридные орбитали имеют тригонально-бипирамидальное расположение. Из пяти возможных мест координации (двух аксиальных и трех экваториальных) более выгодными (с меньшим межлигандным отталкиванием) оказываются экваториальные положения. Именно два из них и занимаются неподеленными парами. А неспаренные электроны занимают оставшееся экваториальное положение и аксиальные положения. В силу направленности ковалентных связей расположение связей Cl – F аналогично расположению орбиталей с неспаренными электронами, а молекула ClF3 имеет Т-образное строение с углом между связями, близким к 90о.

Рис. 1. Геометрия молекулы ClF3 в методе валентных связей: расположение гибридных орбиталей; расположение связей и неподеленных пар; расположение связей.
Метод трехцентровых связей
Применение метода валентных связей к элементам VА – VIIIА групп периодической системы элементов требует возбуждения одного или нескольких электронов с орбитали р на орбиталь d. Энергия подобного возбуждения велика и, во всяком случае, больше энергии двух образующихся связей. Это означает, что такое возбуждение не может иметь место во время образования связи и что использование теории валентных связей для этих соединений не корректно. Так для р-элементов V – VIII групп периодической системы разница между энергиями ns—, np- и nd-орбиталями более 1000 кДж/моль. Это значит, что энергии ns-орбиталей малы, энергии nd—орбиталей велики, чтобы взаимодействовать с орбиталями других атомов. Поэтому только np—орбитали могут взаимодействовать с орбиталями других атомов. Однако число неспаренных np— электронов недостаточно для объяснения возможных валентностей и уменьшается к концу периода, в то время как высшая валентность увеличивается. Возникает вопрос, могут ли пары р-электронов образовывать связи? Положительный ответ на этот вопрос дает теория трехцентровых связей.
Рассмотрим трехатомную линейную молекулу MX2 с помощью метода МО. Атом М имеет р-орбиталь с двумя электронами. Каждый из двух атомов X имеет одну р-орбиталь, содержащую один электрон. Взаимодействие этих орбиталей приводит к системе из трех МО: s (связывающей), s0 (несвязывающей) и s* (антисвязывающей). Связывающие и антисвязывающие МО содержат вклады всех трех атомов, несвязывающие МО образованы АО только двух атомов лигандов (рис.2).
Рис. 2. Схема МО линейного трехцентрового фрагмента Х-М-Х.
Такая система устойчива, порядок связи равен 0,5(2-0) = 1 для трехцентровой связи, т. е. по 0,5 единиц на каждую двухцентровую связь. Подобная связь менее устойчива, чем двухцентровая ковалентная связь.
Видно, что перед образованием связи атом М имел два электрона, атомы Х имели по одному электрону. В образовавшейся системе АО атомов Х формируют целиком несвязывающую МО и участвуют в образовании связывающей МО, и на них находится существенно больше двух электронов. Таким образом, образование подобной трехцентровой связи сопровождается переносом электронной плотности с атома М на атом Х. Это может иметь место только при условии, если атомы Х будут существенно более электроотрицательными, чем атом М.
Можно сделать вывод. Электронная пара р-электронов способна к образованию связи с двумя электроотрицательными лигандами с образованием линейного трехцентрового фрагмента. Подобные связи называются трехцентровыми или гипервалентными I.
Квантовохимические расчеты показали, что в случае максимальной валентности р-элемента его s-электроны могут частично принимать участие в образовании связи и образовывать связи, называемые гипервалентные II и более прочные, чем в рассмотренном случае трехцентровых связей. Геометрическое расположение связей в этом случае определяется их взаимным отталкиванием.
Таким образом, в соединениях р-элементов могут быть три типа химических связей: ковалентные связи, трехцентровые связи (или гипервалентные I) и гипервалентные II связи.
Теория трехцентровых связей – это логическое продолжение теории валентных связей в случаях, когда возбуждения s®p или p®d маловероятны, а центральный атом имеет неподеленную пару р-электронов. В соединениях, образование которых не требует возбуждения электронов или для которых энергия подобного возбуждения мала, образуются только ковалентные связи и использование теории валентных связей оправдано и корректно.
Молекулы SF2, SF4, SF6.
Сера имеет два неспаренных р-электрона, неподеленную пару р-электронов и неподеленную пару s-электронов.
В молекуле SF2 обе образующиеся связи – ковалентные. В молекуле SF4 две связи – ковалентные и одна связь – трехцентровая, гипервалентная I. В молекуле SF6 валентность серы максимальна и все связи – гипервалентные II.
Молекула SF2 угловая из-за взаимодействия связывающих пар электронов с неподеленными парами электронов серы.
Молекула SF4 содержит линейный фрагмент F-S-F трехцентровой связи. Две ковалентные связи и неподеленная пара электронов серы лежат в плоскости перпендикулярной этому фрагменту с учетом их взаимного отталкивания (рис.3).
Молекула SF6 октаэдрическая, так как подобному расположению лигандов соответствует их минимальное отталкивание.
Атом хлора имеет один неспаренный электрон и две неподеленные пары р-электронов. Этот атом может образовать одну ковалентную и две трехцентровые связи.
В молекуле ClF имеется она ковалентная связь, в молекуле ClF3 – одна ковалентная и одна трехцентровая связи, а в молекуле ClF5 – одна ковалентная и две трехцентровые связи.
Поскольку каждой трехцентровой связи соответствует линейный фрагмент, то молекула ClF3 имеет Т-образную форму, молекула ClF5 – форму тетрагональной пирамиды (рис.3).
Атом ксенона не имеет неспаренных электронов и не может образовывать ковалентные связи. Однако ксенон имеет три неподеленные пары р-электронов и может образовывать до трех трехцентровых связей.
В молекуле XeF2 имеется одна гипервалентная I связь, в молекуле XeF4- две, а в молекуле XeF6- три таких же связи.
Вследствие взаимного расположения трехцентровых связей молекула XeF2 – линейная, молекула XeF4 – квадратная, а молекула XeF6 – октаэдрическая. Энергии образующихся связей невелики, они меньше, чем энергии ковалентных связей, однако молекулы устойчивы.
Рис. 3. Геометрия молекул SF4, SF6, ClF3, ClF5 в методе трехцентровых связей. Обозначения связей: ковалентные – черные толстые, гипервалентные I – серые, гипервалентные II – черные тонкие.
Теория трехцентровых связей объясняет, почему получены многочисленные соединения для ксенона, немногочисленные – для криптона, но соединения практически отсутствуют для аргона, неона и гелия (речь идет о нейтральных молекулах), почему большинство найденных соединений являются фторидами или оксидами. Согласно теории трехцентровых связей, необходимым условием образования подобных связей является большая разность электроотрицательностей центрального атома и лигандов. Подобная связь не образуется, если вместо ксенона брать менее электроположительный атом или вместо фтора или кислорода брать менее электроотрицательный атом.
метод отталкивания валентных электронных пар
Согласно этой теории молекулы или ионы, содержащие только простые связи, на валентном уровне центрального атома М могут иметь два типа электронных пар: связывающие пары связей М-Х и неподеленные пары электронов Е.
Эти связывающие и неподеленные пары электронов располагаются таким образом, чтобы их взаимное отталкивание было минимальным.
Это приводит к их определенному расположению в пространстве в зависимости от общего числа электронов (см. таблицу 1).
Учитывая общее число электронных пар атома М (n) и тип молекулы (например, МХ2Е – имеются две связывающие пары и одна неподеленная), можно установить геометрию молекул.
Таблица 1. Геометрия молекул в зависимости от числа электронных пар n и типа молекулы.
1. Неподеленная пара электронов имеет в области центрального атома больший объем, чем общая связывающая пара электронов. Отталкивание неподеленной пары электронов больше, чем отталкивание общей пары электронов.
2. Отталкивание двойной связи больше, чем отталкивание простой связи.
Это правило позволяет рассматривать геометрию молекул с кратными связями. Согласно этому правилу двойная связь занимает на периферии центрального атома одну позицию, имея отталкивание большее, чем отталкивание простых связей.
В молекуле этилена каждый атом углерода имеет четыре электрона. Два из них образуют двойную связь С=С, два других – две простых связи С-Н. Около углерода имеется три электронных облака, имеющих тригональное расположение. Поскольку отталкивание двойной связи больше, чем отталкивание простых связей, то угол между связями С-Н должен быть меньше 120о. Экспериментальное значение этого угла Н-С-Н равно 117,7о.
3. Отталкивание связывающей пары уменьшается с увеличением электроотрицательности лиганда.
С увеличением электроотрицательности лиганда электронная плотность связывающей общей пары электронов смещается в сторону лиганда и уменьшается в области центрального атома, поэтому отталкивание этой пары будет меньшим, чем отталкивание других общих пар электронов.
В случае молекулы NF3, имеющей ту же пирамидальную геометрию, что и молекула NH3, валентный угол должен быть меньше не только тетраэдрического угла 109,5о, из-за большего отталкивания неподеленных пар электронов по сравнению со связывающими парами, но и меньше значения 107,3о, наблюдаемого в молекуле NH3, поскольку отталкивание связи N-F меньше, чем отталкивание связи N-Н. Экспериментальное значение валентного угла в молекуле NF3 (102о) подтверждает предсказание теории.
Замещение атомов водорода на более электроотрицательные атомы в молекуле этилена СН2=СН2, угол НСН равен 117,7о, приводит к уменьшению валентного угла до 114о (угол ClCCl в молекуле CH2=CCl2) и 109о (угол FCF в молекуле CH2=CF2).
Молекула ClF3. Атом хлора имеет на последнем уровне семь электронов. Три из них образуют три общие пары простых связей Cl – F, а четыре другие образуют две неподеленные пары электронов. Тип молекулы MX3E2. Расположение пяти пар – тригонально-бипирамидальное. Положения этих пяти пар не эквивалентные. В аксиальном положении пара имеет три пары под углом 90о и одну под углом 180о. В экваториальном положении пара имеет две пары под углом 90о и две пары под углом 120о. С учетом большего отталкивания ближайших пар отталкивание минимально в экваториальных положениях. Именно эти выгодные положения и занимаются двумя неподеленными парами. Три связывающие пары занимают третье экваториальное положение и два аксиальных положения. Молекула ClF3 имеет Т-образную геометрию.
Из-за большего отталкивания неподеленных пар электронов по сравнению с общими парами электронов угол между аксиальной и экваториальной связями должен быть меньше 90о. Экспериментальное значение этого угла равно 87,5о (рис.4).
Молекула XeF4. Атом ксенона имеет на валентном уровне восемь электронов. Четыре из них образуют четыре связи, четыре других – две неподеленные пары электронов. Тип молекулы МХ4Е2. Расположение шести пар – октаэдрическое. Первая неподеленная пара может занимать любое из шести равноценных положений. Вторая неподеленная пара электронов должна занимать положение противоположное положению первой пары, чтобы минимизировать межэлектронное отталкивание. Молекула имеет квадратное расположение связей.
Молекула IOCl3. В молекуле IOCl3 атом иода имеет 7 электронов. Три из них образуют три простые связи, два – одну двойную связь и еще два – неподеленную пару. Расположение пяти электронных облаков – тригонально-бипирамидальное. Неподеленная пара и двойная связь, как имеющие наибольшее отталкивание, занимают два экваториальные положения. Три простые связи занимают оставшееся экваториальное положение и два аксиальных положения. Геометрия молекулы – искаженный тетраэдр.
Рис. 4. Геометрия молекул в методе Гиллеспи. Приведено расположение связей и неподеленных пар.
Заключение
Таким образом, для определения геометрии молекулы могут быть использованы различные методы. Так необычная Т-образная геометрия молекулы ClF3 может быть правильно предсказана с помощью метода валентных связей (предполагающего в данном случае возбуждение р-электрона на d-орбиталь), с помощью метода трехцентровых связей (указывающего на невозможность подобного возбуждения) и с помощью метода Гиллеспи (вообще не обсуждающего вопросы образования химической связи).
Очевидно, что эти методы не могут объяснить геометрию всех молекул, например, изменения геометрии в ряду: BeF2 – MgF2 – CaF2 (от линейной молекулы к нежесткой и к угловой). Однако, учитывая простоту этих моделей, следует скорее удивляться их успехам, нежели их неудачам.
1. Химическая связь. М.: Наука, 1973. 232 с.
3. Геометрия молекул. М.: Мир, 1975. 278 с.