Что такое строма яичника
Кисты и кистомы яичников
Многим женщинам хотя бы раз в жизни приходилось наблюдаться или лечиться по поводу кисты яичника. Но, к сожалению, как и сами женщины, так порой и врачи-гинекологи, наблюдающие их, недооценивают это заболевание. Бытует мнение, что если ничего не болит, то не нужно ничего лечить, а кисты яичников, как правило «не болят». Исключение могут составлять эндометриоидные кисты яичников, которые, проявляясь болевым синдромом, чаще всего заставляют пациенток пройти ультразвуковое исследование.
Некоторые женщины могут годами наблюдать за ростом кисты, забывая или не зная, к каким последствиям может привести их беспечность. Но ведь ультразвуковое исследование не является методом лечения и 100% диагностики!
Даже если не случится разрыва, нагноения, перекрута кисты или других острых ситуаций, связанных с этим заболеванием и требующих экстренного оперативного вмешательства, то чем дольше существует киста, тем выше риск её озлокачествления. К тому же не нужно забывать, что когда киста растет, она как бы «съедает» ткань яичника, а значит, чем позднее её удалят, тем меньше останется здоровой ткани яичника, способной к фолликулогенезу и выработке гормонов (что важно для женщин репродуктивного возраста).
В данном разделе Вы сможете ознакомиться со следующими данными:
Что же такое киста яичника?
Как правило, под термином «киста яичника» подразумевается образование в яичнике, имеющее капсулу и содержимое.
Жидкость в кисте может быть весьма разнообразной: как очень водянистой, так и плотной, вязкой. В яичниках развиваются опухоли самого различного происхождения и строения, в этом отношении яичники занимают среди других органов человека одно из первых мест.
Распространенность кист яичников
По данным различных авторов частота встречаемости опухолей яичников из всех гинекологических заболеваний составляет от 8 до 19%.
Иностранные исследователи утверждают, что более 80% женщин репродуктивного периода имели в анамнезе кисту яичника хотя бы один раз. При этом только у 1/4 из них наблюдались какие-либо клинические проявления.
У женщин в постменопаузе, частота встречаемости опухолевых образований яичника колеблется от 3 до 18 %, но именно в этом возрасте им нужно уделять особое внимание из-за высокого риска озлокачествления.
Виды опухолевых образований яичников
К опухолям яичников – кистомам относятся в основном:
Классификация Всемирной Организации Здравоохранения достаточно сложна и основана на определении гистологической структуры опухоли.
Из наиболее часто встречающихся можно привести следующие:
Следует особо отметить, что «эндометриоидная киста яичника» является следствием основного заболевания под названием «Эндометриоз». Это обязательно надо учитывать при назначении послеоперационного лечения.
К опухолевидным образованиям относятся в основном:
Отдельно нужно выделить такой термин как «функциональные кисты яичников» – это кисты, которые образуются в процессе нормального менструального цикла. К ним относятся фолликулярные кисты и кисты желтого тела. Как правило, эти кисты подвергаются обратному развитию. Однако, если эти образования продолжают расти и не исчезают в течение 3 месяцев, требуется оперативное вмешательство для подтверждения диагноза.
В случае обнаружения кисты при ультразвуковом исследовании никто до конца не может быть 100% уверен в диагнозе. Необходимо, прежде всего, наблюдение, но при длительном существовании кисты или при наличии данных о том, что эта киста не является функциональной, по международным стандартам требуется проведение оперативного вмешательства с последующим гистологическим исследование операционного материала.
Кисты яичников в постменопаузальном периоде
Данные эпидемиологических и клинических исследований позволили определить контингент женщин, у которых риск развития рак яичника существенно выше, чем в популяции.
В настоящее время, по мнению ряда иностранных авторов, не все кисты яичников в постменопаузе требуют оперативного лечения.
Существуют данные о том, что до 70 % кист в этом возрасте спонтанно разрешаются, а риск озлокачествления однокамерной кисты менее 10 см, при отсутствии пристеночных разрастаний и наличия тонкой капсулы по данным ультразвукового исследования органов малого таза составляет менее 1%.
Но до сих пор этот вопрос остается нерешенным. Самым важным является хотя бы примерное определение природы кисты до операции, поскольку и объем оперативного лечения, и дальнейшая тактика определяются доброкачественностью или злокачественностью кисты яичника.
Продолжаются исследования, посвященные оценке критериев риска озлокачествления кист яичников, которые могут быть использованы до операции с целью определения правильной хирургической тактики. Однако до настоящего времени золотым стандартом диагностики характера кисты яичника остается гистологическое исследование.
Только подробное послеоперационное исследование ткани капсулы и содержимого кисты яичника позволяет 100% поставить диагноз.
Одним из вариантов критериев предоперационной диагностики, является определение индекса малигнизации кисты яичника ( RMI 1 – Relative Malignancy Index), разработанного доктором Jacobs и коллегами в 1990 г., на основе бальной оценки ряда признаков:
Формула для расчета индекса малигнизации кист яичников выглядит следующим образом:
то есть индекс определяется путем умножения баллов выделенных показателей.
При цифре индекса более 200, можно подозревать злокачественность кисты яичника.
Чувствительность индекса малигинизации составляет 87%, специфичность – 97%, что обосновывает его использование в практике врача.
Врачи большинства стран используют индекс малигнизации не только для решения вопроса о тактике ведения пациентки с кистой яичника, но и для определения объема и доступа операции (лапароскопического или лапаротомического).
В последние годы появилась также возможность измерять показатели нового онкомаркера в сыворотке крови (HE4) и на основании возраста пациентки (до менопаузы или после), сочетания цифр НЕ4 и СА-125 уточнять доброкачественность кисты яичника. НЕ4 (4-й протеин придатков яичка человека) является одним из наиболее информативных онкомаркеров и должен быть включен в программу предоперационного обследования пациенток с кистами яичников.
Алгоритм ROMA (Risk of Ovarian Malignancy Algorithm) учитывает показатели 2-х онкомаркеров СА-125 и НЕ4, а также возрастной период женщины.
Для женщин в пременопаузе:
Кисты яичников во время беременности
Нередко кисту яичника впервые диагностируют во время беременности (по литературным данным, у 2% женщин). Но в большинстве случаев они являются функциональными кистами менее 6 см в диаметре, которые самостоятельно разрешаются во втором триместре.
Беременность – это особое состояние, и тактика ведения беременных с кистами яичников учитывает, с одной стороны, влияние лечение на состояние здоровья матери, а с другой, учитываются риски неблагоприятного влияния на плод.
Учеными разработаны стандарты, определяющие, когда необходимо оперативное лечение, а когда возможно обойтись только динамическим наблюдением.
В случае диагностирования кист яичников у беременной женщины, показаниями к оперативному лечению являются:
Предпочтительным является проведение операции лапароскопическим доступом, поскольку доказано, что лапароскопия является более безопасным и щадящим методом оперативного вмешательства в любом триместре беременности.
Безусловно, проведение даже этого высокотехнологичного метода диагностики и лечения во время беременности имеет свои особенности:
Таким образом, операция у беременных с кистами яичников является сложной и требует определенной подготовки не только хирурга, но и всего персонала, и должно проводиться в высококвалифицированных профильных учреждениях.
Осложнения кист яичников
Кисты яичников могут длительное время себя не проявлять. Однако, к сожалению, самым угрожающим может быть не только перерождение их в злокачественные опухоли.
К экстренным ситуациям могут привести и доброкачественные кисты яичников, в т.ч. и функциональные.
К осложнениям кист яичников относятся:
Разрыв кисты яичника – это острое гинекологическое заболевание, которое требует экстренной хирургической помощи.
В практике чаще всего встречается разрыв кисты желтого тела (так называемая «апоплексия яичника»), либо перфорация эндометриоидной кисты яичника. Такие осложнения сопровождаются выраженным болевым синдромом, а также кровотечением, которое может являться жизнеугрожающим.
Чем быстрее выполняется хирургическое вмешательство, тем лучше для пациентки. И в этом случае бдительными должны быть как врачи, так и сами больные. При определенных условиях и отсутствии геморрагического шока возможно проведение лапароскопии и сохранение яичника. Особенно важным это является у женщин репродуктивного возраста.
Перекрут кисты яичника или яичника – это также острое гинекологическое заболевание, и фактор времени между началом заболевания и оперативным вмешательством приобретает самую важную роль.
Это связано с тем, что при перекруте яичника или кисты яичника сразу нарушается кровоснабжение в яичнике: чем дольше яичник находится без соответствующего питания, тем меньше шансов его сохранить.
Чаще всего перекручиваются параовариальные кисты яичника, поскольку они растут на «ножке», которая при определенных условиях может перекрутиться. Возможен также перекрут яичника (или придатков матки) при наличии в нем дермоидной кисты. Яичники с эндометриоидными кистами перекручиваются довольно редко, поскольку, как правило, спаяны из-за эндометриоза с окружающими тканями и фиксированы. При дермоидных кистах яичника спаечный процесс, как правило, менее выражен, кисты подобной природы являются как бы «тяжелыми», поскольку их содержимое (зубы, хрящи, волосы) имеют определенный вес (выше, чем жидкость), что приводит к возникновению условий, способствующих перекруту.
Операции при перекруте кист яичников или яичников требуют определенного подхода. Их также можно выполнить лапароскопическим доступом.
Особенности проведения лапароскопии заключаются в следующем:
При перекруте параовариальных кист яичника их удаляют с последующим гистологическим исследованием.
Таким образом, кисты яичников являются крайне сложной для диагностики и лечения патологией. Тактика лечения определяется многими факторами (возрастом, данными дооперационной диагностики, гистологическим заключением). При возникновении осложнений показано экстренное вмешательство, чем раньше, тем лучше. Тщательное обследование пациенток в соответствии со стандартами, своевременное оперативное лечение в адекватном объеме, позволяют избежать осложнений, улучшить качество жизни, выполнить операцию лапароскопическим доступом и не допустить малигнизацию. При этом бдительными должны быть как пациентки с кистами яичников, так и наблюдающие их врачи-гинекологи.
УЗИ яичников
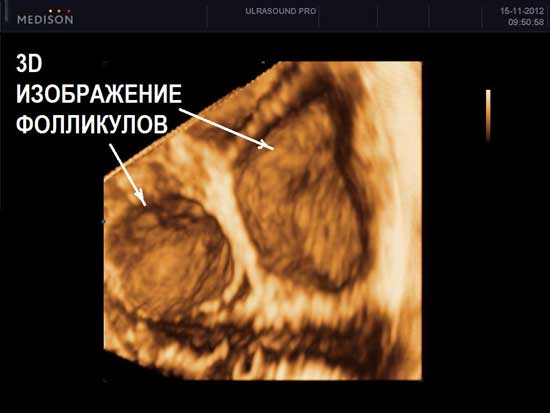
Яичники – парный орган репродуктивной женской системы. Располагаются яичники в малом тазу. Структурный аппарат яичникасостоит из фолликулов и стромы яичника. В норме яичники не имеют оболочки, и созревшийфолликулбез затруднения способен лопнуть во время овуляции и выпустить яйцеклетку. Выход яйцеклетки из фолликула и называется овуляция. Происходит овуляция под воздействием высоких уровней (пиков) лютеинизирующего гормона, вырабатываемого в головном мозге. Этот гормон способем вовремы выброситься в кровоток только при нормальной работе самих яичников, посылающих гормональные сигналы в головной мозг. Строма яичников – это соединительная ткань, содержащая кровеносные сосуды, по которым происходит доставка всех необходимых веществ к фолликулам яичников для их полноценной работы.
УЗИ яичников позволяет безопастно и достоверно изучить яичники, в первую очередь, их структуру. УЗИ яичников можно проводить через живот абдоминальным датчиком и с помощью трансвагинального УЗИ. Трансвагинальное УЗИ – наиболее достоверный и точный метод УЗИ яичников.
УЗИ яичников норма
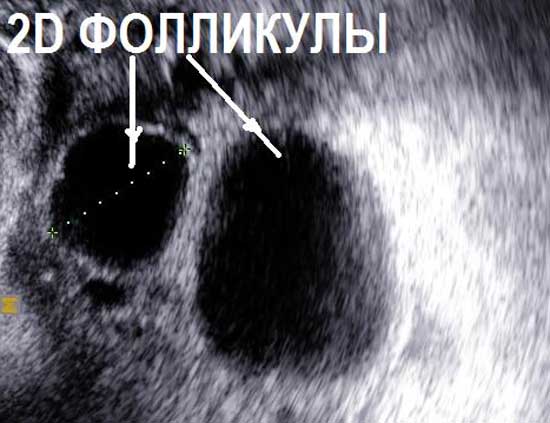
Нормальные размеры яичников при УЗИ яичников составляют до 12 мл 3 для каждого яичника. При нормальном УЗИ яичников в них можно насчитать до 12 фолликулов в каждом. Обнаружение при УЗИ яичников числа фолликулов менбше 5 в двух яичниках вместе – неблагоприятный признак, свидетельствующий чаще всего о преждевременном истощении яичников. При УЗИ яичников норма строма яинников содержит умеренное количество кровеносных сосудов, средней эхогенности, сравнимой по оттенку цвета с маткой. Повышение эхогенности стромы яичников, увеличение размеров, наличие в них множественных сосудов при УЗИ яичников может свидетельствовать о патологии (поликистоз яичников, воспаление яичников). При УЗИ яичников в норме яичники располагаются с двух сторон от матки, у правого и левого ребра матки. Яичники могут прилежать к матке или находится на небольшом расстоянии от матки – это норма УЗИ яичников. В подавляющем большинстве случаев, при УЗИ яичников, особенно трансвагинальном УЗИ, трудностей в обнаружении яичников нет.
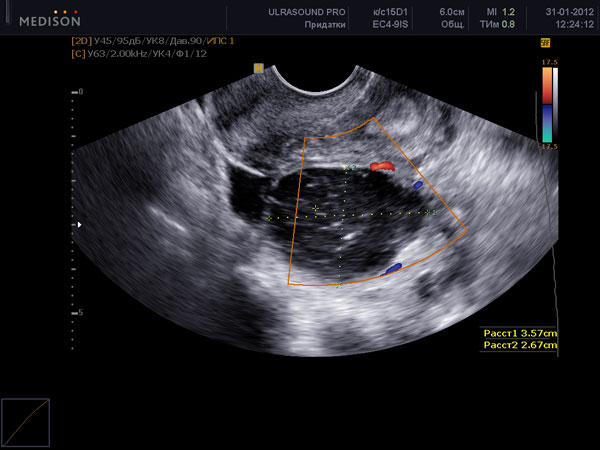
На УЗИ не виден яичник в случае его удаления при операциях, врожденном отсутсвии одного или двух яичников, резком уменьшении яичника вследствие преждевременного истощения или нормального климактерического периода, особенно при выраженном вздутии петель кишечника, резком изменении места расположения яичников в сзязи с выраженной спаечной болезнью органов малого таза. Если на УЗИ не виден яичник, и нет причин полагать, что он отсутствует, проводится УЗИ яичников после подготовки. Подготовка состоит в очищении кишечника с снятии вздутия (фортранс, очистительная клизма, эспумизан перед УЗИ яичников). Нормальные фолликулы в яичнике, которые доступны визуализации при проведении УЗИ яичников имеют размеры от 1 мм до 30 мм. Размеры фолликула более 30 мм при УЗИ яичников свидетельствуют об образовании фолликулярной (функциональной) кисты яичника. Обнаружение кисты яичника при УЗИ не составляет трудностей. Киста яичника на УЗИ выглядит как шар разной степени окрашивания и структуры.
По характеру структуры и оттенка цвета киста яичника при УЗИ может быть:
Проведение УЗИ яичников однократно не дает всех ответов на вопросы о функционировании яичников. В течении одного менструального цикла структура и внешний вид яичников при УЗИ меняется. Сразу после менструации при УЗИ яичников в норме видны фолликулы, размерами до 8 мм. Через 9-16 дней от первого дня менструации при УЗИ яичников наблюдается один крупный фолликул. Если его размер 10-17,9 мм – такой фолликул называется доминантным. В норме таких фолликулов при проведении УЗИ яичников может быть несколько или один. В предовуляторный период (день менструального цикла 11-18) обнаруживается при УЗИ яичников фолликул, размерами 18-30 мм. Такой фолликул называется преовулятрным. При нормальной гормональной регуляции в течении нескольких часов или суток происходит овуляция. Чаще всего, такой преовуляторный фолликул, обнаруживаемый при УЗИ яичников, один.
После овуляции при УЗИ яичников на месте овулировавшего фолликула можно увидетьжелтое тело. Суть его раборы – обеспечение прогестероном вторую фазу цикла. Прогестерон необходим для развития беременности на ранних сроках, пока нет полноценного формирования плаценты. Если не наступает беременность, желтое тело вырабатывает прогестерон для нормальной трансформации эндометрия и подготовки его к отторжению во время предстоящей менструации. При проведении Узи яичников после овуляции (с 12 до 28 дня цикла) можно оценить структуру желтого тела. При проведении анализа кровотока в желтом теле при УЗИ яичников с применением допплера, можно достоверно предполагать нормальность его функционирования. При неадекватной работе желтого тела при УЗИ яичников наблюдается отсутсвие выраженного низкорезистентного кровотока, желтое тело может быть кистозное, увядает раньше срока ( приблизительно на 22 день цикла). Это называется недостаточностью желтого тела. У женщин с недостаточностью желтого тела может наблюдаться короткие менструальные циклы (менее 26 дней), бесплодие, кровотечения во время менструации (в связи с гиперплазией эндометрия), мажущие выделения перед менструацией. При Узи яичников после овуляции приблизительно на 18 и на 23 дни цикла можно в динамике оценить, нормально ли работает желтое тело. Для точного анализа дополнительно исследуется прогестерон в крови.
Естественно, УЗИ яичников не проводится изолированно. Вместе с УЗИ яичников проводится УЗИ матки,более информативно УЗИ вагинальным датчиком. Такое УЗИ называетс трансвагинальное УЗИ.
Подготовка к УЗИ яичников
Специальной подготовки к УЗИ яичников не требуется, за исключением случаев, описанных выше, когда на УЗИ не видно яичников.
Гипертекоз яичников
Тека-клетки – это клетки стромы яичников, из которых также формируется оболочка фолликула. Они продуцируют андрогены, которые затем под влиянием фермента ароматазы преобразуются в эстрадиол.
В течение долгого времени в силу схожей клинической картины гипертекоз рассматривали как тяжелую форму синдрома поликистозных яичников. Однако сейчас эта патология считается самостоятельным заболеванием.
Симптомы стромального гипертекоза
Как мы писали выше, для стромального гипертекоза характерны многие симптомы, имеющие место при поликистозе яичников.
Очень высокий уровень тестостерона вследствие активной продукции андростендиона становится причиной гиперандрогении с выраженными признаки вирилизации. У пациенток выявляется гирсутизм (избыточный рост терминальных волос по мужскому типу: на груди, спине, лице, внутренней и задней поверхности бедер), андрогензависимая алопеция (облысение в лобно-теменной области с сохранением роста волос в затылочно-височной областях). У пациенток понижается тембр голоса. Характерно абдоминальное ожирение, когда жировая ткань локализуется в области талии, и фигура приобретает форму яблока (при характерной для женщин форме груши, когда отложение жиров происходит преимущественно в области бедер и ягодиц). У многих женщин высокий уровень андрогенов провоцирует изменения в дерме: увеличивается продукция и изменяется консистенция кожного сала. В связи с этим развивается угревая болезнь, жирная себорея кожи головы.
Снижение чувствительности клеток к инсулину становится причиной того, что в крови накапливается глюкоза, которая оказывается не способна проникнуть в клетки. В ответ на это поджелудочная железа начинает вырабатывать еще больше инсулина.
Выраженность стромального гипертекоза непосредственно связана с тем, насколько значительна инсулинорезистеность. Это связано с тем, что тека-клетки имеют рецепторы к инсулину, который способствует выработке ими андрогенов.
У пациенток с гипертекозом могут выявляться патологии молочной железы (мастопатия, доброкачественные и злокачественные опухоли) и рак тела матки.
Диагностика гипертекоза
Исследование позволяет выявить двусторонне увеличенные яичники. Необходимо дифференцировать гипертекоз и поликистоз в яичников. Во втором случае в яичниках присутствует большое число кистозно измененных фолликулов, а белочная оболочка значительно утолщена. При гипертекозе кист может не быть вовсе, а толщина капсулы обычно не превышает норму.
Анализ на определение уровня гонадотропинов (анализ на ЛГ, ФСГ), при котором выявляется повышение концентрации лютеинизирующего гормона.
Анализ на определение уровня андрогенов (тестостерон, ДГЭА-С, 17 ОН-прогестерон) в моче и плазме крови. Высокий уровень тестостерона в крови указывает на яичниковую природу патологии. ДГЭА-С, 17 ОН-прогестерон в моче повышены в незначительной степени.
Для подтверждения диагноза требуется проведение гистологического исследования, в ходе которого обнаруживаются увеличенные лютеинизированные клетки стромы яичников, в цитоплазме которых находятся липиды.
Лечение гипертекоза яичников
Возможно применение консервативных методов, включающих в себя противовоспалительную, микроволновую, дегидратационную и витаминотерапию, прием гормональных препаратов, оказывающих антиандрогенное воздействие.
Отсутствие эффекта является показанием для проведения хирургического лечения, объем которого определяется лечащим врачом в индивидуальном порядке с учетом возраста и репродуктивных планов пациентки.
Если у Вас возникли какие-либо вопросы, связанные с диагностикой и лечением гипертекоза, вы можете задать их врачам Нова Клиник.
Для того чтобы избежать опасных осложнений, очень важно своевременно диагностировать патологию и пройти курс лечения. Записаться на прием к врачу можно по телефону, указанному на сайте, или воспользовавшись кнопкой записи.
Стромальные опухоли яичников
— Рак (карцинома) развивается из эпителия. Этот вид опухолей составляет 85-90% всех злокачественных новообразований яичника. Рак яичников чаще развивается у женщин старше 50 лет.
— Герминоклеточные опухоли происходят из эмбриональных предшественников половых клеток. У взрослых эти новообразования встречаются редко.
— Стромальные опухоли яичников происходят из клеток стромы («поддерживающих» клеток яичника). Эти клетки вырабатывают половые гормоны – эстроген, прогестерон и андрогены. Стромальные опухоли обычно производят избыточное количество этих гормонов.
— Гранулёзоклеточная опухоль – самая частая (90%) из стромальных опухолей яичников. Большинство гранулёзоклеточных опухолей возникает в репродуктивном возрасте. Выделяют гранулёзоклеточную опухоль взрослого типа, чаще эта опухоль возникает у женщин в период менопаузы. Второй тип – ювенильная гранулёзоклеточная опухоль, встречается у детей и подростков.
— Опухоли из клеток Сертоли (также известные как андробластомы, опухоли Сертоли-Лейдига) могут состоять только из клеток Сертоли или из клеток Сертоли и клеток Лейдига. Первые чаще выявляются у молодых женщин, вторые у подростков, причём эти опухоли продуцируют большое количество мужских половых гормонов (андрогенов), что приводит к огрубению голоса и избыточному оволосению.
— Опухоли из стромы полового тяжа с аннулярными трубочками очень редки. Эта группа представляет собой отдельный вид опухолей, подразделяющийся на два подтипа – один из них ассоциирован с синдромом Пейтца-Егерса, такие опухоли, как правило, отличаются доброкачественным поведением и обнаруживаются в обоих яичниках. Второй подтип не связан с синдромом Пейтца-Егерса, а опухоли обычно имеют более крупный размер и чаще являются злокачественными.
— Стероидноклеточные опухоли очень редки, составляют менее 0,1% от всех опухолей яичников. Их подразделяют на 3 типа в зависимости от гистологического строения : доброкачественные стромальная лютеома и опухоль из клеток Лейдига, злокачественная неспецифицированная стероидноклеточная опухоль.
Симптомы стромальных опухолей яичников могут быть такими же, как и при остальных новообразованиях этой локализации: аномальные маточные кровотечения, пальпируемое образование в брюшной полости, частое мочеиспускание, запоры, изменение аппетита, тошнота, изжога, слабость, чувство распирания в животе, боль в ногах, спине, тазу или животе, болезненность при половом акте.
Кроме того, признаками, характерными именно для стромальных опухолей яичников, являются 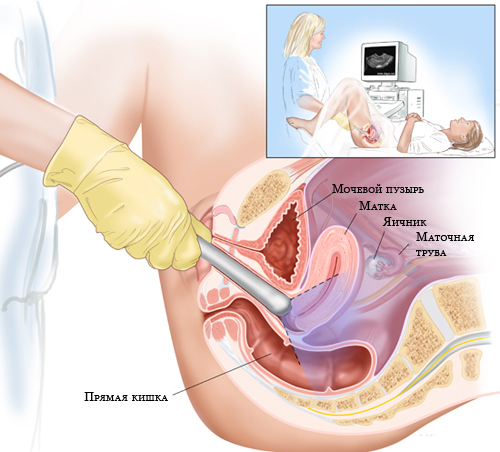
Обследование при стромальных опухолях яичника аналогично таковому при раке яичника.
Стромальный текоматоз яичников
Полный текст:
Аннотация
В 1942 г. S. Geist и J. Geines первыми опубликовали необычные результаты гистологического исследования овариальной ткани больных с синдромом Штейна—Левенталя. Ими были обнаружены очаги «лютеинизированных» текальных клеток, аналогичные клеткам theca interna folliculi, разбросанные по овариальной «строме” вне связи с фолликулами. На следующий год L. Fraenkel в своей работе назвал данные гистопатологические изменения гипертекозом яичников. В 1949 г. A. Culiner и S. Shipel использовали термин «синдром гипертекоза» для обозначения состояний, при которых очаги «текоматоза», состоящие из 10—30—60 отдельных гипертрофированных и лютеинизированных текальных клеток в овариальной «строме», сочетались с клинической картиной дефеминизации и вирилизации. В последующие годы из-за отсутствия единой терминологии в литературе использовались такие синонимы, как гипертекоз, кортикальная стромальная гиперплазия, стромальная пролиферация, стромальный текоз, текоматоз. R. Feinberg предложил разделить гипертекоз на 3 группы, положив в основу классификации преобладание кистозных фолликулов и утолщенной белочной оболочки (смешанный текоз) с повышенной пролиферацией собственно клеток межуточной ткани или без нее (внутренний текоз). Наличие «стромальной” пролиферации при отсутствии явлений кистозной атрезии фолликулов он определил термином «стромальный текоз» (текоматоз)». И. В. Голубева впервые в нашей стране обратила внимание на клинические и гормональные особенности стромального текоматоза (СТ), который ранее рассматривался в рамках синдрома поликистозных яичников, а через 3 года М. Э. Бронштейн доказала, что это самостоятельная морфологическая форма и дала определение понятия СТ. Под СТ яичников понимают гиперплазию межуточной ткани яичников и появление в ней групп гипертрофированных эпителиоидных клеток, формирующих очаги различного размера вне всякой связи с фолликулами. Предметом настоящего обзора является рассмотрение клинической и морфологической картины данного заболевания, особенностей гормонального гомеостаза, современных гипотез патогенетических механизмов его развития, а также возможных вариантов лечения.
Ключевые слова
Для цитирования:
Мальцева М.Ф., Пищулин А.А., Бронштейн М.Э. Стромальный текоматоз яичников. Проблемы Эндокринологии. 1996;42(3):40-45. https://doi.org/10.14341/probl12046
For citation:
Maltseva M.F., Pishchulin A.A., Bronstein M.E. Stromal ovarian tecomatosis. Problems of Endocrinology. 1996;42(3):40-45. (In Russ.) https://doi.org/10.14341/probl12046
В 1942 г. S. Geist и J. Geines [21] первыми опубликовали необычные результаты гистологического исследования овариальной ткани больных с синдромом Штейна—Левенталя. Ими были обнаружены очаги «лютеинизированных» текальных клеток, аналогичные клеткам theca interna folliculi, разбросанные по овариальной «строме” вне связи с фолликулами. На следующий год L. Fraenkel [20] в своей работе назвал данные гистопатологические изменения гипертекозом яичников. В 1949 г. A. Culiner и S. Shipel [15] использовали термин «синдром гипертекоза» для обозначения состояний, при которых очаги «текоматоза», состоящие из 10—30—60 отдельных гипертрофированных и лютеинизированных текальных клеток в овариальной «строме», сочетались с клинической картиной дефеминизации и вирилизации.
В последующие годы из-за отсутствия единой терминологии в литературе использовались такие синонимы, как гипер- текоз, кортикальная стромальная гиперплазия, стромальная пролиферация, стромальный текоз, текоматоз. R. Feinberg [19] предложил разделить гипертекоз на 3 группы, положив в основу классификации преобладание кистозных фолликулов и утолщенной белочной оболочки (смешанный текоз) с повышенной пролиферацией собственно клеток межуточной ткани или без нее (внутренний текоз). Наличие «стромальной” пролиферации при отсутствии явлений кистозной атрезии фолликулов он определил термином «стромальный текоз» (текоматоз)».
И. В. Голубева впервые в нашей стране обратила внимание на клинические и гормональные особенности стромального текоматоза (СТ), который ранее рассматривался в рамках синдрома поликистозных яичников [5], а через 3 года М. Э. Бронштейн доказала, что это самостоятельная морфологическая форма и дала определение понятия СТ [2—4, 6]. Под СТ яичников понимают гиперплазию межуточной ткани яичников и появление в ней групп гипертрофированных эпителиоидных клеток, формирующих очаги различного размера вне всякой связи с фолликулами.
Предметом настоящего обзора является рассмотрение клинической и морфологической картины данного заболевания, особенностей гормонального гомеостаза, современных гипотез патогенетических механизмов его развития, а также возможных вариантов лечения.
Рис. 1. Внешний вид больной с СТ яичников.
Заболевание, сопровождающееся СТ яичников, может развиваться у женщин как в репродуктивном возрасте, так и в пре- и постменопаузе.
Принято считать, что частота заболевания ничтожно мала. Однако проведенные за последние 20 лет исследования свидетельствуют о необходимости пересмотра отношения специалистов к месту, которое занимает СТ в общей структуре гине- коэндокринологических заболеваний [II, 16, 33].
В работе В. Dennefors и соавт. [16] СТ был выявлен у 47% обследованных женщин 53—78 лет.
Клиническая картина заболевания, сопровождающегося СТ, так же, как и при синдроме поликистозных яичников, отличается значительной вариабельностью [34].
Однако, как указывают L. Karp и соавт. [25], обычно СТ клинически напоминает тяжелый вариант течения синдрома Штейна—Левенталя: массивное ожирение, выраженный гирсутизм и вирилизация (рис. 1).
По свидетельству многих авторов, вирильный синдром является наиболее типичным признаком СТ, причем нередко он достигает крайней степени своего развития, напоминая таковой при вирилизирующих опухолях яичников [18, 20, 34].
Отмечается избыточный рост волос на лице, верхней губе, сосках, по белой линии живота, наблюдается усиление роста волос на руках и ногах и появление мужского типа оволосения на лобке. Гирсутизм и гипертрихоз могут сочетаться с такими признаками дефеминизации, как гипертрофия клитора [26, 33, 34], понижение тембра голоса [25], выпадение волос в лобной и височной областях [17, 26, 31, 34], увеличение мышечной массы в плечевом поясе [17], упорное течение acne vulgaris [17, 18, 31].
Помимо вирильного синдрома, при СТ часто наблюдается нарушение менструального цикла по типу олигодисменореи [17, 18, 34], которая затем может перейти во вторичную аменорею. Редко встречается первичная аменорея [22]. Следствием аменореи может стать первичное или чаще вторичное бесплодие.
Интересное наблюдение представили S. Braithwaite и соавт. [12], описавшие СТ у женщины 53 лет. У нее имелись «акро- мегалоидные черты лица», снижение тембра голоса, повышение либидо. Избыточный рост волос отмечался с 23 лет, причем в последние 10 лет больная была вынуждена брить бороду. Масса тела больной составляла 117,8 кг. При гинекологическом осмотре длина клитора была равна 2 см. Но, несмотря на столь яркую клиническую картину и длительный анамнез заболевания, у пациентки было 12 беременностей, 9 из которых закончились родами.
У больных с СТ часто наблюдаются ожирение [9, 33, 35], артериальная гипертензия [24, 35], черный акантоз [22], нарушение толерантности к глюкозе или сахарный диабет [20, 22, 24].
По данным Н. Sasano и соавт. [33], из 19 пациенток с теко- матозом (диагноз подтвержден при морфологическом исследовании яичников) в 33% случаев было выявлено ожирение, в 27% — артериальная гипертензия и в 20% — сахарный диабет. Необходимо отметить, что в исследуемую группу вошли больные в возрасте 35—55 лет (12 человек) и 56—70 лет (6). При этом вирилизация была обнаружена лишь у 1 пациентки, тогда как у 15 из 17 обследованных имелась патология ткани эндометрия. У 3 женщин была простая гиперплазия эндометрия, у 3 — смешанная гиперплазия, у 2 диагностирован полип эндометрия и, наконец, у 7 обнаружена высокодифференцированная аденокарцинома. Приведенные данные свидетельствуют о том, что развитие СТ в перименопаузальном периоде жизни женщины часто приводит к возникновению гиперпластических процессов в эндометрии вплоть до высокодифференцированной аденокарциномы. Частота развития гиперплазии варьирует от 20 до 50% [17, 32, 33], а частота возникновения рака — от 1 до 25%. Именно поэтому больных с СТ необ-
Рис. 2. Очаги СТ в межуточной ткани коркового слоя яичников.
Окраска гематоксилином и эозином. Ув. 240.
холимо относить к группе высокого риска в отношении рака эндометрия.
Гиперпластические процессы, развивающиеся на фоне СТ, могут иметь место не только в эндометрии, но и в железистой ткани молочных желез. При этом сочетанная гиперплазия матки и молочных желез наблюдается примерно у 50% больных с дисфункциональными маточными кровотечениями и у 30!% больных с олигоменореей [12]. Важно иметь в виду, что в некоторых случаях вирилизация у пациенток старше 35 лет менее выражена, чем у более молодых, или вообще не проявляется, а основными их жалобами являются периодические кровянистые выделения из половых путей, иногда переходящие в кровотечение, боли внизу живота, а также уплотнения и болезненность в области молочных желез.
Таким образом, наиболее частыми клиническими проявлениями СТ являются гирсутизм, вирилизация, ожирение, артериальная гипертензия, нарушение толерантности к глюкозе или сахарный диабет, acantosis nigricans. Заболеванию также часто сопутствуют гиперпластические процессы в эндометрии вплоть до возникновения высокодифференцированной аденокарциномы.
Разнообразие и выраженность клинических проявлений не позволяют подобрать оптимальную комбинацию признаков, которые смогли бы лечь в основу строгого клинического определения заболевания, поэтому главным критерием в установлении диагноза является характер морфологических изменений в яичниках.
Как уже было показано, у больных с СТ яичников могут наблюдаться регулярные менструальные циклы, спонтанные овуляции, а также возможно наступление беременности и родов. Однако по мере прогрессирования заболевания в яичниках возникают выраженные и порой необратимые патоморфологические изменения, которые сводятся к следующему.
Макроскопически яичники при СТ могут быть нормальных размеров или увеличены [1, 7, 10]. Поверхность их гладкая или неровная, бугристая из-за выпячивания кистозно-измененных фолликулов, серовато-белого или перламутрового цвета [1, 7, 8, 30]. На разрезе белочная оболочка обычно утолщена [1, 34], под ней располагается разное количество чаще всего мелких кистозных фолликулов. Кортикальный слой резко утолщен, белесоватого цвета, в наиболее глубоких частях желтоватый.
В кортикальном слое обнаруживаются многочисленные примордиальные фолликулы и единичные фолликулы на разных стадиях развития. Имеется много атрезированных фолликулов. Желтые тела, как правило, отсутствуют. Вследствие усиленной пролиферации клеток межуточной («стромальной») ткани возникает гиперплазия и гипертрофия яичника, которая может быть узелковой и диффузной (рис. 2).
Наиболее часто встречается диффузная «стромальная» гиперплазия, которая сопровождается равномерным утолщением всего коркового слоя яичников, иногда распространяясь и на мозговое вещество [1, 2 ].
Эпителиоидные «текаклетки» разбросаны поодиночке или гнездами, преимущественно вокруг мелких кровеносных сосудов, образуя очаги текоматоза различной формы и величины.
По форме эпителиоидные клетки округло-полигональные, как и клетки theca interna folliculi, а по размеру нередко превосходят последние. Цитоплазма их пенистая, вакуолизированная, ядра большие, пузыревидные, хотя могут быть маленькими, пикнотизированными, оттесненными к периферии клетки.В первом случае ядра занимают центральное положение в клетке. Клеточные границы полигональных эпителиоидных клеток четко контурированы. Вакуолизация цитоплазмы этих клеток обусловлена растворением при гистологической обработке овариальной ткани липидов, накопленных в цитоплазме. Липиды в основном представлены холестерином и его эфирами. Иногда в таких яичниках отмечается накопление липидов и в некоторых веретеновидных клетках межуточной ткани. Эпителиоидные клетки, образующие очаги текоматоза, обнаруживаются не только в очагах, узлах кортикальной «стромальной» гиперплазии, но и среди веретеновидных клеточных элементов с палочковидными ядрами [1 ].
По данным гистохимических исследований, этим клеткам присуща высокая функциональная активность [3]. Она тем выше, чем меньше липидов, особенно связанного холестерина, содержится в этих клетках. Об их высокой функциональной активности можно судить по активности ферментов, причастных к стероидогенезу: 3-р-с^к зой, 10-оксидазой и С-10,19-лиазами (рис. 4). Доказано, что ароматизация является ФСГ-зависимым процессом, поэтому ее активность определяется количеством ФСГ-рецепторов на клетках гранулезы. Образование этих рецепторов происходит в ответ на определенный уровень гипофизарной ФСГ-стимуля- ции, а также зависит от содержания эстрогенов и андрогенов в фолликуле. Являясь субстратом для ФСГ-зависимой ароматизации, андрогены в низкой концентрации могут повышать ароматазную активность. При повышенном содержании андрогенов клетки гранулезы способствуют конверсии андростендиона в более активные андрогены, которые не могут снова конвертироваться в эстрогены, что также является ингибирующим фактором ароматизации.
Таким образом, синтез эстрогенов происходит в 2 этапа: вначале в малых зреющих фолликулах клеток theca folliculi interna, не достигших 6 мм в диаметре, стероидогенез идет до уровня образования андростендиона и Т, а затем в клетках гранулезы происходит их конверсия в эстрадиол и эстрон.
СТ — заболевание, при котором по неизвестным причинам происходит гиперплазия межуточной ткани яичников с появлением в ней групп эпителиоидных гипертрофированных клеток, формирующих очаги текоматоза вне связи с фолликулами.
Вышеописанные текоматозные очаги обладают высокой ан- дрогенпродуцирующей активностью, что и определяет кли- ническую картину заболевания.
Применение современных радиоиммунных методов определения концентрации гормонов в сыворотке крови, полученной путем селективной катетеризации яичниковых, надпочечниковых и периферических вен, дало реальную возможность оценить гормональный гомеостаз у больных СТ.
Уровень ДГАС у обеих пациенток находился в пределах нормы, тогда как уровни Т (норма 15—60 нг/дл) и ДГТ (норма 10—30 нг/дл) были повышены до 90—130 и 40—50 нг/дл соответственно. Также были повышены уровни 17-гидроксипроге- стерона (17-ОН-П) и П, а содержание 17-а-гидроксипрегне- нолона и прегненолона было в пределах нормы.
I Овариально-периферический венозный градиент был повы
шен для 17-ОН-П, Т и ДГТ.
Полученные результаты исследования свидетельствовали о значительном повышении синтеза андрогенов, преимущественно по Д-4 метоболическому пути.
В работе J. Aiman и соавт. [8] у 6 женщин с текоматозом был измерен средний уровень продукции Т, который оказался равным 2,1 мг/день. Эта цифра в 8 раз выше показателя для нормально овулирующих женщин репродуктивного возраста и в 2 раза выше в сравнении с уровнем продукции Т при синдроме поликистозных яичников.
Овариально-периферический венозный градиент был значительно повышен для прегненолона, 17-ОН-прегненоло- на, 17-ОН-П, П, ДГАС, андростендиона, Т, эстрона и эстрадиола, что указывало на активацию продукции Т и его предшественников как по Д-4, так и по Д-5 метаболическим путям.
Самый высокий градиент концентрации стероидов отмечался у андростендиона, уровень которого превысил нормальные показатели в 15 раз. Содержание Т и ДГАС было в 6—7 раз выше нормы, что косвенно указывало на большую активацию Д-4 пути синтеза стероидных гормонов. Градиент концентрации для кортизола был минимален.
Аналогичные результаты были получены М. Nagamani и соавт. [30]. Авторы также отметили высокий овариально-пери-
Рис. 4. Схема двухклеточного механизма взаимодействия клеток теки и гранулезы с участием ароматазной ферментной системы [36].
Т — тестостерон; А — андростендион; Р-ЛГ — рецептор к лютеинизирующему гормону (ЛГ); Р-ФСГ — рецептор к фолликулостимулирующему гормону (ФСГ); Е — эстерон; Е2 — эстрадиол.
ферический венозный градиент для ДГТ, указывающий на активацию 5-редуктазной активности.
Повышению синтеза андрогенов у больных СТ обычно сопутствует гиперэстрогения [33].
Основным циркулирующим эстрогеном в крови у женщин в постменопаузе является эстрон. Он образуется путем периферической ароматизации из андростендиона, синтезируемого корой надпочечников и клетками стромы яичников. Усиление процесса периферической ароматизации чаще наблюдается у женщин с избыточной массой тела, так как жировая ткань, с одной стороны, служит резервуаром стероидных гормонов, а с другой — является местом активации процесса ароматизации и 17-а-гидроксистероиддегидрогенизации [28].
В литературе обычно указывается повышенное (реже нормальное) содержание эстрона при СТ яичников с непременно повышенным соотношением эстрона с эстрадиолом [8, 35, 37].
Хроническая гиперэстрогения лежит в основе развития гиперпластических процессов в эндометрии, часто сочетающихся с СТ.
Е. Novak и соавт. [32] с помощью гистохимического анализа показали, что окислительная ферментативная активность яичников у женщин с патологией эндометрия в 2 раза выше, чем у пациенток без таковой. Однако другие авторы [28, 37] не смогли обнаружить значительных различий на гистопатологическом уровне в яичниках женщин с патологией эндометрия или без нее.
Что касается синтеза гонадотропных гормонов, то тут необходимо отметить, что при СТ чаще всего обнаруживается нормальный или незначительно повышенный уровень ЛГ при нормальном уровне ФСГ [16, 19]. При этом в отличие от синдрома поликистозных яичников соотношение ЛГ/ФСГ меньше 3 [27].
В заключение целесообразно отметить основные особенности гормонального гомеостаза при СТ.
Лечение СТ представляет собой непростую задачу. Его необходимость диктуется прежде всего предрасположенностью к развитию гиперплазии и рака эндометрия у таких больных, чему способствует хроническая ациклическая стимуляция эстрогенами. Другой серьезной проблемой является возникновение выраженной вирилизации пациенток, обусловленной ги- перандрогенией и нарушениями периферических рецепторных взаимодействий. Последнее утверждение, возможно, объясняет тот факт, что даже двустороняя овариэктомия иногда оказывается неэффективной в отношении таких проявлений вирильного синдрома, как гипертрихоз и гирсутизм, гипертрофии и вирилизации клитора.
В основе современного подхода к патогенетическому лечению СТ лежит принцип восстановления нарушенной функции яичников, т. е. устранение ановуляции с целью нормализации процессов стероидогенеза. Достичь желаемого результата можно лишь при своевременно начатом комплексном лечении с учетом индивидуальных особенностей течения заболевания.
Женщинам с сопутствующим ожирением необходимо рекомендовать мероприятия, направленные на снижение избыточной массы тела: низкокалорийную диету в пределах 1500— 2200 ккал/сут с ограничением жиров и легкоусвояемых углеводов, ограничение потребления соли до 3—5 г/сут, умеренную физическую нагрузку, нормализацию режима труда и отдыха.
В 1953 г. G. Mitchell и J. Rogers [29] показали, что ановуля- ция и олигоменорея у женщин с ожирением, которые смогли достигнуть значительного уменьшения массы тела, исчезали и восстанавливались овуляторные циклы. Хотя андрогены в данной работе не исследовались, можно предположить, что именно уменьшение синтеза андрогенов, вызванное снижением массы тела, приводило к нормализации гормонального гомеостаза и восстановлению овуляторных циклов.
Следующий этап в лечении СТ — «антиандрогенная терапия». Одной из схем лечения является применение ципроте- ронацетата, обладающего аитиандрогениой и аитигоиадотроп- ной активностью, в сочетании с этинилэстрадиолом в течение 6 мес. При получении положительной динамики (снижение содержания андрогенов в плазме крови, уменьшение вирилизации, установление регулярных менструаций) целесообразно перейти на поддерживающее лечение препаратом «Диане-35» в течение последующих 6 мес. Данная схема лечения оказывается наиболее эффективной при слабовыражеииой гиперанд- рогении.
В случае умеренно выраженной гиперандрогении возможно проведение стимуляции овуляции кломифенцитратом до 3 циклов.
Если после 6 мес медикаментозной терапии ановулятор- ные циклы становятся регулярными, но гиполютеиновыми, то к лечению можно подключить препараты с гонадотропной активностью (хумегон или ■ пергонал).
Однако, несмотря на расширение арсенала препаратов, используемых в лечении СТ, эффект достигается лишь в случае форм заболевания, характеризующихся нормальным или слегка повышенным уровнем Т, поэтому отсутствие положительных результатов от проводимой медикаментозной терапии в течение года является прямым показанием к проведению операции — клиновидной резекции яичников. Данная методика позволяет удалить значительный объем андрогенпродуци- рующей ткани. Большой опыт применения оперативного метода лечения данного заболевания показывает, что в 70% случаев удается достичь восстановления нормального овуляторного менструального цикла и в 40% — восстановления фертильности [6]. Также достаточно велик процент стабилизации гирсутизма, и приблизительно в 18% случаев наблюдается уменьшение роста волос.
К сожалению, как было указано, не все пациентки с выраженной гиперандрогенией излечиваются даже с помощью оперативного метода.
В некоторых работах имеются указания на снижение концентрации андрогенов в раннем послеоперационном периоде, но изменение гормонального фона обычно кратковременно, и уже через 2—4 нед показатели возвращаются к исходному предоперационному уровню.
Таким образом, единственным способом ликвидации массивной гепераидрогннии у больных данной группы долгое время оставалась хирургическая кастрация — двусторонняя овариэктомия.
Показаниями к проведению такой операции являются выраженная дефеминизация и вирилизация пациенток. Но нельзя также забывать и о том, что СТ часто может иметь бессимптомное течение, оставаясь при этом фактором высокого риска развития гиперплазии и рака эндометрия, особенно у женщин в постменопаузе.
Поэтому было очень важно найти альтернативный и менее травматичный метод лечения СТ.
В 1986 г. К. Steingold и соавт. [37] впервые применили агонисты ЛГ—РГ для подавления стероидпродуцирующей активности яичников у пациентки 31 года с СТ. Помимо выраженного вирильного синдрома (тяжелый гирсутизм и гипертрихоз, увеличение клитора до 8 мм), у нее наблюдались олигомено- f рея, первичное бесплодие, acantosis nigricans на задней части шеи.
За 1 мес до начала лечения агонистами ЛГ—РГ больной была произведена клиновидная резекция яичников. Измерение содержания стероидных гормонов, полученных методом селективной венозной катетеризации яичниковых и надпочечниковых вен, проводилось до и после оперативного вмешательства. Анализ полученных данных показал, что непосредственной реакцией на удаление яичниковой ткани явилось значительное снижение уровня большинства Д-4- и Д-5- стероидов, а также кортизола, эстрона и эстрадиола. Интересен тот факт, что концентрация Т, андростендиона и 17-ОН-П приближалась к границам нормы, тогда как содержание прегненолона и П не изменялось, но уже через 4 нед содержание половых стероидов пришло к исходному уровню. Через 1 мес после операции больная стала получать аналоги ЛГ—РГ по 100 мг в день ежедневно. Как и предполагалось, исследователям удалось достичь выраженного супрессивного эффекта на все Д-4-сгероиды, эстрон и эстрадиол, тогда как на Д-5-стероиды и кортизол агонисты ЛГ—РГ не оказали влияния. Кроме того, снижение уровня Д-4-стероидов и эстрогенов было более значительно, чем после клиновидной резекции. Подавление овариального стнриодогеннза сохранялось в течение 6 мес приема препарата и 1 мес после его завершения.
Через 1 мес лечения уровень Т и андростендиона снизился Г до нормы, а через 2 мес достиг показателей, наблюдаемых при хирургической кастрации.
Через 4—5 мес после начала лечения было отмечено незначительное увеличение содержания кортизола и Д-5-стерои- дов—ДГАС и П-ОН-прегненолона вследствие увеличения функциональной активности надпочечников. С другой стороны, применение агонистов ЛГ—РГ мало повлияло на синтез надпочечниковых андрогенов.
Несмотря на индуцированную медикаментозную кастрацию, авторы не отметили уменьшения степени гирсутизма во время лечения. Это не противоречило имеющимся данным, что тяжелый гирсутизм плохо поддается терапевтическому воздействию, включая применение таких антиандрогенов, как ципротеронацетат. Возможно, это объясняется измененной чувствительностью рецепторов волосяных фолликулов к стимулирующему гормональному влиянию, а также длительностью цикла роста волос на лице (6 мес).
С другой стороны, эффект подавления гипнрэстрогниеи привел к тому, что гиперплазия эндометрия сменилась его атрофией.
Целью лечения данной больной было не только подавление избыточной продукции андрогенов, но и восстановление нормального овуляторного цикла и достижение беременности.
Через 2 нед после завершения лечения пациентке был назначен хорионический менопаузальный гонадотропин в течение 8 дней. При этом уровень эстрадиола повысился до 1840 пг/мл и по данным УЗИ размер фолликула был около 14 мм. Через 7 дней уровень прогестерона достиг 30 нг/мл, что свидетельствовало о возникновении овуляции.
Достижение полноценной овуляции в 1-й месяц после медикаментозной овариэктомии позволило сделать вывод о том, что СТ имеет функциональную природу возникновения, которая предполагает успешный результат лечения, направленного на подавление избыточной продукции андрогенов. Это достигается путем применения агонистов рилизинг-гормонов.
Создание пролонгированных форм аналогов ЛГ—РГ сделало возможным их использование 1 раз в месяц. Более того, у женщин репродуктивного возраста с текоматозом яичников, страдающих бесплодием, появился шанс достижения беременности, хотя вероятность ее наступления в случае выраженной гиперплазии и лютеинизации стромы невелика.
Таким образом, обобщая принципы подхода к лечению СТ яичников, можно сделать следующие выводы.
. излечения. Высокая стоимость этих препаратов также огра- * ничивает их широкое применение.