Что такое стромальные клетки
Что такое стволовые клетки?
Стволовые клетки – это клетки-предшественники всех клеток и тканей нашего организма. Стволовые клетки способны поддерживать свою численность с помощью деления и обладают способностью дифференцироваться (превращаться) в различные типы клеток.
Когда стволовые клетки делятся, они могут формировать больше себе подобных клеток или больше других типов клеток. Например, стволовые клетки кожи могут сформировать больше стволовых клеток кожи или они могут сделать больше дифференцированных клеток кожи, которые имеют свои собственные конкретные функции, такие как выработка пигмента меланина.
Стволовые клетки человека условно разделяют на гемопоэтические и мезенхимальные.
Мезенхимные (стромальные) стволовые клетки (МСК) способны превращаться в клетки костной, хрящевой, соединительной ткани, формировать элементы кровеносных сосудов. Кроме восполнения утраченных элементов этих тканей, мезенхимальные стволовые клетки синтезируют большой набор биологически активных веществ, с помощью которых могут изменять поведение других типов клеток, например, клеток иммунной системы.
Такие биологические функции мезенхимальных стволовых клеток сделали их востребованным источником для регенеративной терапии: к концу 2017 года в международной базе клинических испытаний зарегистрировано более 780 исследований с использованием МСК (https://clinicaltrials.gov). Многообещающие результаты были получены при применении МСК для восстановления тканей при травмах опорно-двигательного аппарата, язвах и ожогах, для профилактики и/или лечения реакции трансплантат против хозяина при онкологических заболеваниях, при терапии иммунопатологических процессов, ишемии нижних конечностей, патологии сердечно-сосудистой системы, дегенеративных процессов в хрящевой ткани и даже в реконструктивной стоматологии. Важно, что по результатам всех клинических исследований применение МСК не приводит к возникновению серьезных побочных эффектов.
В качестве основных источников получения мезенхимальных стволовых клеток выступают костный мозг, жировая ткань и ткани пуповины. В отличие от МСК костного мозга и жировой ткани, мезенхимальные стволовые клетки пуповины – это молодые клетки, не подвергавшиеся действию негативных факторов внешней среды и поэтому обладающие высокой функциональной активностью.
Существует несколько источников стволовых клеток человека:
Почему стволовые клетки важны для вашего здоровья?
Какие существуют виды стволовых клеток?
Существует много различных видов стволовых клеток. Ученые считают, что каждый орган нашего тела имеет свой собственный специфический тип стволовых клеток. Например, наша кровь происходит из стволовых клеток крови (также известных как гемопоэтические клетки). Однако стволовые клетки присутствуют и на самых ранних этапах развития человека, и когда ученые выращивают эти клетки в лабораторных условиях, их называют эмбриональными стволовыми клетками.
Причиной, по которой ученые заинтересованы в эмбриональных стволовых клетках, является то, что работа эмбриональных стволовых клеток заключается в создании каждого органа и ткани в нашем организме во время нашего развития. Это означает, что эмбриональные стволовые клетки, в отличие от взрослых стволовых клеток, потенциально могут сформировать любую клетку из сотен различных типов клеток человека. Например, в то время как стволовые клетки крови могут производить только клетки крови, эмбриональные стволовые клетки могут формировать клетки крови, кости, кожи, мозга, и так далее.
Что такое индуцированные плюрипотентные стволовые клетки?
Ученые и врачи очень рады новому типу стволовых клеток, которые называются индуцированные плюрипотентные стволовые клетки (iPS). Рады потому, что эти клетки имеют почти все те же свойства, что и эмбриональные стволовые клетки, но происходят они не из эмбриона. Это снимает многие этические проблемы, связанные с практическим применением стволовых клеток. Кроме того, индуцированные плюрипотентные стволовые клетки получают из дифференцированных клеток самого пациента, а это означает, что iPS клетки могут быть возвращены пациенту без риска иммунного отторжения, что очень важно для любой трансплантации стволовых клеток.
Что нас ждет в будущем? Как стволовые клетки могут изменить процесс лечения?
Возвратимся к примеру сердца. Собственные стволовые клетки сердца самостоятельно просто не в состоянии восстановить ущерб от инфаркта, но пересадка миллионов стволовых клеток обладает гораздо более мощным потенциалом к обновлению поврежденных тканей. Поэтому, трансплантируя пациентам стволовые клетки, мы повышаем способность организма к самоисцелению, достижение которого лежит за пределами возможностей ограниченного количества наших собственных стволовых клеток. Некоторые проблемы требуют разрешения до того, как лечение стволовыми клетками станет более распространенным методом, включая вопросы безопасности (так как стволовые клетки могут потенциально формировать опухоли), а также проблемы иммунного отторжения.
Несмотря на это, стволовые клетки, вероятнее всего, усовершенствуют медицину и, вполне возможно, что через одно или два десятилетия большинство из нас будут знать кого-то или будут теми, кто получил трансплантацию стволовых клеток. Стволовые клетки перспективны для лечения большинства основных болезней, с которыми люди сталкиваются в течение их жизни, в том числе рака, сердечно-сосудистых заболеваний, болезни Паркинсона, рассеянного склероза, инсульта, болезни Хантингтона, травм спинного мозга и многих других заболеваний.
Какие методы лечения стволовыми клетками доступны уже сейчас, и почему многие врачи рекомендуют, чтобы вы их рассматривали с осторожностью и только в крайних случаях?
Зачем сдают пуповинную кровь
Поделиться:
Надо ли сдавать на хранение пуповинную кровь? Это вопрос продвинутых родителей. Ответ на него совсем не простой и далеко не однозначный, поэтому стоит сначала ответить на гораздо более простые вопросы.
Что такое пуповинная кровь?
Это кровь, которая остается в пуповине и плаценте после рождения ребенка. Она богата стволовыми клетками, которые можно использовать для лечения разных заболеваний.
Что такое стволовые клетки?
Это клетки-первоисточники. Дело в том, что большинство клеток в нашем организме высокоспециализированы и не похожи друг на друга. Клетка печени очень отличается от клетки сердца, потому что у них разная работа. Все высокоспециализированные клетки в процессе деления создают свои точные копии: из клетки печени может получиться только клетка печени.
А стволовые клетки не имеют четкой дифференцировки, поэтому из них можно вырастить практически любую ткань. Такие клетки можно обнаружить в крови и костном мозге у взрослых и детей. Впервые стволовые клетки были описаны в 1908 году русским гистологом Александром Максимовым, их изучение продолжается более 100 лет.
Правда, что стволовые клетки используют для лечения болезней?
Да, но стволовые клетки — не панацея. Из пуповинной крови извлекают гемопоэтические стволовые клетки, из них можно вырастить клетки кроветворной и иммунной системы. Такими клетками можно вылечить лишь ограниченное число болезней. Чаще всего и успешнее всего они применяются для лечения острых и хронических лейкозов.
При злокачественных заболеваниях крови проводится очень агрессивная химиотерапия, «убивающая» не только рак, но и всю систему кроветворения. Для того чтобы вылечить человека, необходимо полностью заменить больную систему кроветворения донорской — требуется пересадка (трансплантация) гемопоэтических стволовых клеток.
Читайте также:
Съесть плаценту
Кроме того, метод лечения стволовыми клетками пытаются применять в терапии более 70 различных заболеваний, в том числе таких, которые современная медицина лечить не умеет совсем. Исследователи предлагают методику при детском церебральном параличе, болезни Альцгеймера, сахарном диабете и других серьезных заболеваниях. Идут работы по лечению инсультов, инфарктов, переломов, цирроза печени.
Результаты, откровенно говоря, получаются очень разные, так что говорить о том, что всем надо срочно лечиться стволовыми клетками, преждевременно. Однозначные показания для трансплантации клеток пуповинной крови пока ограничиваются небольшим перечнем генетических, гематологических и онкологических заболеваний.
Пуповинная кровь лучше, чем костный мозг?
Клетки из пуповинной крови реже вызывают отторжение у реципиентов (людей, которым пересаживают ткани) и могут подойти большему количеству людей. Кроме того, получить пуповинную кровь очень легко, а сбор костного мозга у донора требует обезболивания и иногда дает осложнения.
Также пуповинную кровь легко заморозить и поместить в криохранилище на долгие годы, а костный мозг следует пересадить реципиенту в ближайшее время.
Как собирают и хранят пуповинную кровь?
Собрать пуповинную кровь очень просто: после рождения ребенка пуповина, связывающая малыша с плацентой, пережимается и пересекается. После этого с помощью специального набора собирают кровь, оставшуюся в пуповине и плаценте.
Пуповинная кровь может храниться в специальных банках стволовых клеток. Это организации, занимающиеся сбором, обработкой, хранением биологического материала. Во всем мире банки стволовых клеток могут быть государственными и частными. Точно так же обстоят дела и в нашей стране.
Основное отличие в том, что в государственный банк материал передается безвозмездно и может быть использован для любого пациента, которому подойдет. А в частных банках пациенты платят за забор и хранение своего биоматериала, чтобы распоряжаться им по своему собственному усмотрению.
Как обратиться в государственный гемобанк?
Если супружеская пара решит собрать пуповинную кровь и сдать в государственный банк, то следует поискать родильные дома, которые могут оказать такую услугу. За несколько недель до родов у матери берут кровь на анализы, чтобы исключить инфекции, изучают семейный анамнез и предлагают подписать информированное согласие.
Сбор пуповинной крови пока не входит в стандарты оказания медицинской помощи, поэтому это делают далеко не везде. Государственных банков в нашей стране пока немного. Известный благотворительный фонд «Подари жизнь» сообщает об успешной работе Царицынского банка пуповинной крови от департамента здравоохранения города Москвы и банка в Самаре.
Какие плюсы и минусы у договора с частным банком?
При выборе коммерческого банка супружеская пара заключает договор на проведение процедуры, и специально обученный человек прибывает к завершению родов практически в любой родильный дом на всей территории нашей огромной страны. Это, конечно, очень удобно. А главное, что при обращении в частный банк «вкладчики» приобретают свою собственную биостраховку от ряда болезней. Однако, не все так радужно.
Иногда пуповинной крови очень мало, практически нечего сохранять. Это бывает при преждевременных родах или без видимой причины. Кроме того, пуповинная кровь содержит не так уж много стволовых клеток. На практике для того чтобы провести нормальную трансплантацию взрослому человеку, обычно объединяют материал от нескольких доноров. Так что вашей «страховки» может оказаться недостаточно.
Кроме того, крайне редко стволовые клетки пуповинной крови могут впоследствии помочь этому же ребенку. Для лечения генетических заболеваний, к примеру, они совершенно не годятся, потому что носят ту же самую генетическую проблему. Бóльшая часть заболеваний крови также связана с генетическими нарушениями, поэтому трансплантация собственных стволовых клеток возможна лишь при скромном перечне лимфопролиферативных заболеваний.
Чаще же используется аллогенная трансплантация — когда клетки пересаживают другому человеку. Безусловно, тут есть большая вероятность, что собранный материал подойдет брату или сестре новорожденного. Или родителям. Или… какому-нибудь совершенно постороннему человеку.
Хранение пуповинной крови в качестве «биологической страховки» против каких-нибудь будущих заболеваний не оправдано! 3 Целесообразнее не тратить средства на подобное «страхование», а сдать кровь в некоммерческий банк. Вероятность того, что это кому-то поможет, гораздо выше.
Принимая окончательное решение о сборе и хранении пуповинной крови, нужно учитывать следующее:
1 Cord blood banking for potential future transplantation: subject review. American Academy of Pediatrics. Work Group on Cord Blood Banking // Pediatrics. 1999 Jul; 104 (1 Pt 1): 116-8.
2 American Academy of Pediatrics Section on Hematology/Oncology; American Academy of Pediatrics Section on Allergy/Immunology, Lubin BH, Shearer WT. Cord blood banking for potential future transplantation // Pediatrics. 2007 Jan; 119(1): 165-70. [PMID: 17200285]
3 ACOG Committee Opinion No. 648: Umbilical Cord Blood Banking // Obstet Gynecol. 2015 Dec; 126(6): e127-9. [PMID: 26595583]
ВОССТАНОВИТЕЛЬНАЯ ТЕРАПИЯ БУДУЩЕГО
Академик Российской академии медицинских наук, член-корреспондент РАН В. СМИРНОВ, директор Института экспериментальной кардиологии Кардиокомплекса Минздрава РФ.
Я хочу рассказать о разделе медицины, где незаметно для большинства ученых и врачей в ближайшее время ожидается феноменальный, грандиозный рывок в лечении множества болезней, сегодня практически неизлечимых.
В кроветворной системе стволовых клеток много, они просты по структуре, хорошо изучены, постоянно обновляются, и пути их превращений в клетки крови давно известны.
А вот о стволовых стромальных клетках костного мозга читатели вряд ли слышали. По сравнению с гемопоэтическими их в костном мозге совсем немного, и они представляют собой более сложные долгоживущие системы, которые обновляются достаточно редко. Пути превращения стромальных клеток только начинают изучать. Как показали последние исследования, стромальные клетки, так же как и предшественники клеток крови, постоянно циркулируют в кровотоке млекопитающих.
Стволовые клетки участвуют в восстановлении поврежденных тканей
Из стромальных клеток костного мозга можно вырастить любые клетки
В случае тяжелых повреждений организму своих собственных стромальных клеток не хватает. Ему можно помочь, вводя стромальные клетки извне. Итальянские ученые поставили простой опыт: методом облучения мышам полностью удалили костный мозг, затем ввели специально помеченные стромальные клетки. Через несколько дней животным дали препарат, от которого у них начали разрушаться мышцы передних ног. Через две недели после инъекции стромальных клеток мышечная ткань передних лапок у мышей частично восстановилась. Оказалось, что большая часть новых мышечных клеток образовалась из введенных стромальных. Видимо, стромальные клетки подходят к месту повреждения, где получают «химический сигнал» о том, в какие клетки им нужно превратиться, чтобы компенсировать потери организма. Более того, ученые сумели «заставить» стромальные клетки под действием специальных сигнальных веществ превращаться в клетки гладких мышц прямо «в пробирке».
Оказалось, что введение стромальных клеток костного мозга в зону повреждения сердечной мышцы (зону инфаркта) практически полностью устраняет явления послеинфарктной сердечной недостаточности у эксперимен тальных животных. Так, стромальные клетки, введенные свиньям-«инфарктникам», уже через восемь недель полностью перерождаются в клетки сердечной мышцы, восстанавливая ее функции практически полностью.
Результаты такого лечения инфаркта у животных просто поразительны. По данным American Heart Association (Американского кардиологического общества) за 2000 год, у крыс с искусственно вызванным инфарктом 90% стромальных клеток костного мозга, введенных в область сердца, полностью перерождаются в клетки сердечной мышцы.
Японские ученые получили из стромальных клеток костного мозга мышей клетки сердечной мышцы прямо в лаборатории: в культуру стромальных клеток добавили специальное вещество (5-азоцитидин), и они, как по мановению волшебной палочки, начали превращаться в клетки сердечной мышцы.
Такая клеточная терапия для восстановления повреждений сердечной мышцы после инфаркта весьма перспективна, потому что для нее используются собственные стволовые стромальные клетки организма. А они не отторгаются, кроме того, при введении взрослых стволовых клеток исключена вероятность их злокачественного перерождения.
Стромальные клетки превращаются и в печеночные. Установлено, что при повреждении печени новые печеночные клетки (гепатоциты) и их предшественники формируются в основном из донорских стромальных клеток костного мозга.
В терапевтическом применении стромальных клеток сегодня, без сомнения, лидирует ортопедия. Дело в том, что в руках у медиков имеются уникальные вещества: особые белки, так называемые bone morphogenic proteins (BMP), вызывающие перерождение стромальных клеток в клетки костной ткани (остеобласты). На выделение и изучение свойств BMP у исследователей ушло почти четверть века. Результаты клинических испытаний впечатляют. В США 91-летней пациентке с незаживающим в течение 13 лет переломом вживили специальную коллагеновую пластинку с нанесенными на нее BMP. При этом поступающие в зону перелома стромальные клетки «притягивались» к пластинке и под действием BMP начинали превращаться в клетки костной ткани. Через восемь месяцев после установки пластинки сломанная кость у больной практически восстановилась.
В США уже проходят последнюю стадию испытаний и скоро начнут широко применяться в клиниках специальные пористые губки, наполненные одновременно и стромальными клетками, и BMP. Помещая такие чудо-губки в поврежденное место (зону перелома или пустоту после удаления остеосаркомы), можно уже в течение двух месяцев заполнить недостающий промежуток до 25 сантиметров длиной.
Интересный эксперимент с использованием тканевых стволовых клеток провели американские исследователи. Они вырастили стволовые клетки мышечной ткани (миобласты) из бедренных мышц 72-летнего пациента-инфарктника. Затем эти клетки ввели ему непосредственно в зону инфаркта, после чего у больного было отмечено значительное улучшение сократительной способности сердца.
Источники стромальных клеток для восстановительной терапии
Сегодня за 75 долларов американские студенты сдают 20 миллилитров спинного мозга из поясничного отдела. Но полученные таким образом клетки используются только для научных исследований.
Можно ожидать, что промышленными источниками стромальных клеток в скором будущем станут пуповины, плаценты и жировая ткань.
Газеты и журналы (правда, большей частью зарубежные) переполнены информацией о стволовых клетках. Но не о стромальных, а об эмбриональных. Это клетки человеческого зародыша, обладающие способностью образовывать более двухсот с лишним типов тканей.
Такие разные стволовые клетки
Поскольку взрослый организм происходит от одной-единственной клетки, для каждой его клеточки можно составить «родословную»: проследить, из клетки какого типа она развилась и какие клетки могут «родиться» от нее.
Автор
Редакторы
Наш организм состоит из более чем двухсот различных типов клеток. Эти 10 13 маленьких живых объектов связаны сложными сетями взаимодействий, причем каждая клетка выполняет свою строго определенную функцию во благо всего организма. За разнообразие клеточного состава и обновление изношенных клеток отвечают стволовые клетки (СК). Они бывают разными и отличаются в первую очередь способностью дифференцироваться — «превращаться» в специализированные клетки. Плюрипотентная СК может дать начало всем клеткам, присутствующим во взрослом организме; СК крови может дать все возможные типы клеток крови (но не нейрон или клетку эпителия кишечника), а потомки клетки — предшественницы кератиноцитов могут быть только кератиноцитами (такая клетка называется унипотентной). Подробнее о типах и свойствах стволовых клеток, а также о том, как их можно изучать и применять в медицине, рассказывает специальный выпуск журнала «Биохимия»: «Такие разные стволовые клетки». Редакция журнала «Биохимия» и «Биомолекула» предлагают вашему вниманию обзорную статью, которая резюмирует работы, опубликованные в этом номере.
«Биохимия» — «Биомолекуле»
Один из наиболее известных и классических русских журналов молекулярно-биологического профиля — «Биохимия» — дружит с «Биомолекулой». И в рамках этой дружбы мы будем иногда публиковать научно-популярные версии статей, обзоров и эссе, которые выходят в «Биохимии».
Стволовые клетки взрослого организма
Стволовые клетки (СК) находятся в организме в строго определенных местах, которые, благодаря окружающим клеткам и внеклеточному матриксу [1], обеспечивают правильное функционирование стволовых клеток. Такие места называются клеточной нишей [2]. В костном мозге есть два типа СК: кроветворные, способные дифференцироваться во все клетки крови, и мезенхимные (МСК), дающие начало костной, хрящевой и жировой тканям и составляющие важную часть стромы кроветворения (ниши кроветворной СК), но ни при каких обстоятельствах не способные дифференцироваться в клетки крови.
«Биомолекула» уже немало писала про стволовые клетки. Для начала предлагаем читателю ознакомиться с прекрасным обзором «Ствол и ветки: стволовые клетки» [3]. — Ред.
Самые первые — стволовые клетки крови
Первыми СК взрослого организма, с которыми познакомилась наука, стали, пожалуй, стволовые клетки крови. Еще в 1903 году русский ученый А.А. Максимов, наблюдая за поведением клеток крови, ввел понятие «стволовая клетка». Иерархия клеток-предшественниц в кроветворной системе представлена несколькими отделами, которые были определены физиологическими методами. Кроветворные клетки лабораторных мышей уничтожали радиацией, затем облученным животным подсаживали клетки, «стволовость» которых требовалось изучить. Оказалось, что в костном мозге есть стволовые клетки, способные к мультипотентной дифференцировке во все линии кроветворных клеток и к активному и многократному делению. В их силах полностью восстановить кроветворение в облученном организме. На этом свойстве СК крови основан успех пересадки костного мозга пациентам после лучевой терапии лейкозов.
Ниже в иерархии стоят олигопотентные клетки-предшественницы — родоначальницы только нескольких линий клеток крови, таких как общие миелоидные предшественники (дающие моноциты, мегакариоциты, эритроциты) и общие лимфоидные предшественники (дающие В-, Т- и НК-клетки ).
Еще более низкую ступень в иерархии занимает отдел уни- и бипотентных клеток-предшественниц, способных дифференцироваться только в одном или двух направлениях.
Процессы кроветворения в эмбрионе и взрослом организме в значительной мере различаются, и об этом можно прочитать в статье С.А. Рыбцова и М.А. Лагарьковой в тематическом номере «Биохимии» [4].
Самые популярные — мезенхимные стволовые клетки
Если стволовые клетки крови интенсивно изучают уже более 100 лет, то активные исследования МСК начались лишь в последней четверти ХХ века. Особенно интересен их потенциал для клеточной терапии, поскольку они содержатся в костном мозге, взятие образца которого не очень травматично для человека. МСК активно делятся в чашке Петри, и их можно «подтолкнуть» к дифференцировке в костную, хрящевую и жировую ткани.
Большой медицинский потенциал сподвиг Бигильдеева А.Е. с соавторами досконально изучить этот тип клеток при помощи генетического штрихкодирования клеточных популяций [6]. При извлечении МСК из костного мозга [7] в каждую клетку вносят метку — небольшой уникальный фрагмент ДНК, который встраивается в геном клетки и потому будет находиться в геномах всех ее потомков. Анализ этих меток после роста в чашке Петри позволяет определить, потомки каких клеток размножились сильнее, а каких — не оставили потомков.
Оказалось, что популяция МСК гетерогенна и представлена множеством клеточных клонов (потомков одной исходной клетки), различающихся по способности к делению и дифференцировке. При многократном пересеве культуры ее клональный состав значительно меняется из-за ухода потомков клеток, не способных к долгому размножению. МСК с высокой способностью к размножению чаще выявляются на ранних этапах культивирования вне организма, и в поликлональной популяции МСК содержится лишь небольшое количество таких клеток. В связи с этим в подходах регенеративной медицины, требующих активного размножения клеток, рекомендуется применять МСК ранних пассажей (то есть те, что жили в чашке Петри недолго). Благодаря подобным исследованиям становится ясно, что хранить в замороженном виде МСК в больших количествах невозможно: для этого придется их долго культивировать, и они могут утратить требуемые стволовые свойства. Тут можно обратиться к более ранним стволовым клеткам, каких во взрослом организме уже не остается.
Эмбриональные стволовые клетки
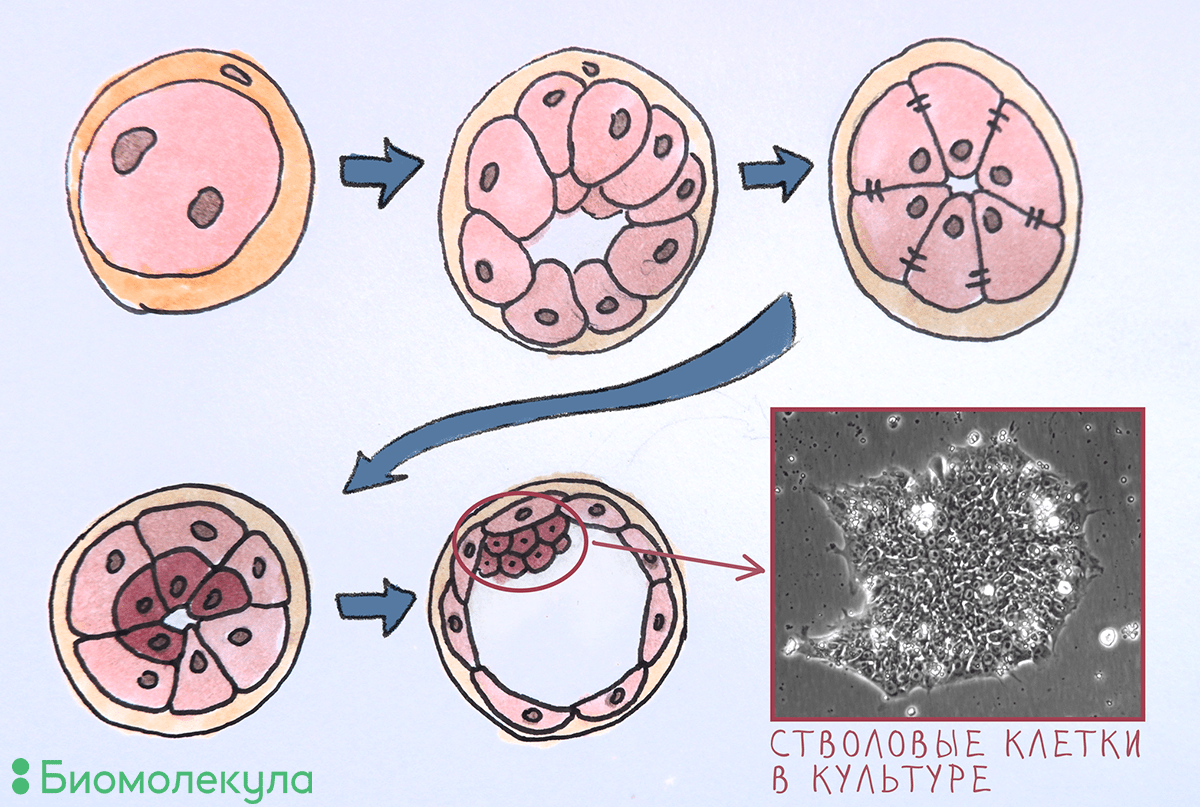
Некоторые стволовые клетки функционируют не просто в особом месте организма, но и в строго определенное время. Тотипотентностью — способностью дифференцироваться во все клетки организма и экстраэмбриональные ткани — обладает только зигота, но уже после нескольких делений это свойство утрачивается навсегда. На стадии бластоцисты происходит первая специализация клеток эмбриона: выделяются клетки трофобласта (наружный слой, который затем образует экстраэмбриональные ткани) и клетки внутренней клеточной массы, из которых разовьется весь организм (рис. 1). Последние при культивировании в чашке Петри называются эмбриональными стволовыми клетками (ЭСК). Впервые удалось вывести этот тип клеток в культуру в 1981 году [8]. Добавляя в культуральную среду определенные белки — факторы роста, — удается долго поддерживать ЭСК в недифференцированном плюрипотентном состоянии. ЭСК активно размножаются, сохраняя при этом свои свойства, что позволяет получать большое количество клеток для исследовательских задач и для применения в медицине.
Рисунок 1. Первые пять дней развития эмбриона человека. 1 — Оплодотворение; 2 — деление (дочерние клетки называются бластомерами); 3 — компактизация (образование плотных контактов между бластомерами); 4 — дифференцировка на внутренний и внешний слои; 5 — образование полости (бластоцеля), внешнего слоя клеток (трофобласта) и внутренней клеточной массы, которую можно извлечь для культивирования в чашке Петри и получить таким образом ЭСК (фото автора статьи).
Однако, несмотря на свои уникальные свойства, ЭСК не лишены недостатков. А поскольку для получения ЭСК приходится разрушать эмбрион, возникли и этические вопросы. Часть общества негативно настроена по отношению к применению ЭСК в медицине и науке, даже несмотря на то, что донорами ЭСК служат эмбрионы, оставшиеся невостребованными при процедуре экстракорпорального оплодотворения [9], и существует технология забора единичных клеток [10], применяемая, например, для ранней эмбриональной диагностики и не вызывающая гибели эмбриона. В 2017 году в России вступил в силу федеральный закон № 180-ФЗ «О биомедицинских клеточных продуктах», регулирующий использование стволовых клеток человека в медицине. Он запрещает использовать для производства биомедицинских клеточных продуктов биоматериал, полученный из эмбрионов или плодов человека. Запрещаются искусственное создание эмбриона человека, прерывание или нарушение процесса развития эмбриона или плода человека в целях производства биомедицинских клеточных продуктов. Поэтому исследователи и бизнес вынуждены фокусироваться на разработке продуктов из постнатальных клеток, то есть взятых уже после рождения.
ИПСК — «искусственные» плюрипотентные стволовые клетки
Один из многообещающих источников стволовых клеток, позволяющий избежать упомянутых этических проблем, — индуцированные плюрипотентные стволовые клетки (ИПСК) [11]. За открытие технологии их получения Синья Яманака и Джон Гёрдон в 2012 году были удостоены Нобелевской премии по физиологии или медицине [12]. ЭСК и ИПСК практически неотличимы друг от друга, но явное преимущество ИПСК перед ЭСК состоит в том, что для их получения не нужно разрушать эмбрион. Необходимо просто добыть из взрослого организма материал, забор которого не причиняет человеку вреда: фибробласты кожи, волосяные луковицы, кровь. Чаще всего используют фибробласты из нижнего слоя кожи, вырабатывающие коллаген и эластин и первыми спешащие на помощь при заживлении раны. Их преимущество в том, что они хорошо (и дешево!) размножаются в культуре, а протоколы «репрограммирования» — методы возвращения клетки взрослого организма в плюрипотентное состояние — отлажены и широко доступны. Извлеченные клетки размножают в культуре и разными способами перепрограммируют. Затем, после тщательной характеристики, подтверждающей, что клетки стали плюрипотентными и не содержат хромосомных аномалий, приступают к экспериментам.
Подробнее о перепрограммировании клеток рассказывает статья «Была клетка простая, стала стволовая» [11]. — Ред.
Существуют разные протоколы перепрограммирования — как со вставкой ДНК прямо в геном клетки (подходят только для исследовательских целей), так и не оставляющие следов в геноме (подходят и для медицинского применения ИПСК). Получение ИПСК с помощью доставки репрограммирующих факторов в вирусных векторах (например, лентивирусных, относящихся к тому же семейству вирусов, что и ВИЧ), которые встраиваются в геном клетки, широко распространено в лабораторной практике ввиду высокой эффективности, методологической простоты и дешевизны.
Однако клетки, несущие в своем геноме вирусные вставки, потенциально опасны из-за возможности активации протоонкогенов в организме пациента — прямого пути к развитию злокачественных заболеваний. Чтобы сделать ИПСК безопасными для медицины, предстояло преодолеть проблемы геномной интеграции и неполного «замолкания» трансгенных факторов репрограммирования, возникающие при использовании вирусных систем. Появились протоколы перепрограммирования, не требующие изменения генома. Среди таких методов можно отметить применение синтетических РНК факторов репрограммирования или же самих этих факторов, в белковой форме. Доставленные в клетку, эти молекулы начинают работать так, будто бы клетка сама их синтезировала. Однако широкому распространению этих методов препятствует то, что синтез и очистка РНК и белков в пробирке стόят очень дорого, а эффективность репрограммирования готовыми белками очень низка: в ИПСК превращаются лишь 0,006% обработанных клеток.
Решение, как это часто бывает в науке и технике, удалось подсмотреть у природы. С одной стороны, никакая искусственная система доставки биологических молекул в клетку не будет так эффективна, как вирус, поскольку он миллионы лет эволюции оттачивал мастерство заражения клетки. С другой стороны, кроме упомянутых выше, существуют вирусы с совершенно другим жизненным циклом, в ходе которого вирусный генетический материал не встраивается в геном клетки-хозяина, — а это именно то, что нужно для безопасных медицинских манипуляций. Производство таких вирусных векторов тоже не дешевое «удовольствие», но это неудобство с лихвой окупается высокой эффективностью перепрограммирования — до 1% (да, для репрограммирования клеток это действительно много!). Получаемые таким методом ИПСК безопасны для клинического использования, поскольку геном клетки не меняется (а значит, и не повреждается), и никакие опасные трансгены в организме пациента активироваться не могут.
Впрочем, каким бы способом мы ни получали ИПСК, лишь в редких случаях можно работать непосредственно с плюрипотентными клетками. При изучении заболеваний «в пробирке» целесообразнее всего анализировать именно тот тип клеток, который повреждается при этой болезни. Для клинической практики плюрипотентные клетки не подходят категорически, поскольку в организме они могут превратиться много во что, в том числе и в опухоль (тератому). Необходимо трансплантировать именно тот тип клеток, который нуждается в замене или восполнении, и современные клеточные технологии позволяют сделать это в условиях лаборатории.
Дифференцировка плюрипотентных клеток «в пробирке»
Изучать «молекулярные детали» большинства заболеваний прямо на пациентах неудобно (или даже невозможно): например, если болезни подвержены мозг или сердце, образцы поврежденных тканей можно получить только после смерти пациента. Зачастую к моменту ухода пациента из жизни ткани и органы повреждены болезнью настолько, что в них не остается интересующих исследователя клеток. В мозге страдавших болезнями Альцгеймера или Паркинсона на месте пораженных структур остаются только пустоты, и говорить об изучении причин гибели нейронов уже не приходится. Вот почему исследователям необходимы адекватные модели различных заболеваний.
Разработку и проверку новых лекарств на стадии доклинических исследований ведут на модельных животных, и это порождает массу ограничений, так как многие вещества метаболизируются у таких животных и человека по-разному. Лабораторные животные не страдают многими заболеваниями — той же болезнью Паркинсона, например. В таком случае поражение специфического типа нервных клеток вызывают химическими веществами или усиленной работой мутантного гена, с которым связывают развитие болезни. Модель, основанная на таком «искусственном» развитии болезни у лабораторного животного, не всегда адекватно воспроизводит симптомы заболевания, а это затрудняет его изучение.
«Биомолекула» рассказывала об этом во всех подробностях в спецпроекте по клиническим исследованиям.
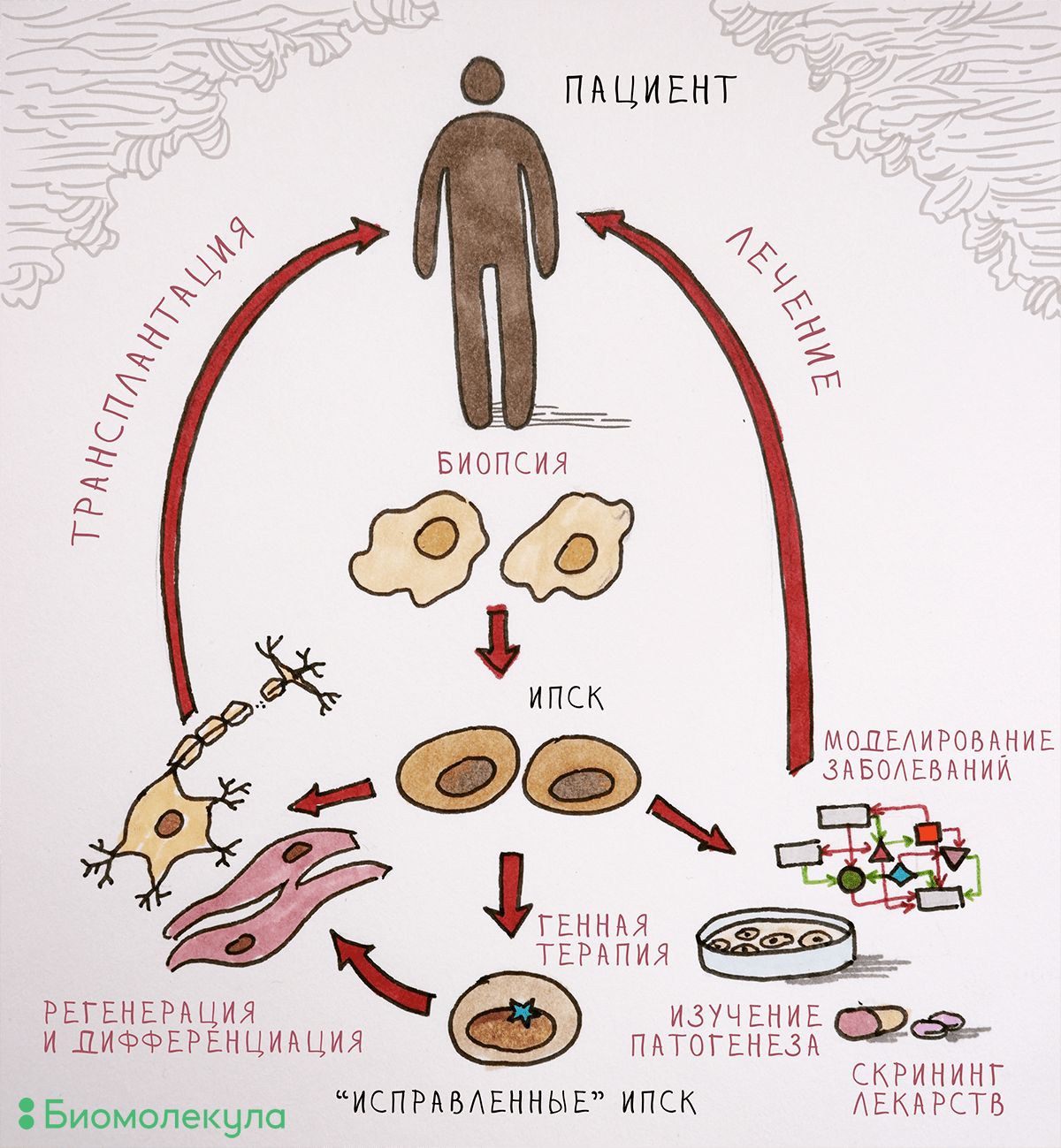
Рисунок 2. Применение ИПСК в биологии и медицине. Полученные из клеточного материала взрослого человека ИПСК можно «превратить» в любой тип клеток. Дифференцированных потомков этих СК можно оставить в лаборатории, чтобы изучать механизмы развития болезни и проверять новые лекарственные средства, а можно и трансплантировать пациентам (разумеется, подтвердив безопасность протоколов лечения).
Для создания модели заболевания на основе ИПСК необходимо превратить их в тот тип клеток, который повреждается при изучаемой патологии. Наиболее востребованы модели нейродегенеративных и кардиологических заболеваний, ведь в этих случаях поврежденные ткани напрямую не доступны исследователям. Для запуска дифференцировки в нужную сторону необходимо воспроизвести в чашке Петри те же условия, с которыми клетка сталкивается в организме. Рассмотрим, как можно получить клетки нервной системы — нейроны, производящие дофамин (а именно они погибают при болезни Паркинсона [14], [15]).
Дифференцировка в клетки нервной системы: трудно, долго, красиво
Тут мы должны слегка углубиться в эмбриологию, ведь нужно будет имитировать все изменения в окружении клетки, происходящие от стадии бластоцисты до формирования головного мозга. Придется учитывать и механические воздействия на клетку, и своевременное появление определенных белков — факторов дифференцировки, — и их концентрацию, и состав солей в окружающей клетку среде, и особенности поверхности, к которой клетка прикреплена.
Перед запуском ИПСК в дифференцировку важно убедиться, что клетки растут в оптимальной плотности: они должны занимать почти всю площадь чашки Петри. Это необходимо, чтобы на старте превращения клетки давили друг на друга ровно так, как это происходит на первом этапе формирования нервной системы эмбриона — при развитии нервной трубки. Клетки, которые находятся на дне нервной бороздки, испытывают давление из-за активного размножения соседних клеток и изгибания самой бороздки в трубку, а клетки, расположенные сверху, наоборот, испытывают растяжение и превращаются в нервный гребень. Из нервного гребня впоследствии развивается множество типов клеток, в том числе и волосяные луковицы, а из клеток, находящихся на дне нервной бороздки, образуется центральная нервная система (рис. 3).
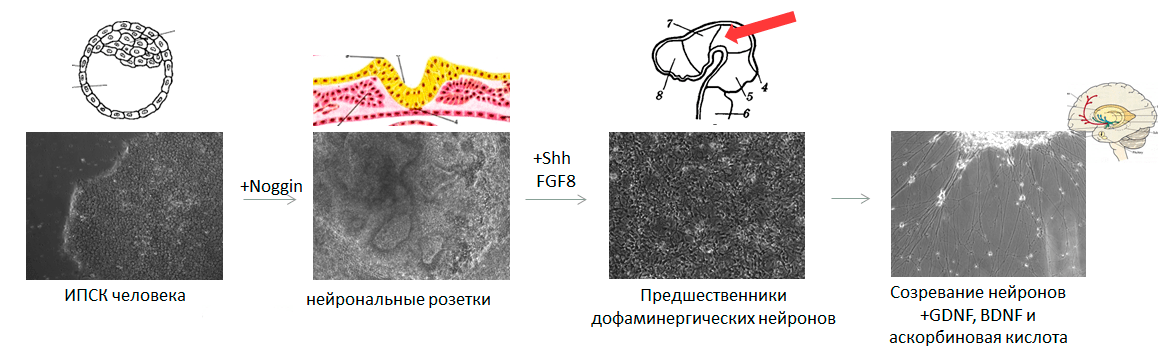
Рисунок 3. Последовательные стадии развития нервной системы (ранние этапы). Первоначально будущие клетки нервной системы изменяют форму и характерным образом располагаются друг относительно друга — получается нервная пластинка. Затем она изгибается, превращаясь в нервную бороздку, где на клетки действуют механические силы. Наконец, нервная бороздка замыкается в нервную трубку. Красные стрелки показывают механические силы, действующие на клетки. Нейрональные розетки — аналог нервной трубки в чашке Петри. Увеличение 100× (фото автора статьи).
Для дифференцировки в нейроны помимо механических сил необходимо воздействие специальных факторов — в основном, белка Noggin (на английском сленге означает «башка»). Он ингибирует сигнальные пути, ведущие к формированию мезодермы, обеспечивая таким образом нейрализацию (образование нервной трубки) эктодермы над местом закладки хорды. Добавляя в чашку Петри к ЭСК или ИПСК рекомбинантный белок Noggin, можно получить чистую популяцию ранних нейронных предшественников, аналогичных клеткам нервной трубки.
В процессе развития нервной трубки происходит ряд событий, ведущих к усложнению ее пространственной организации и клеточного состава. После замыкания нервной трубки начинается активное деление ее клеток, приводящее к многослойности трубки. Одновременно с разрастанием и утолщением нервной трубки происходит ее изгибание, необходимое для «укладки» формирующегося мозга в черепной коробке. За специализацию дофаминергических нейронов черной субстанции среднего мозга отвечают белок Sonic hedgehog (да-да, он назван в честь ёжика Соника) и фактор роста фибробластов 8 (FGF8).
Здесь важно правильно выбрать последовательность и количество белковых факторов, добавляемых в питательную среду дифференцирующимся клеткам (рис. 4). Если на ранних этапах развития нервная система представляла собой просто трубку, то теперь мозг приобретает сложную трехмерную организацию. Решающую роль в этом процессе играют градиенты факторов дифференцировки: выделяясь в определенных участках мозга, эти факторы диффундируют в окружающие ткани, и чем дальше от «места производства», тем их концентрация ниже. Сигналом к формированию определенного типа нейронов служит не сам по себе фактор дифференцировки, а его концентрация. Например, если добавить в среду с дифференцирующимися клетками меньше Sonic hedgehog, то вместо нейронов, вырабатывающих дофамин, мы получим нейроны, производящие гамма-аминомасляную кислоту [16], относящиеся к совершенно другой структуре мозга и выполняющие другие функции.
Рисунок 4. Параллель между нейрогенезом эмбриона и тем, как это выглядит в чашке Петри. Отправная точка — ЭСК или ИПСК (аналогичны внутренней клеточной массе бластоцисты). Под воздействием белкового фактора Noggin плюрипотентные клетки дифференцируются в ранние нейронные предшественники, аналогичные клеткам нервной трубки. Затем под действием более специфических факторов дифференцировки образуются специализированные нейронные предшественники, соответствующие конкретному отделу развивающегося мозга. И на последнем этапе при внесении белков GDNF и BDNF нейроны «созревают», становясь аналогичными клеткам полностью сформированного мозга.
Интересно, что на эти факторы сейчас возлагают немалые надежды в лечении болезни Паркинсона, при которой происходит массовая гибель нейронов: «Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?» [17]. — Ред.
Поскольку при нейродегенеративных заболеваниях, в том числе и при болезни Паркинсона, гибнут именно зрелые нейроны у взрослых людей, а не их размножающиеся предшественники, для моделирования болезни правильно брать как раз зрелые нейроны, чтобы с большей достоверностью повторить развитие патологических процессов. С другой стороны, можно изучать особенности дифференцировки нейронов и выяснять, что и как на эту дифференцировку влияет. Аналогичные подходы можно применить при получении кардиомиоцитов — клеток сердца, изучать которые прямо в организме тоже непросто.
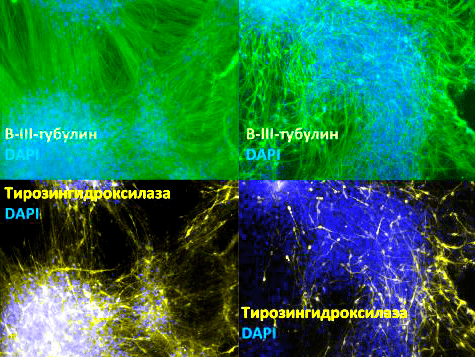
Рисунок 5. Зрелые нейроны, полученные путем дифференцировки из клеток-предшественниц. Различные структуры нейронов флуоресцентно окрашены: бета-III-тубулин (присутствует во всех типах нейронов; окрашен зелёным), тирозингидроксилаза (фермент, участвующий в синтезе дофамина; характерен для нейронов, выделяющих дофамин; окрашен желто-зеленым), ядра клеток (окрашены синим). Увеличение 100×.
фотография из диссертации автора статьи [18]
Дифференцировка в клетки сердца
Получение ИПСК от пациента и их последующая направленная дифференцировка в кардиомиоциты открывают новые возможности для изучения патогенеза наследственных сердечно-сосудистых заболеваний, в частности гипертрофической кардиомиопатии, от которой до сих пор не разработано эффективного лечения. При этом заболевании утолщаются стенки левого желудочка и межжелудочковой перегородки, развиваются сердечная недостаточность и аритмия, возрастает риск внезапной сердечной смерти. Гипертрофическая кардиомиопатия — одна из самых распространенных сердечно-сосудистых патологий: 1 случай на 500 человек. Елена Дементьева с коллегами создала модель этого заболевания на основе пациентспецифичных ИПСК [19]. Исследовав геном пациента с гипертрофической кардиомиопатией, коллектив обнаружил мутацию R326Q в гене MYBPC3, кодирующем миозин-связывающий белок С. Этот белок расположен в саркомере и играет важную роль в сокращении кардиомиоцита. ИПСК пациента и здорового донора (в качестве контроля) превратили в клетки сердца, которые воспроизводили такие признаки гипертрофической кардиомиопатии, как нарушение динамики потоков ионов кальция и их повышенное внутриклеточное содержание.
Таким образом, описанная клеточная модель для изучения гипертрофической кардиомиопатии представляет собой кардиомиоциты, полученные в результате направленной дифференцировки ИПСК пациента с этой болезнью.
3D-дифференцировка: миниорганы в пробирке
Исследования последних лет, связанные с созданием 3D-органоидов (Еремеев А.В. с соавторами [20]) из ЭСК или ИПСК, существенно облегчили исследования в области моделирования органогенеза человека in vitro и стали мощным инструментом для исследования механизмов развития патологий сложных органов, равно как и разработки новых подходов к их терапии. В последние годы были созданы многоклеточные органоиды мозга человека [21], толстой кишки [22], почек, сетчатки, печени. Разумеется, пока 3D-модели многоклеточных органов на основе 2D-культур имеют свои ограничения и лишь условно имитируют их сложную архитектонику [23], [24].
Тем не менее органоиды всё активнее используют в биомедицине. С помощью органоидов на основе ИПСК уже изучают механизмы наследственных заболеваний мозга (например, микроцефалии), а на органоидах мозга и кишечника проводят тестирование кандидатных лекарственных препаратов для лечения муковисцидоза и лихорадки Зика [25], [26]. Сейчас исследователи получают органоиды из нескольких типов клеток головного мозга или же клеток определенных зон. Добавление соответствующих факторов морфогенеза позволяет получать органоиды различных региональных подтипов мозга: коры головного мозга, мозжечка, среднего мозга, переднего мозга, гипоталамуса, гиппокампа. Есть основания полагать, что клетки в органоидах больше похожи на клетки в организме, чем плоские 2D-культуры на чашке Петри, поскольку они развиваются и образуют связи между собой более «правильно».
Применение плюрипотентных стволовых клеток в медицине
Еще в прошлом веке предпринимались попытки лечения тяжелых заболеваний с помощью клеточной терапии, то есть трансплантации новых, здоровых клеток на место гибнущих от болезни. Так, в 1987 году в Университете Лунда в Швеции провели ряд операций по подсадке в мозг пациентов с болезнью Паркинсона предшественников нейронов, полученных из эмбриона человека. У некоторых пациентов наступили значительные улучшения. Пересаженные клетки выживали в мозге пациентов и довольно долго нормально функционировали. Тем не менее улучшение наблюдалось далеко не во всех случаях, а иногда развивались и осложнения: пересаженные клетки «заболевали» болезнью Паркинсона.
Для решения проблем, выявленных в предыдущей серии трансплантаций, запустили TRANSEURO — клиническое исследование в Европе, в ходе которого в 2014–2016 годах 11 пациентам трансплантировали предшественников нейронов, вырабатывающих дофамин. Однако из-за источника клеток — эмбрионов человека — возникли как этические, так и чисто технические трудности, связанные с получением фетального материала и невозможностью его стандартизации для клинического применения. Из-за сбоев в поставке ткани для трансплантации из 90 запланированных операций по подсадке таких клеток осуществили только 20, и на данный момент проект остановлен. Для того чтобы обойти эти сложности, активно разрабатывают эффективные методы дифференцировки ЭСК и ИПСК для дальнейшего их применения в клинической практике.
Для клинического применения клеточной терапии с использованием ЭСК/ИПСК важно избежать иммунной реакции «трансплантат против хозяина». Технология ИПСК теоретически позволяет исключить или значительно снизить реакцию иммунной системы благодаря использованию собственных линий ИПСК. Однако на практике получение ИПСК и их дальнейшая дифференцировка для каждого пациента всё еще слишком дороги и длительны.
В качестве альтернативы Киотский университет запустил проект Stock, нацеленный на создание банка разных линий ИПСК, типированных по иммунологическим параметрам совместимости (как это делается при пересадке органов). Было подсчитано, что 50 линий ИПСК, специально отобранных по этому принципу, позволят охватить 73% населения Японии. Но не стόит забывать, что развитию иммунного ответа могут способствовать и клетки врожденной иммунной системы, такие как макрофаги и естественные киллеры.
Первые клинические испытания клеточного продукта, полученного из ИПСК, провели в Японии в 2017 году. Тестирование клеток пигментного эпителия сетчатки глаза, дифференцированного из ИПСК, показало, что получать производные ИПСК для каждого конкретного пациента, увы, нерентабельно [27]. Получение клеточного продукта очень трудоемко, дорого и требует жесткого контроля качества каждой созданной клеточной линии — будь то ИПСК или дифференцированные клетки. Поэтому научная общественность склоняется к применению в клеточной терапии «иммунологически совместимых» производных ЭСК и ИПСК. Такие клеточные продукты хоть и не позволят полностью избежать иммунного ответа, но смогут его снизить до уровня, с которым справится более мягкая иммуносупрессивная терапия.
Клинические испытания клеточной терапии болезни Паркинсона с помощью производящих дофамин нейронов, дифференцированных из ИПСК, планируется начать в Киотском университете и в Королевском госпитале Мельбурна. Этому решению предшествовали годы экспериментов на животных моделях. В серии экспериментов на приматах, стартовавшей еще в 2005 году, удалось подобрать оптимальный протокол операции: какое количество клеток нужно ввести в мозг животного, на какой стадии дифференцировки подсаживать клетки, чтобы они оставались в живых и наилучшим образом «встраивались» в поврежденные участки мозга и оказывали терапевтический эффект.
В связи с дороговизной и трудоемкостью получения линий ИПСК для каждого конкретного пациента, взоры практиков сейчас обращены к проектам, подобным Stock. Чтобы еще больше упростить и удешевить клеточную терапию, исследователи хотят прибегнуть к «обману» иммунной системы и получить одну универсальную линию ИПСК, которая бы подходила любому пациенту. Для этого можно генетическими методами убрать с поверхности клетки молекулы HLA I класса — метку «свой—чужой» для иммунной системы: именно различия в этой молекуле между индивидами приводят к реакции «хозяин против трансплантата». Если HLA I класса на поверхности нет, клетки становятся «невидимыми» для большинства иммуноцитов. Но небольшая их часть (естественные киллеры), наоборот, начинает распознавать такие клетки как опасные, поскольку специализируются на определении объектов без сигнала «свой». Однако и их можно обвести вокруг пальца, над чем сейчас и трудятся во многих лабораториях.
Клеточная терапия с использованием стволовых клеток различного происхождения набирает обороты в мировой практике. Такой подход клеточной терапии, как пересадка костного мозга, уже давно прижился в клинической практике. Терапия МСК не всегда дает хорошие результаты. Однако в случае реэпителизации поврежденных кожных покровов (например, при синдроме диабетической стопы) эффективность применения МСК уже показана в клинических исследованиях [28].
В клинику готовы войти и производные плюрипотентных стволовых клеток (ЭСК и ИПСК). Полученные из ЭСК олигодендроциты [29] и клетки поджелудочной железы [30], производящие инсулин, находятся на финальных этапах клинических испытаний. В случае олигодендроцитов был заявлен 15-летний срок наблюдения за пациентами после подсадки клеток в спинной мозг. Этот срок еще не истек, но негативных последствий для пациентов до сих пор не обнаружено. Начались клинические исследования клеточных продуктов для терапии таких сложных и тяжелых заболеваний, как дистрофия сетчатки и болезнь Паркинсона [31]. Многие исследования направлены на то, чтобы уменьшить или полностью исключить иммуносупрессию при пересадке дифференцированных производных ЭСК и ИПСК. Благодаря стволовым клеткам перед нами открывается огромное поле возможностей, но впереди еще большее поле научной работы.

 Читайте также:
Читайте также: