Что такое сульфид и сульфат
Сульфиды. Сульфаты
Во всех соединениях широко развиты изоморфные замещения одних элементов другими, а также примеси редких элементов: кадмия, галлия, индия и талия и др.
Характерны ионные кристаллические решетки. Но в связи с большими радиусами ионов S, Te, Se, As, Sb, наблюдается явление поляризации, поэтому появляются общие электронные оболочки и возникают ионно-ковалентные, а иногда – чисто ковалентные связи.
В большинстве случаев происхождение гидротермальное, иногда – сульфиды являются продуктами кристаллизации сульфидной магмы.
При выветривании в зоне окисления переходят в сульфаты, затем в оксиды, гидрооксиды, карбонаты.
PbS 
галенит англезит церрусит
Сульфиды подразделяются на подклассы:
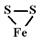
4) сложные (сульфосоли).
Сульфиды представляют собой рудную базу цветной металлургии и являются сырьем для производства серной кислоты.
Представители простых сульфидов:
— Cu2S – халькозин (медный блеск) – медная руда. Свинцово-серый цвет. Ромбическая сингония. Спайность несовершенная. Средне распространенный минерал на Украине.
Представители двойных сульфидов:
Основная химическая масса – морские и озерные осадки. Многие сульфаты – минералы зоны окисления, некоторые – продукты вулканической деятельности.
Используется в качестве утяжелителя в производстве красок, бумаги, клеенок, линолеума; при варке стекол (известен бариевый хрусталь); для изготовления баритовой штукатурки поглощающей рентгеновские лучи в лабораториях и больницах.
Распространен на Украине: Приазовье, Волыноподолье (в месторождении серы), наибольшие скопления в Закарпатье (Береговское и Беганьское месторождения).
—SrSO4 целистин – ромбическая сингония. Кристаллы таблитчатые, призматичные; агрегаты – друзы, шестоватые, зернистые. Цвет небесно-голубой, голубовато-белый, серый, прозрачный. Блеск стеклянный, на плоскостях спайности – перламутровый.
Распространенный минерал на Украине: Приднестровье, Приазовье, Крым, Прикарпатье.
—CaSO4 ангидрит – ромбическая сингония, кристаллы таблитчатые, близкие к изометричным; агрегаты сплошные, мелкозернистые. Важный породообразующий минерал, встречающийся вместе с гипсом и галитом в осадочных породах. Выпадает в осадок при температуре >42°С (до этой температуры выпадает гипс). При нормальном давлении в присутствии воды ангидрит переходит в гипс с большим увеличением объема (на 30%).
Распространенный минерал на Украине (Артемовское месторождение).
—CaSO4·2H2Oгипс (легкий шпат). Разновидности гипса:
— селенит – параллельно-волокнистая разность с шелковым блеском;
— алебастр – снежно-белая, тонкозернистая разность
Кристаллы таблитчатые, иногда очень крупные; характерны двойники «ласточкин хвост». Агрегаты плотные, зернистые, листоватые, волокнистые.
Известные месторождения гипса находятся в Донбассе (Артемовское) и в Приднестровье.
— Na2SO4·10H2Oмирабилит (глауберова соль). Моноклинная сингония – сплошные зернистые массы. Бесцветный, белый, блеск стеклянный, вкус горько-соленый, в пробирке при нагревании растворяется в собственной кристаллизационной воде. На воздухе теряет воду, превращаясь в тенардит Na2SO4·.
Крупнейшие месторождения мирабилита – залив Кара-Богаз-Гол, где он выпадает при 6°С и в больших количествах выносится прибоем на берег. Летом он снова растворяется, а выброшенный на берег минерал переходит в тенардит. Запасы составляют 4 млрд. тон.
И мирабилит и тенардит применяются в стекольной промышленности при изготовлении жидкого стекла, для приготовления соды по методу Леблана, в медицине.
Мирабилит редкий, тенардит среднераспостраненный минералы на Украине.
Класс Сульфиды и сульфаты
Для формирования сульфидов наиболее благоприятны горизонты ниже уровня грунтовых вод. Большинство сульфидов имеют гидро-термальное происхождение. Встречаются сульфиды, которые образовались непосредственно из магмы и ее летучих продуктов.
Барит. Название минерала происходит от др. греч. «βαρ?ς» – тяжёлый. Химическая формула минера- ла – BaSO4. В чистом виде бесцветный и прозрачный или белый, но обычно окрашен примесями оксидов железа, сульфидов и т. д. в самые разные цвета. Блеск стеклянный. Твердость – 3-3,5. Спайность совершенная и средняя.
Распространён широко. Происхождение гидротермальное, иногда образует самостоятельные рудные жилы в несколько метров шириной. Может заполнять миндалевидные пустоты в ряде основных вулканитов. В осадочных породах образует радиально-лучистые конкреции. Прозрачные кристаллы барита используют в оптических приборах. Применяют для защиты от рентгеновских лучей, для покрытий и изоляции в химических производствах (благодаря химической стойкости, в частности по отношению к серной кислоте). Служит сырьём для производства бариевых солей, бариевых белил, эмали, глазури; наполнитель при изготовлении резины, клеенки, линолеума, бумаги.
Фото 5. Барит. Место отбора образца: месторождение Белореченское, Кавказ, Россия (№ образца 16, № полки 11)
Гипс пластинчатый. Название минерала происходит от греческого слова «гипсос» – мел. Химическая формула минерала – CaSO4•2H2O. Волокнистая разновидность гипса называется селенитом, а зернистая – алебастром. Блеск стеклянный или шелковистый. Спайность весьма совершенная. Цвет – белый, серый, иногда красноватый. Излом – занозистый. Черта – белая. Твердость – 2.
Встречается гипс в пластах осадочных пород в форме чешуйчатых, волокнистых или плотных мелкозернистых масс; в виде бесцветных или белых кристаллов, иногда окрашенных захваченными ими при росте включениями и примесями в бурые, голубые, жёлтые или красные тона. Образует прожилки параллельно-волокнистой структуры (селенит) в глинистых осадочных породах, а также сплошные мелкозернистые агрегаты, напоминающие мрамор (алебастр).
Волокнистый гипс (селенит) используют для недорогих ювелирных изделий. Из алебастра издревле вытачивали крупные ювелирные изделия – предметы интерьера (вазы, столешницы, чернильницы и т.д.). Обожженный гипс применяют для отливок и слепков (барельефы, карнизы и т.д.), как вяжущий материал в строительном деле, в медицине. Используется для получения строительного гипса, высокопрочного гипса, гипсоцементно-пуццоланового вяжущего.
Фото 6. Гипс. Место отбора образца: Ульяновск, Россия (№ образца 32, № полки 5)
Селенит – разновидность гипса, имеющая шелковистый блеск и красивый переливчатый оптический эффект на полированной поверхности благодаря параллельно расположенным и плотно сросшимся между собой тонким волокнам. Просвечивает, имеет выраженный эффект иризации. Твердость – 2. Цвет чистых разностей белый, но чаще бывает окрашен примесями в желтоватый или розоватый оттенки.
Применяется как недорогой поделочный камень для изготовления резных художественных и художественно-бытовых изделий, бус и фигурок. Легко шлифуется наждачной бумагой и хорошо полируется. В украшениях может быстро затираться и терять полировку из-за малой твёрдости, и тогда требует новой полировки.
Фото 7. Селенит. Место отбора образца: Пермский край, Россия (№ образца 82, № полки 5)
Целестин. Название минерала происходит от латинского слова «caelestis» – небесный, химическая формула минерала – SrSO4. Минерал обладает следующими свойствами. Цвет – голубой, коричневый, бесцветный, зелёный, белый, серый. Цвет черты – белый. Блеск – перламутровый до стеклянного. Твердость – 3,0- 3,5. Спайность – совершенная. Излом – неровный. Кристаллы (столбчатые, таблитчатые) имеют множество граней, встречаются также зернистые агрегаты. Образуется в трещинах, друзах. Целестин используется в пиротехнике, химии (в стекольном, керамическом производстве), фармацевтике.
Фото 8. Целестин. Место отбора образца: Бэнеу, Туркмения (№ образца 107, № полки 11)
Фото 9. Ангидрит. Место отбора образца: Кавказ, Россия (№ образца 8, № полки 4)
Сфалерит. Название минерала происходит от др.-греч. «Φαλερ?ς» – обманчивый, цинковая обманка – минерал, сульфид цинка. Название связано с трудностью определения минерала. Сфалерит янтарно-жёлтого цвета называют медовой обманкой, оранжево-красного цвета – рубиновой обманкой. Химическая формула минерала – ZnS. Минерал обладает следующими свойствами. Цвет – жёлтый, красновато-оранжевый, зеленовато-жёлтый, серый, тёмно-серый.
Цвет черты – от желтоватого до светло-бурого. Блеск – алмазный. Твердость – 3,0-3,5. Излом – неровный. Спайность – совершенная. Сфалерит встречается в гидротермальных месторождениях, скарнах, полиметаллических рудах. Из сфалерита выплавляют металлический Zn. Попутно извлекают примеси: Cd, In, Ga.
Сфалерит используют в лакокрасочном производстве для изготовления цинковых белил. Большое значение имеет получение из природного сфалерита химически чистого ZnS, применяемого как люминофор. Люминофорный сфалерит, активированный Ag, Cu, применяют для изготовления кинескопов. Сфалерит используют для изготовления различных светосоставов и светящихся красок (например, в приборостроении), в различных сигнальных аппаратах.
Фото 10. Сфалерит. Места отбора образца: рудник Эльбрусский, Кавказ, Россия (№ образца 89, № полки 12)
Фото 11. Сфалерит. Места отбора образца: Дальнегорск, Приморский край, Россия (№ образца 90, № полки 8)
Галенит. Название минерала происходит от латинского слова «галена» – свинцовая руда. Химическая формула минерала – PbS. Часто содержит при- меси Ag, Cd, Se и др. Твёрдость – 2-3; плотность – 7,4-7,6 г/см³. Цвет – стальной, серый с голубоватым отливом, иногда пёстрая побежалость, блеск – металлический, излом – ступенчатый, хрупкий. Спайность – совершенная. Месторождения гидротермальные и метасоматические. В гипергенных условиях изменяется с образованием карбонатов (например, фосгенита) и сульфатов свинца. Основная руда свинца.
Фото 12. Галенит. Места отбора образца: Эльбрус, Кавказ, Россия (№ образца 25, № полки 5)
Фото 13. Галенит. Места отбора образца: Дальнегорск, Приморский край, Россия (№ образца 26, № полки 5)
Пирит. Название минерала происходит от греческого слова «ðυρ?της λ?θος» – камень, высекающий огонь. Химическая формула минерала – FeS2Не- редки примеси Со, Ni, As, Cu, Au, Se и др. Цвет на свежем сколе латунно-жёлтый до зо- лотисто-жёлтого, со временем меняется до тёмно-жёлтого, часто с побежалостью, за счёт образования поверхностной окисной плёнки. Имеет металлический блеск. Твёрдость – 6-6,5.
Пирит – один из самых распространенных в земной коре сульфидов. Большие его залежи сосредоточены в месторождениях гидротермального происхождения, особенно в серноколчеданных залежах, осадочных и метаморфических породах. В осадочных породах пирит образуется в закрытых морских бассейнах, в результате осаждения сероводорода. Кроме того пирит в небольших количествах образуется при магматических процессах.
Пирит главный источник получения кобальта, в значительной мере селена и таллия. Но пирит не является самостоятельным предметом разработки и добывается попутно из колчеданных руд при обогащении флотацией связанных с ним более ценных полезных ископаемых. Пирит является сырьём для получения серной кислоты, серы и железного купороса, но последнее время редко используется для этих целей. В последнее время всё чаще применяется в качестве корректирующей добавки при производстве цементов.
Фото 14. Пирит кристаллы. Места отбора образца: Дальнегорск, Россия (№ образца 71, № полки 8)
Фото 15. Пирит жильный. Места отбора образца: Карелия, Россия (№ образца 72, № полки 8)
Молибденит. Название происходит от греческого «молибдос» – свинец, т.к. в древности молибденит не отличали от галенита. Химическая формула ми- нерала – MoS2. Цвет – свинцово-серый. Блеск – металлический. Твёрдость по минералогической шкале 1–1,5. Генетически связан с гранитами, кварцевыми жилами, грейзенами, иногда с пегматитами. Кристаллы таблитчатые, но чаще встречается в виде агрегатов чешуйчатой или листоватой формы, вкраплений в кварце. В результате гидротермальных процессов осаждается из глубинных горячих вод.
Наиболее важное сырье для производства молибдена, получаемого в результате обогащения флотацией. Молибденит – полупроводник, применявшийся в радиотехнике для изготовления детекторов. Как компонент смазок в больших объемах используется и в автомобилестроении, но его применение здесь ограничивается, преимущественно, герметично закрытыми узлами, так как в негерметичных узлах под воздействием воды и кислорода воздуха, молибденит превращается в абразивный оксид молибдена.
Фото 17. Молибденит. Место отбора образца: Приэльбрусье, Кавказ, Россия (№ образца 61, № полки 4)
Арсенопирит. Название происходит от латинского слова. «arsenicum» – мышьяк. Химическая формула минерала – FeAsS. Блеск металлический, цвет оловянно-белый. Твёрдость по шкале Мооса – 5,5-6. Плотность 5,9 – 6,2 г/cм3. Хрупкий, излом неровный. При ударе издаёт резкий чесночный запах.
Арсенопирит встречается в гидротермальных рудных жилах совместно с галенитом, сфалеритом, флюоритом, кварцем. Для него характерно образование в широком интервале температур, он встречается также в пегматитах и в высокотемпературных постмагматических (пневматолитовых) месторождениях, иногда в зонах контактового метаморфизма. Арсенопирит – основное сырьё для получения мышьяка и его соединений. Попутно из него извлекаются полезные примеси (кобальт и никель).
Фото 18. Арсенопирит. Место отбора образца: не указано (№ образца 11, № полки 12)
Аурипигмент. Название происходит от латинского слова «aurum» – золото, золотая краска. Химическая формула минерала – As2S3. Цвет от лимонно-жёлтого до золотисто-жёлтого, на свежем сколе яркий. Цвет черты – светло-жёлтый. Блеск от алмазного до металлического, на свежих плоскостях спайности – сильный перламутровый. Спайность может быть весьма совершенной и неясной. Излом ступенчатый (раковистый). Твёрдость – 1,5-2. Это мягкий и вязкий минерал, легко режется ножом. Обладает специфическим серным запахом, усиливающимся при нагревании Аурипигмент имеет низкотемпературное гидротермальное происхождение. Часто встречается вместе с реальгаром, киноварью, антимонитом в глинах, гидротермально изменённых глинистых мергелях и сланцах, а также в рудных жилах.
Широко используется как минеральный пигмент в станковой живописи и, особенно, в иконописи (средневековое название минеральной краски – «королевская жёлтая»). За привлекательный внешний вид пользуется популярностью у коллекционеров.
Фото 19. Аурипигмент. Место отбора образца: Эльбрус, Кавказ, Россия (№ образца 14, № полки 4)
Пирротин. Название происходит от др.-греч. «ðυρρ?της» – огненно-красный – полиморфный минерал класса сульфидов, сульфид железа. Название дано в 1835 году немецким минералогом Августом Брайтхауптом. Химическую формулу пирротина отображают как FenSn+1(обычно n=6…11), или Fe1-хS (чаще всего х = 0,1-0,2, или Fe0.875S. Чаще всего состав Fe6S7и до Fn S12.
Обладает магнитными свойствами. Кристаллы и зёрна пирротина – природные постоянные магниты с удельной магнитной восприимчивостью 15×10−4см³/г. Хорошо проводит электричество. Сплавляется в чёрную массу. В кислотах растворяется очень плохо. Является рудой железа, хотя и менее значимой, чем пирит, используется в химической промышленности (производство серной кислоты). Из руды выделяют также примеси металлов.
Фото 20. Пирротин. Место отбора образца: Дальнегорск, Приморье, Россия (№ образца 74, № полки 5)
Халькопирит. Название происходит от греческого слова «χαλκóς» – медь» + пирит. Это устаревший синоним названия медный колчедан. Химическая формула – CuFeS2. Цвет золотисто-жёлтый, по оттенку, в отличие от латунно-жёлтого пирита, напоминающий червонное золото, из-за этого получивший название «золотая обманка». Блеск металлический. На поверхности кристаллов и сколов характерна яркая пёстрая побежалость. Твёрдость –3,5-4. Спайность несовершенная. Хрупкий. Под паяльной трубкой на угле сплавляется в серо-чёрный магнитный королёк.
Происхождение гидротермальное, в ассоциации с галенитом и сфалеритом входит в состав полиметаллических руд, однако сам по себе больших скоплений не образует. Образуется также при метаморфических процессах, встречается в грейзенах и скарнах. В близповерхностных условиях неустойчив и в процессе выветривания довольно быстро разрушается с образованием вторичных минералов меди. Важнейшая медная руда. Использовался как детектор в первых радиоприёмниках до появления электронных ламп.
Фото 21. Халькопирит. Место отбора образца не указано (№ образца 20, № полки 7)
Киноварь. Название происходит от старинного слова индийского происхождения. Химическая форму- ла минерала – HgS. Имеет красивую алую окраску, на свежем сколе напоминает пятна крови. На воздухе постепенно окисляется с поверхности, покрываясь тонкой плёнкой побежалости (HgО). Греческое название киновари, употребляемое ещё Теофрастом, по одной из версий происходит от др.- перс. zinjifrah, вероятно, означавшем «драконья кровь». Содержит 85,83 % ртути. Спайность совершенная в одном направлении. Хрупкая. Цвет красный, иногда наблюдается тёмная синевато-серая побежалость. В тонких осколках киноварь прозрачна, обладает ярким «алмазным» блеском. Твёрдость – 2-2,5. Легко плавится и при нагревании на воздухе до 200 °C полностью улетучивается с образованием паров ртути и сернистого газа. Растворима только в царской водке (Царская водка – смесь концентрированных кислот – азотной (63%) (1 объём) и соляной (3 объёма).
Киноварь – наиболее распространённый минерал ртути. Образуется в гидротермальных близповерхностных месторождениях, вместе с кварцем, кальцитом, баритом, антимонитом, пиритом, галенитом, марказитом, реже с самородным золотом. Киноварь с древности применялась в качестве красной краски, как источник для получения ртути и как единственное существовавшее до изобретения антибиотиков надёжное (хотя и небезопасное) средство лечения сифилиса. Как незаменимый ярко-алый минеральный пигмент киноварь применяли уже в Древнем Египте, со времён ранней Византии и доныне как минеральный пигмент является по сути незаменимой и широко используется.
Фото 22. Киноварь. Место отбора образца не указано (№ образца 46, № полки 5)
Урок №12. Сероводород. Сульфиды
Повторите тему 9 класса:
ПОЛУЧЕНИЕ СЕРОВОДОРОДА
Сероводород – токсичный бесцветный газ с запахом тухлых яиц.
Сероводород (H 2 S) в лаборатории можно получить нагреванием смеси парафина с серой.
Выделяющийся сероводород можно обнаружить с помощью влажной универсальной индикаторной бумаги: под действием сероводорода она краснеет. При добавлении сульфата меди к сероводородной воде выпадает черный осадок сульфида меди
CuSO 4 + H 2 S = CuS↓+ H 2 SO 4
По черному осадку сульфида свинца можно обнаружить сульфид-ион.
Сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
FeS (тв.) + 2HCl = FeCl 2 + H 2 S↑
FeS (тв.) + H 2 SO 4 = FeSO 4 + H 2 S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
H 2 + S ↔ H 2 S↑ + 20,92 кДж
Выход H 2 S мал, т.к. обратимая реакция обратима
Наиболее чистый сероводород можно получить при гидролизе сульфида алюминия
Al 2 S 3 (тв.) + 6H 2 O (ж.) = холод = 2Al(OH) 3 ↓ + 3H 2 S↑
Сероводород можно получить в других реакциях:
8Na + 5H 2 SO 4 (конц.) = 4Na 2 SO 4 + H 2 S↑ + 4H 2 O
8HI + H 2 SO 4 (конц.) = 4I 2 + H 2 S↑ + 4H 2 O
ХИМИЧЕСКИЕ СВОЙСТВА СЕРОВОДОРОДА
Изменяет окраску индикаторов на красную – кислая среда.
2) Взаимодействие с растворами оснований. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
H 2 S + 2KOH = K 2 S + 2H 2 O
H 2 S (избыток) + KOH = KHS + H 2 O
3) С растворами солей тяжёлых металлов (Cu, Pb, Ni, Cd, Zn):
H 2 S + CuSO 4 = CuS↓ + H 2 SO 4
CuS осадок чёрного цвета
Сульфиды тяжёлых металлов окрашены: PbS; CuS; NiS – чёрные. СdS – жёлтый. ZnS – белый.
Сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H 2 S + Pb(NO 3 ) 2 = PbS + 2HNO 3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Сероводород – восстановитель
1) При недостатке кислорода и в растворе H 2 S окисляется до свободной серы (раствор мутнеет):
2H 2 S + O 2 (нед.) = 2S↓ +2H 2 O
В избытке кислорода:
2H 2 S + 3O 2 (изб.) = 2SO 2 ↑ + 2H 2 O
2) Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Бром и хлор окисляют сероводород до молекулярной серы:
H 2 S + Cl 2 = 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H 2 S + 4Cl 2 + 4H 2 O → H 2 SO 4 + 8HCl
Азотная кислота окисляет сероводород до молекулярной серы:
H 2 S + 2HNO 3(конц.) = S + 2NO 2 + 2H 2 O
При кипячении сера окисляется до серной кислоты:
H 2 S + 8HNO 3(конц.) = H 2 SO 4 + 8NO 2 + 4H 2 O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Оксид серы (IV) окисляет сероводород:
2H 2 S + SO 2 = 3S + 2H 2 O
Соединения железа (III) также окисляют сероводород:
H 2 S + 2FeCl 3 = 2FeCl 2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H 2 S + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O
2H 2 S + 4Ag + O 2 = 2Ag 2 S + 2H 2 O
Интересно! Серебряные и медные монеты чернеют на воздухе и в воде, если в среде содержится сероводород:
Серная кислота окисляет сероводород либо до молекулярной серы:
H 2 S + H 2 SO 4(конц.) = S + SO 2 + 2H 2 O
Либо до оксида серы (IV):
H 2 S + 3H 2 SO 4(конц.) = 4SO 2 + 4H 2 O
СУЛЬФИДЫ
Сульфиды – это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на растворимые в воде, нерастворимые в воде, но растворимые в минеральных кислотах, нерастворимые ни в воде, ни в минеральных кислотах, гидролизуемые водой.
Чёрные сульфиды (CuS, HgS, PbS, Ag 2 S, NiS, CoS)
Белые и цветные сульфиды (ZnS, MnS, FeS, CdS)
ПОЛУЧЕНИЕ СУЛЬФИДОВ
2) Растворимые сульфиды можно получить при взаимодействии сероводорода и щелочей
H 2 S + 2KOH = K 2 S + 2H 2 O
3) Нерастворимые сульфиды получают взаимодействием растворимых сульфидов с солями или взаимодействием сероводорода с солями (только черные сульфиды)
Pb(NO 3 ) 2 + Н 2 S = 2НNO 3 + PbS
ZnSO 4 + Na 2 S = Na 2 SO 4 + ZnS
ХИМИЧЕСКИЕ СВОЙСТВА СУЛЬФИДОВ
1) Гидролиз. Растворимые сульфиды гидролизуются по аниону, среда водных растворов сульфидов щелочная:
Na 2 S+H 2 O↔NaHS+NaOH;
2) С растворами кислот. Сульфиды металлов, расположенных в ряду напряжений левее железа (включительно), растворяются в сильных минеральных кислотах.
CaS + 2HCl = CaCl 2 + H 2 S↑
3) С концентрированными кислотами. Нерастворимые сульфиды растворяются в концентрированной азотной кислоте или концентрированной серной кислоте. При этом сера окисляется либо до простого вещества, либо до сульфата.
CuS + 8HNO 3 = CuSO 4 + 8NO 2 + 4H 2 O
или горячей концентрированной серной кислоте:
CuS + 4H 2 SO 4(конц. гор.) = CuSO 4 + 4SO 2 + 4H 2 O
4) Сульфиды проявляют восстановительные свойства и окисляются пероксидом водорода, хлором и другими окислителями.
Сульфид свинца (II) окисляется пероксидом водорода до сульфата свинца (II):
PbS + 4H 2 O 2 = PbSO 4 + 4H 2 O
Сульфид меди (II) окисляется хлором:
СuS + Cl 2 = CuCl 2 + S
5) Обжиг сульфидов. При этом образуются оксиды металла и серы (IV).
2CuS + 3O 2 = 2CuO + 2SO 2
2Cr 2 S 3 + 9O 2 = 2Cr 2 O 3 + 6SO 2
2ZnS + 3O 2 = 2SO 2 + ZnO
6) Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S 2−
Сульфиды свинца, серебра и меди — черные осадки, нерастворимые в воде и минеральных кислотах:
Na 2 S + Pb(NO 3 ) 2 = PbS↓ + 2NaNO 3
Na 2 S + 2AgNO 3 = Ag 2 S↓ + 2NaNO 3
Na 2 S + Cu(NO 3 ) 2 = CuS↓ + 2NaNO 3
7) Необратимый гидролиз
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 S
Разложение происходит и при взаимодействии солей трехвалентных металлов с сульфидами щелочных металлов.
3Na 2 S + 2AlCl 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 S + 6NaCl
















