Что такое свойства веществ как взаимосвязаны свойства
Вещества и их свойства. Физические и химические явления.
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
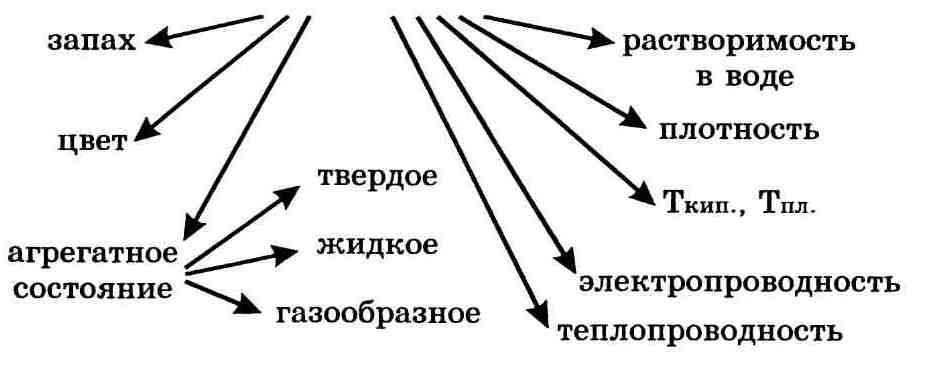
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
Что такое свойства веществ как взаимосвязаны свойства
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
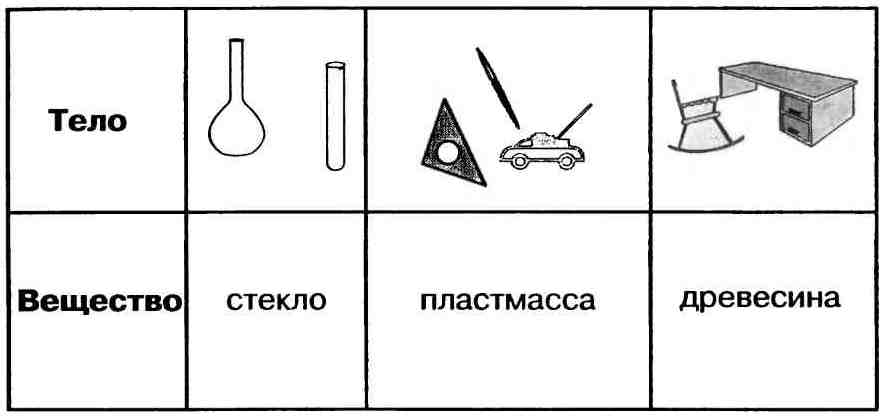
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
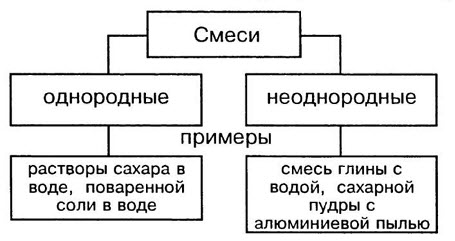
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
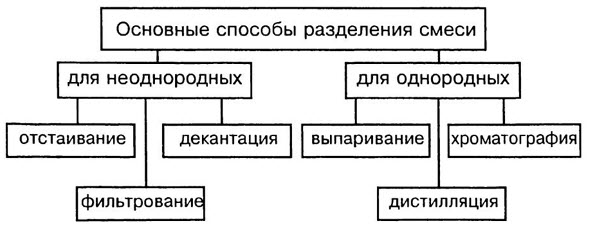
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Физические и химические свойства веществ
Различные вещества отличаются друг от друга своими свойствами.
Свойства вещества — это признаки, по которым одно вещество отличается от других веществ или сходно с ними.
Пример. Сходства и отличия между водой и ацетоном на примере трёх свойств:
| Свойства | Вещества | |
|---|---|---|
| Вода | Ацетон | |
| Температура кипения | 100 °C | 56 °C |
| Цвет | нет | нет |
| Запах | нет | есть |
Свойства вещества делятся на физические и химические.
Физические свойства вещества — это свойства вещества, которые можно определить наблюдением, измерением или экспериментальным путём, без его превращения в другое вещество.
Пример. Вода не имеет цвета, вкуса, запаха, в зависимости от окружающих условий может находиться в одном из трёх агрегатных состояний — жидком, твёрдом или газообразном. Цвет, запах, вкус, агрегатное состояние при определённых температуре и давлении — физические свойства.
Физические свойства вещества зависят от его агрегатного состояния.
Пример. Плотность льда, воды и водяного пара различна. Газообразный кислород бесцветный, а жидкий — голубой.
Химические свойства вещества — это свойства вещества, которые проявляются в химических реакциях.
Пример. Вода при очень высокой температуре разлагается на водород и кислород. Вода вступает в химическую реакцию с натрием, при этом образуются гидроксид натрия и водород. Железо окисляется при нагревании на воздухе или в токе кислорода, или при высокой влажности воздуха. Способность окисляться, вступать в химическую реакцию с другими веществами и разлагаться — химические свойства.
Для установления свойств вещества необходимо брать его с минимально возможным количеством примесей. Иногда даже очень малое содержание примеси может привести к сильному изменению некоторых свойств вещества.
Пример. Содержание в цинке лишь сотых долей процента железа или меди ускоряет его взаимодействие с соляной кислотой в сотни раз.
Изучить вещество — это значит узнать его свойства, описать из чего и как оно построено.
ВЗАИМОСВЯЗЬ СТРОЕНИЯ,
СВОЙСТВ И ПРИМЕНЕНИЯ ВЕЩЕСТВ
Урок химии – «сократовская беседа»
Цель урока. Формирование результативного естественно-научного мышления через активизацию представлений о взаимосвязи строения веществ с их химическими и физическими свойствами и обусловленности применения веществ их свойствами.
1. Актуализировать такие основополагающие понятия курса химии, как «предмет химии», «вещество», «физическое тело», «химическая реакция», «химическое строение».
2. Способствовать развитию мобильности мышления через применение в конкретных ситуациях знаний из различных разделов курса химии средней школы.
3. Развить умение участвовать в проблемном диалоге.
4. Содействовать развитию общей эрудиции учащихся и познавательного интереса.
Методы и приемы. Практические – эвристический диалог, разбор проблемных ситуаций, решение экспериментальных задач.
Оборудование и реактивы: металлический штатив, мерная колба, кристаллизатор, два химических стакана, пробирки, спиртовка, держатель; сухие (NH4)2SO4 и Ca(OH)2, вода, фенолфталеин, растворы глюкозы, аммиака, йода, щелочи, CuSO4, концентрированная соляная кислота, крахмальный клейстер.
Тип урока: обобщающий.
ХОД УРОКА
Оргмомент
Учитель. Ребята! Тема сегодняшнего урока – «Взаимосвязь строения, свойств и применения веществ». Урок мы проведем в форме «сократовской беседы». Великий мыслитель древности Сократ считал, что лучший способ познания – проблемный вопрос и меткий ответ. Своих учеников Сократ учил находить проблему в окружающем мире, выражать ее в виде конкретных вопросов и совместными усилиями искать ответы. Сегодня мы попробуем поработать в режиме проблемного диалога, как ученики Сократа.
Активизация учащихся
Учитель. Чтобы разбудить мысль и разговориться, давайте быстро ответим на ряд вопросов. Что есть химия?
Ученик. Наука о веществах, их строении, свойствах и превращениях в другие вещества. Такие превращения называются химическими реакциями.
Учитель. Что такое вещество?
Ученик. То, из чего состоят физические тела, которые нас окружают.
Учитель. В чем суть химических реакций в соответствии с атомно-молекулярным учением?
Ученик. Разрушение молекул исходных веществ до атомов и формирование из этих же атомов новых молекул. Взаимодействие неизменных молекул вещества между собой определяет его физические свойства, способность молекул превращаться в другие молекулы определяет его химические свойства.
Учитель. Что такое атом?
Ученик. Мельчайшая химически неделимая частица вещества.
Учитель. Что такое молекула?
Ученик. Мельчайшая частица вещества, обладающая всеми его химическими свойствами.
Учитель. Что означает слово «химия»?
Ученик. Слово «химия» происходит, возможно, от названия Древнего Египта «Хем» («темный», «черный») – очевидно, по цвету почвы в долине реки Нил. Это особенно плодородная земля, образовывающаяся после разливов Нила, дающая несколько урожаев в год. Смысл «приносить новое, улучшать качество» заложен в названии науки о веществах.
Учитель. Попробуйте представить себя в I в. н. э. Какими сведениями по химии располагали тогда люди?
Ученик. Это выплавка металлов из руд, красители на основе природных пигментов, лекарства, «изгоняющие болезнь»: мочегонные, потогонные, рвотные, слабительные.
Учитель. С первых этапов существования химии первостепенный интерес вызывали вещества, находящие применение в жизнедеятельности человека. А применение основано на конкретных свойствах веществ. Вы находитесь на заключительном этапе изучения химии. От чего, с вашей точки зрения, зависят свойства веществ?
Ученик. Прежде всего свойства зависят от качественного и количественного состава веществ и химического строения. Качественный состав веществ – из каких элементов состоит вещество. Количественный состав веществ – сколько атомов каждого химического элемента входит в состав одной молекулы вещества. Химическое строение – порядок связи атомов в молекуле с учетом их взаимного влияния и тип химической связи.
Учитель. Никто из вас никогда не держал в руках вещество RbF. Но для вас не составит труда определить тип химической связи – ионная, т. к. типичный металл связан с типичным неметаллом. Все ионные соединения проявляют ряд сходных физических свойств. Какие это свойства?
Ученик. Ионные соединения твердые, не имеют запаха, с высокими температурами плавления и кипения, их растворы и расплавы электропроводны. Все это в полной мере соответствует фториду рубидия.
Основная часть «сократовской беседы»
Учитель. Какие примеры взаимосвязи строения, свойств и применения веществ можете привести вы?
Если учащиеся затрудняются ответить, предложите им прокомментировать логические ряды:
карбин 



Электронный газ заполняет все пустоты в кристаллической решетке 

Клубкообразные молекулы удлиняются под действием приложенной силы без разрыва 
Трехмерная структура подобна кристаллической 
Гидрофобный углеводородный «хвост» по принципу «подобное растворяется в подобном» связывает неполярные загрязнения, а гидрофильная карбоксильная группа аналогично связывает полярные загрязнения и образует водородные связи с молекулами воды 
Учитель (комментарий учителя или подготовленное к уроку сообщение учащихся). Особое значение имеет то, что жизнь на Земле – это химия, реакции с участием белков, нуклеиновых кислот, углеводов и жиров – это химические основы физиологических процессов. Именно вещества и химические реакции – носители жизни в том варианте, в котором она развивается на нашей планете. Все, что с нами происходит, – великие мысли, глубокие чувства, благородные порывы и прочее – это результат биохимических реакций. Проиллюстрируем сказанное на примере того, как у нас возникают ощущения запахов.
Ученый Дж.Эймур создал «стереохимическую» теорию запахов, согласно которой есть семь первичных запахов: эфирный, камфарный, мускусный, цветочный, мятный, острый и гнилостный. Первые пять запахов определяются формой молекул, соответствующей форме обонятельных рецепторов, как ключ соответствует замку, который он отпирает.


 [Cu(NH3)4](OH)2.
[Cu(NH3)4](OH)2.