Что такое валентные возможности атома
Валентные возможности атомов химических элементов
Понятие валентность происходит от латинского слова «valentia» и было известно еще в середине XIX века. Первое «пространное» упоминание валентности было еще в работах Дж. Дальтона, который утверждал, что все вещества состоят из атомов, соединенных между собой в определенных пропорциях. Затем, Франкланд ввел само понятие валентности, которое нашло дальнейшее развитие в трудах Кекуле, который говорил о взаимосвязи валентности и химической связи, А.М. Бутлерова, который в своей теории строения органических соединений связывал валентность с реакционной способностью того или иного химического соединения и Д.И. Менделеева (в Периодической системе химических элементов высшая валентность элемента определяется номером группы).
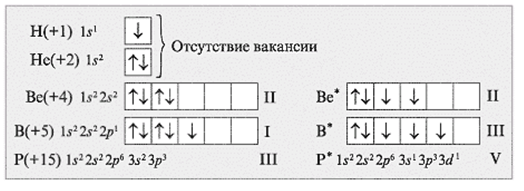
Валентность элемента определяется числом неспаренных электронов атоме, поскольку они принимают участие в образовании химической связи между атомами в молекулах соединений.
Основное состояние атома (состояние с минимальной энергией) характеризуется электронной конфигурацией атома, которая соответствует положению элемента в Периодической системе. Возбужденное состояние – это новое энергетическое состояние атома, с новым распределением электронов в пределах валентного уровня.
Графические электронные формулы
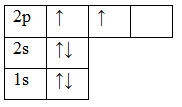
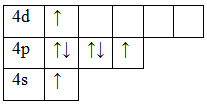
Электронные конфигурации электронов в атоме можно изобразить не только в виде электронных формул, но и с помощью электронно-графических формул (энергетических, квантовых ячеек). Каждая ячейка обозначает орбиталь, стрелка – электрон, направление стрелки (вверх или вниз) показывает спин электрона, свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении. Если в ячейке 2 электрона, такие электроны называются спаренными, если электрон 1 – неспаренный. Например:
Орбитали заполняют следующим образом: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку на 2p подуровне три орбитали с одинаковой энергией, то каждый из двух электронов занял по одной орбитали. Одна орбиталь осталась свободной.
Определение валентности элемента по электронно-графическим формулам
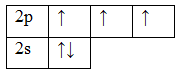
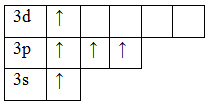
Валентность элемента можно определить по электронно-графическим формулам электронных конфигураций электронов в атоме. Рассмотрим два атома – азота и фосфора.
Т.к. валентность элемента определяется числом неспаренных электронов, следовательно, валентность азота равна III. Поскольку у атома азота нет свободных орбиталей, для этого элемента невозможно возбужденное состояние. Однако III, не максимальная валентность азота, максимальная валентность азота V и определяется номером группы. Поэтому, следует запомнить, что с помощью электронно-графических формул не всегда можно определить высшую валентность, а также все валентности, характерные для этого элемента.
15P 1s 2 2s 2 2p 6 3s 2 3p 3
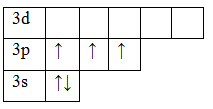
В основном состоянии атом фосфора имеет 3 неспаренных электрона, следовательно, валентность фосфора равна III. Однако, в атоме фосфора имеются свободные d-орбитали, поэтому электроны, находящиеся на 2s – подуровне способны распариваться и занимать вакантные орбитали d-подуровня, т.е. переходить в возбужденное состояние.
Теперь атом фосфора имеет 5 неспаренных электронов, следовательно для фосфора характерна и валентность, равная V.
Элементы, имеющие несколько значений валентности
Элементы IVA – VIIA групп могут иметь несколько значений валентности, причем, как правило, валентность изменяется ступенчато на 2 единицы. Такое явление обусловлено тем, что в образовании химической связи электроны участвуют попарно.
В отличие от элементов главных подгрупп, элементы В-подгрупп, в большинстве соединений не проявляют высшую валентность, равную номеру группы, например, медь и золото. В целом, переходные элементы проявляют большое разнообразие химических свойств, которое объясняется большим набором валентностей.
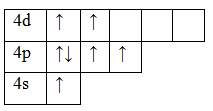
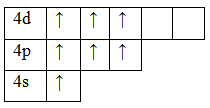
Рассмотрим электронно-графические формулы элементов и установим, в связи с чем элементы имеют разные валентности (рис.1).
Задания: определите валентные возможности атомов As и Cl в основном и возбужденном состояниях.
Ответы:
33As 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3
Основное состояние. Валентность равна III.
Возбужденное состояние. Валентность равна V.
17Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Основное состояние. Валентность равна I.
Возбужденное состояние 1. Валентность равна III.
Возбужденное состояние 2. Валентность равна IV.
Возбужденное состояние 3. Валентность равна VII.
Электроотрицательность. Степень окисления и валентность химических элементов
Содержание:
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Для определения валентности применяются определенные правила:
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
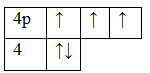
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
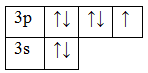
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
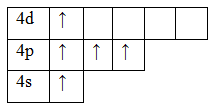
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Валентность
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Следовательно, литий может образовывать одну связь и валентность лития I.
+4Be * 1s 2 

Таким образом, на внешнем э нергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Электронная конфигурация атома бора в основном состоянии +5B 1s 2 2s 2 2p 1 :
+5B 1s 2 

+5B 1s 2 

Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Валентные возможности атомов
Всего получено оценок: 347.
Всего получено оценок: 347.
Количество ковалентных связей, которые может образовывать атом, называется валентностью элемента. Валентные возможности атомов обусловлены наличием валентных электронов на внешнем энергетическом уровне.
Строение атома
Все элементы планеты образованы атомами. Это мельчайшие частицы, состоящие из положительно заряженного ядра и отрицательно заряженных электронов. Ядро включает протоны и нейтроны. Электроны, притягиваемые ядром, располагаются и движутся по орбиталям на разном расстоянии от центра. Неравномерное положение электронов относительно ядра называется энергетическими уровнями.
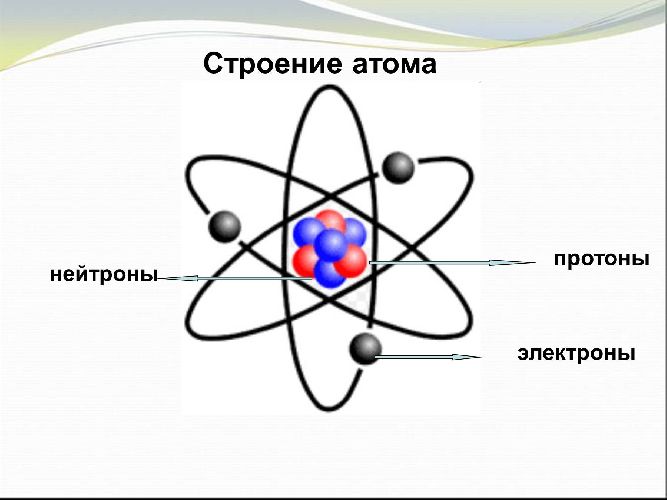
В таблице Менделеева высшая валентность соответствует номеру группы, в которой находится элемент. Количество энергетических уровней совпадает с номером периода, электронов – с порядковым номером.
Валентные возможности
Чтобы оценить валентные возможности атомов химических элементов, необходимо подробно рассмотреть распределение электронов на энергетических уровнях.
Валентность соответствует числу неспаренных электронов, располагающихся на s- и р-орбиталях внешнего энергетического уровня. Валентные электроны атомов элементов, входящих в побочные группы периодической таблицы, располагаются на s-орбитали внешнего уровня и d-орбиталях, образующих внешний подуровень.
В обычном (стационарном) состоянии электроны занимают определённое положение в атоме. Стационарная электронная конфигурация зафиксирована в таблице Менделеева. При возбуждённом состоянии (реакции с другими элементами) энергия атома перераспределяется, и электроны меняют своё положение.
Фосфор находится в V группе, главной подгруппе. Это значит, что в атоме находится пустой d-подуровень. В возбуждённом состоянии спаренные электроны s-уровня распариваются, и один электрон переходит на d-подуровень. Образуется пять свободных, неспаренных электронов. Соответственно, атом фосфора приобретает пятую валентность.
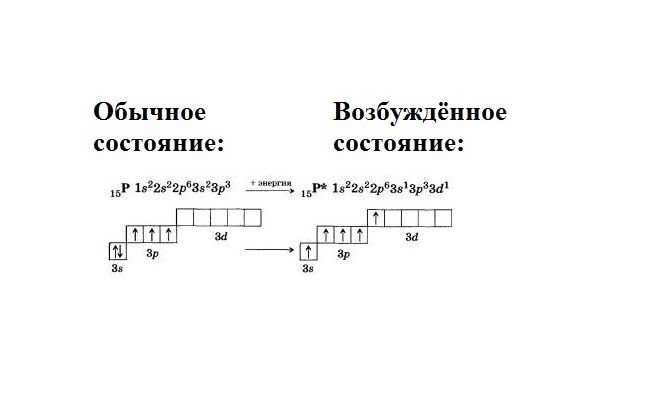
Распаривание происходит с затратой энергии. Расход энергии компенсируется образованием ковалентных связей с высвобождением энергии.
В зависимости от возможности переходить в возбуждённое состояние элементы делятся на две группы: с переменной и постоянной валентностью. Постоянную валентность (соответствует номеру группы) имеют щелочные, щелочноземельные металлы, фтор и алюминий. Переменная валентность присуща всем остальным элементам. Инертные газы не вступают в реакции, поэтому считается, что валентность у них отсутствует.
Что мы узнали?
Валентность показывает, сколько атомов может присоединить элемент посредством ковалентных связей. Значение валентности совпадает с количеством электронов на внешнем энергетическом уровне и соответствует номеру группы периодической таблицы, в которой находится элемент. Из-за возможности переходить в возбуждённое состояние большинство элементов имеют непостоянную валентность. Одинаковую валентность в любом состоянии сохраняют активные металлы и фтор.
Валентные возможности атомов химических элементов.
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
2. ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ
АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Структура внешних энергетических уровней атомов химических элементов определяет в основном свойства их атомов. Эти уровни называют валентными. Электроны внешних уровней (иногда и предвнешних) принимают участие в образовании химических связей. Такие электроны также называют валентными.
Валентность – это способность атомов химических элементов образовывать определенное число химических связей.
Валентные возможности атомов определяются двумя способами:
Числом неспаренных электронов, которые участвуют в образовании связи по обменному механизму:
в стационарном (основном) состоянии;
в возбужденном состоянии.
Рассмотрим валентные возможности атома углерода.
Схема строения атома углерода:
6 С +6 ) 2 ) 4
(атом получил дополнительную энергию)
Валентность атома углерода в основном состоянии равна ____.
Валентность атома углерода возбужденном состоянии равна ______.
Числом неподеленных электронных пар, способных участвовать в образовании химической связи по донорно-акцепторному механизму.
Рассмотрим валентные возможности атома азота.
Схема строения атома азота:
7 N +7 ) 2 ) 5
(атом получил дополнительную энергию)
Не характерно, так как на втором уровне нет больше свободных орбиталей и спаренные электроны не могут распариваться.
Неспаренные электроны участвуют в образовании химической связи по обменному механизму.
В этом случае валентность азота равна III.
Неподеленная пара электронов участвует в образовании химической связи по донорно-акцепторному механизму.
Тогда валентности увеличивается еще на единицу и будет равна IV.
Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1363180
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
До конца 2024 года в РФ построят около 1 300 школ
Время чтения: 1 минута
Исследования вакцины для детей младше 12 лет начнутся с 2022 года
Время чтения: 1 минута
Апробацию новых учебников по ОБЖ завершат к середине 2022 года
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
ВПР для школьников в 2022 году пройдут весной
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.