Что такое вид элемента
Автор текста Анисимова Е.С. Из курса лекций по химии.
Типы атомов. Химические элементы.
Что такое химический элемент.
Теперь обсудим вопрос о количестве протонов в атомах.
В природе есть атомы с одним протоном, с двумя, с тремя и т.д. – примерно до ста протонов. (114).
Атомы с одним протоном в каждом – это одна группа атомов, один тип атомов.
Атомы с двумя протонами в каждом – другая группа атомов, другой тип атомов.
Атомы с одинаковым числом протонов в каждом считаются атомами одного ТИПА.
Атомы с разным числом протонов в каждом считаются атомами разных типов.
Разные типы атомов (атомы разных типов) отличаются числом протонов.
Химический элемент
Ещё раз. Элемент водород – это не один атом водорода,
а все атомы с одним протоном в каждом,
то есть весь элемент, вся группа атомов с одним протоном.
Правильное название атома из группы атомов с одним протоном –
«атом химического элемента «водород»».
Или короче – «атом водорода».
Хотя часто атом водорода называют просто водородом, имея в виду «атом элемента водород».
Но вообще-то это неточное название, а самое главное –
оно может запутать тех, кто не знает разницы между атомом и элементом.
Более того, атомы водорода могут соединяться между собой по два:
такие соединения из двух атомов водорода называют молекулами водорода.
Но часто молекулы водорода называют просто водородом, то есть так же, как элемент. Что может запутывать ещё больше.
Читая про элемент водород, люди могут думать, что речь про молекулу водорода или наоборот.
Поэтому очень важно не путать названия элементов
с точно такими же названиями молекул (подробнее далее) или атомов.
Нужно понимать разницу между атомами и элементами и всегда сообщать слушателям (чтобы не запутать их),
какой водород имеется в виду – элемент, атом или молекула.
Говоря не просто «водород», а «элемент водород», «атом водорода» или «молекула водорода».
Даже если это как бы понятно из контекста.
«Просто водородом» допустимо называть разве что элемент водород –
например, во фразах типа «водород относится к неметаллам».
Но называть атом водорода просто водородом – всё равно что яблоко называть фруктами. Именно – не фруктом, а фруктами.
Также, встречая слово «водород», нужно самим задаться вопросом –
о каком водороде идёт речь – о молекуле, атоме или элементе.
Иначе понимание текста может быть ошибочным.
Теперь увеличим таблицу, добавив элементы и примеры веществ из их атомов.
А ещё – заряд ядра, который всегда равен числу протонов, так как ими и создаётся, а заряд одного протона равен единице.
Таблица «Первые 10 элементов»:
Число протонов
в атоме этого типа Заряд
ядра
атома Номер
элемента Число электронов
в атомах элемента Названия
элементов Символ
элемента
или его атома Вещества
из
атомов
элемента
Один +1 №1 (первый) 1 Элемент
Водород Н Молекула из двух атомов водорода
Н2
Два +2 №2 (второй) 2 Элемент
Гелий Не Атом гелия Не
Три +3 №3 (третий) 3 Элемент
Литий Li Атом лития
Li
Четыре +4 №4 (четвёртый) 4 Элемент
Бериллий Ве Атом
бериллия
Пять +5 №5 (пятый) 5 Элемент
Бор В Атом
бора
Шесть +6 №6 6 Элемент
Углерод С Атом углерода
С
Семь +7 №7 7 Элемент
Азот N Молекула из двух атомов азота
N2
Восемь +8 №8 8 Элемент
кислород O Молекула из двух атомов кислорода
О2
Девять +9 №9 9 Элемент
Фтор F Молекула из двух атомов фтора
F2
Десять +10 №10 10 Элемент
Неон Ne Атомы неона
11 +11 №11 11 Элемент
Натрий Na Атомы
натрия
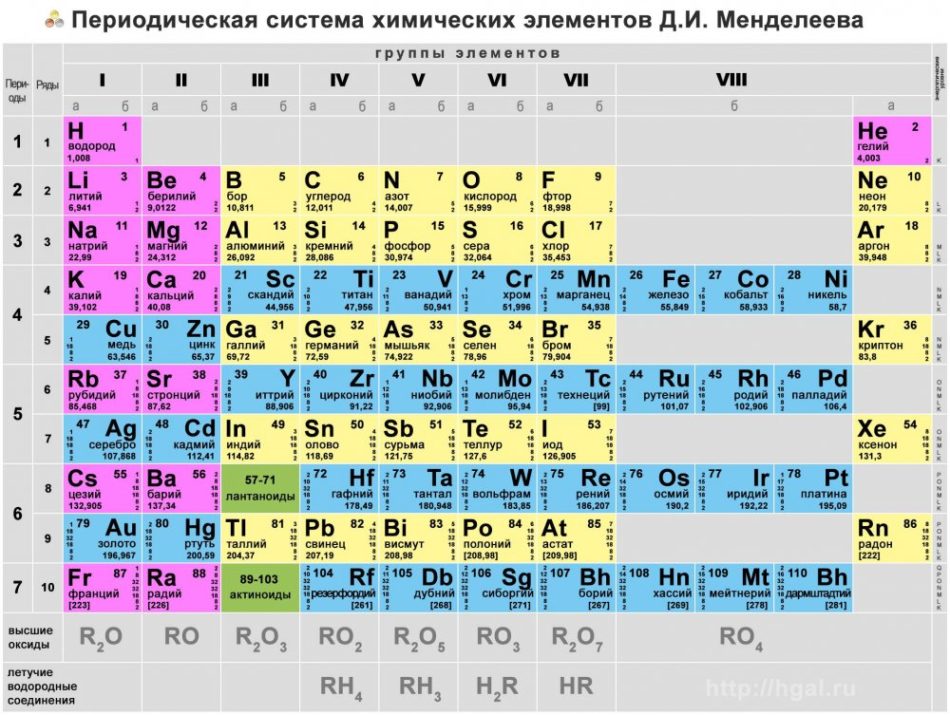
Сотня химических элементов расставлены в специальной таблице,
которую называют периодической системой химических элементов Менделеева
или просто таблицей Менделеева (ТМ).
О ней см. отдельный файл.
Познание мира
10 типов химических элементов
Типы химических элементов
В природе можно найти самые разные вещества. Эти вещества обычно не встречаются в чистом виде, а являются результатом комбинации различных элементов или материалов, которые в результате различных реакций, процессов и периодов времени дали начало всем видам материи. Во Вселенной нет ничего, что не являлось бы результатом комбинации атомов, принадлежащих к разным типам химических элементов, которые мы собираемся изучить более подробно.
Однако, прежде чем рассматривать типы химических элементов, давайте сделаем небольшой обзор школьной науки и вспомним, что такое химические элементы.
Мы называем «химическим элементом» материю, которая состоит из одного и того же типа атома, то есть вещества, которое является атомарно чистым. Химические элементы не могут быть разложены на более простые и классифицируются в периодической таблице элементов как чистые материалы Вселенной.
Мы не должны путать элементы с простыми веществами, поскольку в некоторых случаях два или более атомов одного и того же элемента могут составлять молекулы, сгруппированные по-разному, что приводит к изменению некоторых физических свойств рассматриваемого элемента, в этих случаях изотопов. Например, алмаз и углерод — это вещества, состоящие из химического элемента углерода (C), но который организован по-разному и приводит к образованию двух совершенно разных материалов.
Насколько нам известно, химические элементы образуются внутри звезд в результате сложных процессов синтеза и деления атомов, в результате которых образуются все более тяжелые элементы, результат процесса, называемого нуклеосинтезом.
Большинство известных элементов могут быть получены из природы, спонтанно обнаружены или образуют соединения с другими элементами, такими как уран (U), углерод (C), кремний (Si), серебро (Ag) или золото (Au). Другие, однако, производятся в лабораториях, например, америций (Am), берклий (Bk) или кюрий (Cm). Каким бы ни был метод его получения или присутствует ли он в природе, в зависимости от его свойств, рассматриваемый химический элемент будет иметь то или иное применение.
В настоящее время известно около 118 химических элементов, хотя с учетом того, что люди смогли производить новые элементы, расширение таблицы Менделеева — это вопрос времени.
Основные типы химических элементов
Основные типы химических элементов представлены в периодической таблице, системе классификации, созданной русским химиком Дмитрием Менделеевым (1834–1907), заложившим ее основы в 1869 году. Химические элементы визуально упорядочены в зависимости от их свойств и характеристик.
С течением времени и по мере того, как химия сделала важные научные открытия, эта таблица будет последовательно расширяться, достигнув той формы, которую она имеет сегодня, с 118 известными до сих пор элементами.
В настоящее время в этой таблице мы можем найти следующие типы химических элементов:
Металлы
Металлы — это химические элементы, которые, как правило, содержат от одного до трех электронов на последней орбите своего атома, электроны, которые можно легко переносить, превращая их в проводники тепла и электричества.
Металлы обычно податливы и пластичны, с характерным блеском, интенсивность которого зависит от движения электронов, составляющих их атомы. В большинстве случаев металлы остаются твердыми при комнатной температуре, за исключением ртути.
Среди металлов мы находим золото (Au), серебро (Ag), медь (Cu) и алюминий (Al), физические характеристики которых делают их великолепными проводниками электричества, хотя их присутствие в природе очень разнообразно, что отражается в разнице между их массами.
Считается, что 75% химических элементов, существующих в природе — это металлы, а остальные 25% будут состоять из благородных газов, металлоидов и других типов.
В этой категории есть классификации, обнаруживающие актиниды, лантаноиды, переходные металлы, щелочные металлы, щелочноземельные металлы и другие металлы.
Лантаноиды
Элементы лантаноидов находятся в месторождениях, состоящих из многих минералов. Это металлы белого цвета, которые легко окисляются при контакте с воздухом. Среди них мы находим лантан (La), прометий (Pm), европий (Eu) и иттербий (Yb).
Актиниды
Все изотопы актинидов радиоактивны. Среди них мы находим актиний (Ac), уран (U), плутоний (Pu) и эйнштейний (Es).
Переходные металлы
В этой группе есть вещества всех видов, и, согласно ее самой широкой классификации, она будет соответствовать химическим элементам от 21 до 30, от 39 до 48, от 71 до 80 и от 103 до 112, всего сорок и среди них мы найдем ванадий (V), рутений (Ru), серебро (Ag), тантал (Ta) и лоуренсий (Lr).
Щелочные металлы
Щелочные металлы — это группа из шести элементов, состоящая из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Это блестящие мягкие металлы, обладающие высокой реакционной способностью при нормальной температуре и давлении и легко теряющие внешний электрон, расположенный на своей «s» орбитали.
Щелочные почвы
Щелочноземельные металлы — это группа элементов, в которых мы находим бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Щелочные почвы тверже щелочей, они блестят и являются хорошими проводниками электричества. Они менее реактивны, чем щелочные, и действуют как хорошие восстановители. Они обладают способностью образовывать ионные соединения, и все они имеют два электрона на внешней оболочке.
Другие металлы
Это металлические элементы, расположенные в периодической таблице вместе с металлоидами внутри p-блока. Они имеют тенденцию быть мягкими с низкими температурами плавления. Среди них алюминий (Al), индий (In), олово (Sn) и висмут (Bi) среди других.
Не металлы
Неметаллы обычно имеют от пяти до семи электронов на последней орбите, свойство, которое заставляет их приобретать электроны, а не отдавать их, и, таким образом, им удается иметь восемь электронов, которые таким образом стабилизируют их как атомы.
Эти элементы очень плохо проводят тепло и электричество. К тому же они не имеют характерного блеска, не очень пластичны и очень хрупки в твердом состоянии. Их нельзя катать или растягивать, в отличие от металлов.
Большинство из них необходимы для биологических систем, поскольку они присутствуют в органических соединениях, таких как сера (S), углерод (C), кислород (O), водород (H) и йод (I).
Металлоиды
Металлоиды представляют собой промежуточную классификацию между металлами и неметаллами, обладающими свойствами обеих групп. Это связано с тем, что на последней орбите у них четыре атома, что является промежуточным количеством по сравнению с металлами и неметаллами.
Эти химические элементы проводят электричество только в одном направлении, но не в обратном, как в металлах. Примером этого является кремний (Si), металлоид, используемый в производстве полупроводниковых элементов для электронной промышленности благодаря этому свойству.
Другие металлоиды: бор (B), мышьяк (As), сурьма (Sb) и полоний (Po).
Галогены
Галогены — это группа из шести элементов, которые имеют тенденцию образовывать молекулы, состоящие из двух (двухатомных) атомов, которые очень химически активны из-за своей электроотрицательности.
Эти вещества обычно появляются в виде ионов, то есть электрически заряженных молекул, которые в данном случае являются однозначными, сильно окисляющими. Это означает, что галогены являются едкими веществами.
Галогены: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и тенезе (Ts).
Благородные газы
Благородные газы — это группа из семи газов, естественное состояние которых — газообразное. Обычно они представляют собой двухатомные молекулы с очень низкой реакционной способностью, то есть они не вступают в реакцию с другими элементами, составляющими другие вещества, и по этой же причине они известны как инертные газы. Это потому, что на его последней орбите находится максимальное количество электронов, возможное для этого уровня, всего восемь.
Эта избранная группа элементов состоит из гелия (He), неона (Ne), аргона (Ar), криптона (Kr), ксенона (Xe), радона (Rn) и оганесона (Og), ранее известного как унунокций.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Типы химических элементов
Все элементы периодической системы подразделяются на четыре типа:
1. У атомов s–элементов заполняются s–оболочки внешнего слоя (n). К s–элементам относятся водород, гелий и первые два элемента каждого периода.
2. У атомов р–элементов электронами заполняются р–оболочки внешнего уровня (np). К р-элементам относятся последние 6 элементов каждого периода (кроме первого).
3. У d–элементов заполняется электронами d–оболочка второго снаружи уровня (n–1)d. Это элементы вставных декад больших периодов, расположенных между s– и p–элементами.
4. У f–элементов заполняется электронами f–подуровень третьего снаружи уровня (n–2)f. К семейству f–элементов относятся лантаноиды и актиноиды.
Из рассмотрения электронной структуры невозбужденных атомов в зависимости от порядкового номера элемента следует:
1. Число энергетических уровней (электронных слоев) атома любого элемента равно номеру периода, в котором находится элемент. Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах.
2. Номер периода совпадает с главным квантовым числом внешних электронов атома.
3. s– и p–элементы образуют главные подгруппы, d–элементы – побочные подгруппы, f–элементы образуют семейства лантаноидов и актиноидов. Таким образом, подгруппа включает элементы, атомы которых обычно имеют сходное строение не только внешнего, но и предвнешнего слоя (за исключением элементов, в которых имеет место «провал» электрона).
4. Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы. У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних оболочек. Это является основным различием в свойствах элементов главных и побочных подгрупп.
5. Элементы с валентными d– или f–электронами называются переходными.
6. Номер группы, как правило, равен высшей положительной степени окисления элементов, проявляемой ими в соединениях. Исключением является фтор – его степень окисления равна –1; из элементов VIII группы только для Os, Ru и Xe известна степень окисления +8.
Химическая связь и типы взаимодействия молекул
Химическая связь – это взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую.
Основные характеристики связи:
Энергия связи (Е, кДж/моль) – количество энергии, выделяющееся при образовании химической связи. Чем больше энергия связи, тем устойчивее молекулы.
Длина связи – расстояние между ядрами химически связанных атомов.
Кратность связи – определяется количеством электронных пар, связывающих два атома. С увеличением кратности связи длина связи уменьшается, а прочность ее возрастает.
Валентный угол – угол между воображаемыми линиями, которые можно провести через ядра связанных атомов. Валентный угол определяет геометрию молекул.
Дипольный момент возникает, если связь образована между атомами элементов с разной электроотрицательностью и служит мерой полярности молекулы.
Ковалентная связь
Ковалентная связь образуется путем обобществления пары электронов двумя атомами. Особенностями ковалентной химической связи являются ее направленность и насыщаемость. Направленность обусловлена тем, что атомные орбитали имеют определенную конфигурацию и расположение в пространстве. Перекрывание орбиталей при образовании связи осуществляется по соответствующим направлениям. Насыщаемость обусловлена ограниченными валентными возможностями атомов.
Различают ковалентную полярную и неполярную связь. Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью; обобществленные электроны равномерно распределены между ядрами взаимодействующих атомов. Ковалентная полярная связь образуется между атомами с различной электроотрицательностью; общие электронные пары смещены в сторону более электроотрицательного элемента.
Возможны два механизма образования ковалентной связи: 1) спаривание электронов двух атомов при условии противоположной ориентации их спинов (обменный механизм); 2) донорно-акцепторное взаимодействие, при котором общей становится электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора).
Часто в образовании связи участвуют электроны разных подуровней, а, следовательно, орбитали разных конфигураций. В этом случае может происходить гибридизация (смешение) электронных облаков (орбиталей). Образуются новые, гибридные облака с одинаковой формой и энергией. Число гибридных орбиталей равно числу исходных. В гибридной атомной орбитали (АО) электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, приводящее к повышению энергии связи. Гибридизация АО определяет пространственную конфигурацию молекул.
Возможны также более сложные виды гибридизации с участием d и f-орбиталей атомов.
Ионная связь
Ионная связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Ее можно рассматривать как предельный случай ковалентной полярной связи. Такая связь возникает лишь в случае большой разности электроотрицательностей взаимодействующих атомов, например между катионами s-металлов I и II групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl, KBr и др.).
Так как электростатическое поле иона имеет сферическую симметрию, то ионная связь не обладает направленностью. Ей также не свойственна насыщаемость. Все ионные соединения в твердом состоянии образуют ионные кристаллические решетки, в узлах которых каждый ион окружен несколькими ионами противоположного знака. Чисто ионной связи не существует. Можно говорить лишь о доле ионности связи.
Металлическая связь
В отличие от ковалентных и ионных соединений, в металлах небольшое число электронов одновременно связывает большое число ядерных центров, а сами электроны могут перемещаться в металле. Таким образом, в металлах имеет место сильно нелокализованная химическая связь.
Биогенные элементы
Элементы, необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами.
HTML учебник. Бесплатные уроки HTML для начинающих разработчиков и веб-мастеров. Пробуем создать простой HTML сайт.
Виды HTML элементов: блочные элемент и строчные HTML элементы
Привет, посетитель сайта ZametkiNaPolyah.ru! Этой записью мы продолжаем рубрику: Верстка сайтов, в которой есть раздел HTML. Мы уже много говорили про особенности языка HTML и даже пытались сравнить структуру HTML со структурой HTTP протокола. Так же мы разбирались с тем, как браузер интерпретирует HTML документ. В этой записи мы на практике посмотрим, что делает браузер с HTML тэгами и ответим на вопросы: «что такое HTML элемент и для чего нужны HTML элементы?». Если вы поймете, как работает браузер с кодом HTML и поймете, принцип формирования HTML элементов, то вам не составит никакого труда разобраться с языком HTML.
Виды HTML элементов: блочные элемент и строчные HTML элементы
Как я уже говорил, в данной записи мы будем разбираться с HTML элементами. Вы узнаете о том, какие бывают HTML элементы, что характерно для строчных HTML элементов, а что характерно для блочных HTML элементов. Так же в конце данной записи вы найдете два примера того, как браузер показывает HTML элементы на странице.
Виды HTML элементов. Что такое HTML элемент?
Когда мы рассматривал синтаксис HTML и HTML тэги, мы уже упоминали HTML элементы. Давайте сперва ответим на вопрос: «Что такое HTML элементы?». Чтобы ответить на этот вопрос нужно немного понимать, как работает браузер. Когда браузер получает HTML документ, он считывает тэги, написанные в HTML документе, по этим тэгам он создает HTML страницу, которую пользователь видит на экране.
Всё, что вы видите на странице в области просмотра браузера – это HTML элементы. Таким образом мы выяснили разницу между HTML тэгами и HTML элементами: HTML элементы – это то, что пользователь видит на странице в браузере, а HTML тэги – это то, что разработчик пишет, когда создает HTML документ.
Обратите внимание: не все HTML тэги являются HTML элементами, например тэг DOCTYPE, который нужен для того, чтобы браузер понимал, как интерпретировать код документа, не является HTML элементом. Все тэги внутри заголовка HTML документа так же не являются HTML элементами. Но не стоит делать вывод о том, что HTML элемент – это то, что видит пользователь в области просмотра, некоторые HTML элементы могут быть намеренно скрыты при помощи таблиц стилей или HTML атрибутов.
HTML элементы делятся на два вида: блочные HTML элементы и строчные HTML элементы. Первые чаще всего используются для создания структуры HTML страницы (не стоит путать со структурой HTML документа), вторые чаще всего применяются для оформления и логического выделения контента на странице.
Эта запись поможет вам разобраться с тем, какая разница между строчными HTML элементами и блочными HTML элементами. Если вы поймете особенности работы строчных и блочных HTML элементов, то, можно будет сказать, что вы поняли, как работает HTML, и никаких проблем с дальнейшим его изучением не будет.
Блочные HTML элементы
Блочные HTML элементы чаще всего используются для создания структуры HTML страниц или для логического разбиения HTML документа на части. Типичным примером блочных HTML элементов являются:
Ключевой особенностью блочных HTML элементов является то, что ширина блочных HTML элементов по умолчанию (если не заданы какие-либо ограничивающие правила) определяется областью просмотра браузера или шириной HTML элемента, в которую вложен данный элемент. Другими словами: блочный HTML элемент занимает максимально возможную ширину. От этого эти элементы и получили название блочные. Или так: блочный HTML элемент по ширине занимает все доступное пространство.
Если HTML страницу представить, как стену, то блочный HTML элемент – это плита, ширина которой равняется ширине стены. Высота блочного HTML элемента равна высоте его содержимого плюс внутренние отступы блочного HTML элемента. Про внутренние отступы мы поговорим, когда начнем рассматривать CSS. Сейчас добавим, что если у блочного HTML элемента нет содержимого, то его высота равна нулю, но ширина равна ширине области, в которой данный элемент расположен.
Строчные HTML элементы
Строчные HTML элементы – это такие HTML элементы, ширина которых, равна ширине их содержимого. Если у строчного HTML элемента нет содержимого, то его ширина будет равна нулю. Ширина строчного HTML элемента зависит только от ширины его содержимого, поэтому строчные HTML элементы могут занимать несколько строк. Другими словами, строчные HTML элементы могут быть перенесены на новую строку.
Строчные HTML элементы идут друг за другом, это означает, что если закончился строчный HTML элемент, то в этой же строке может начаться следующий строчный HTML элемент. Опять же, если HTML страница это стена, то строчные HTML элемент – это кирпичи, из которых сделана стена.
В качестве примера строчных HTML элементов можно привести:
Высота строчных HTML элементов зависит только от высоты содержимого строчного HTML элемента. Итак, строчные HTML элементы не подстраиваются под область просмотра и нужны для оформления и выделения текста внутри HTML документа.
Примеры блочных HTML элементов
Мы разобрались с тем, что такое блочные HTML элементы и что собой они представляют, давайте теперь приведем несколько примеров блочных HTML элементов и посмотрим, как «ведут» себя блочные HTML элементы на странице. Для этого откройте редактор (можно даже блокнот) и создайте следующий HTML документа: