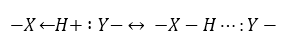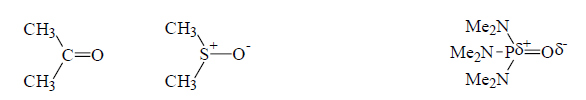Что такое внутримолекулярная водородная связь
Водородная связь
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородные связи возникают между следующими веществами:
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Что такое внутримолекулярная водородная связь
Основы строения вещества
Глава 14. Водородная связь
Межмолекулярная и внутримолекулярная водородная связь
Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи. Она может быть описана с помощью метода молекулярных орбиталей как трехцентровая двухэлектронная связь.
Межмолекулярная и внутримолекулярная водородная связь
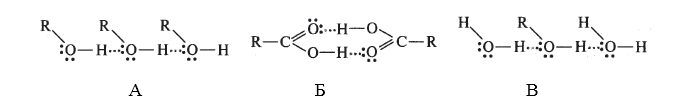
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений (рис. 42). Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
Аномалии свойств, обусловленные наличием водородной связи
Наличием водородных связей обусловлены уникальные свойства многих веществ, в том числе воды. Трехатомная молекула Н2О образует четыре водородные связи. В их образовании принимают участие оба атома водорода, а атом кислорода, имеющий две неподеленные электронные пары, образует две водородные связи с атомами водорода соседних молекул воды.
Если бы не было водородных связей, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов
Температуры кипения халькогеноводородов
| H2Te | H2Se | H2S | H2O | |
| tкип, o С | −2 | −42 | −60 | 100 |
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.
При плавлении льда около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание, с одной стороны, должно вызывать увеличение объема воды. Это происходит со всеми веществами.
Но, с другой стороны, водородные связи продолжают разрушаться, а это должно приводить к уменьшению объема воды. В результате плотность воды изменяется неравномерно. Наибольшее значение (1,00 г/мл) она имеет при температуре 4 o С. Такова зимняя температура вблизи дна пресноводных водоемов, где скапливается вода с максимальной плотностью.
Водородная связь
Вы будете перенаправлены на Автор24
Понятие водородная связь
Появление водородной связи предопределено исключительностью атома водорода. Атом водорода гораздо меньше, чем другие атомы. Электронное облако, образованное им и электроотрицательным атомом сильно смещено в сторону последнего. В результате ядро водорода остается слабоэкранированным.
Атомы кислорода гидроксильных групп двух молекул карбоновых кислот, спиртов или фенолов могут близко сходиться из-за образования водородных связей.
Положительный заряд ядра атома водорода и отрицательный заряд другого электроотрицательного атома притягиваются. Энергия их взаимодействия сопоставима с энергией прежней связи, поэтому протон оказывается связанным сразу с двумя атомами. Связь со вторым электроотрицательным атомом может быть более сильной, чем первоначальная связь.
Протон может передвигаться от одного электроотрицательного атома к другому. Энергетический барьер у такого перехода незначительный.
Водородные связи относятся к числу химических связей средней силы, но, если таких связей много, то они способствуют образованию прочных димерных или полимерных структур.
Готовые работы на аналогичную тему
Положительный конец диполя в гидроксильной группе находится у атома водорода, поэтому через водород может формироваться связь с анионами или электроотрицательными атомами, содержащими неподеленные электронные пары.
Рисунок 2. Ацетон, диметилсульфоксид (ДМСО), гексаметилфосфортриамид (ГМФТА)
Так как стерические препятствия отсутствуют, водородная связь образуется легко. Ее сила, в основном определяется тем, что она преимущественно имеет ковалентный характер.
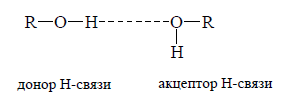
Обычно наличие водородной связи обозначают пунктирной линией между донором и акцептором, например, у спиртов
Как правило, расстояние между двумя атомами кислорода и водородной связи меньше суммы ван-дер-ваальсовых радиусов атомов кислорода. Должно присутствовать взаимное отталкивание электронных оболочек атомов кислорода. Однако силы отталкивания преодолеваются силой водородной связи.
Природа водородной связи
Значение межмолекулярной водородной связи
Водородные связи оказывают следующее влияние на соединения:
они обуславливают ассоциацию соединений (карбоновых кислот, спиртов), что приводит к появлению высоких температур кипения этих соединений;
Например: уксусная кислота даже в газовой фазе существует в виде димера.
сольватация соединений посредством образования водородных связей с растворителем существенно повышает их растворимость;
способствуют стабилизации ионизированных частиц в растворе, например межмолекулярные водородные связи в соединениях А,Б,В:
важны при формировании пространственной структуры нуклеиновых кислот, белков, полисахаридов и др. соединений;
участвуют в осуществлении ряда биохимических процессов (синтез мРНК, репликация ДНК);
обеспечивают связывание лекарственных препаратов с рецепторами и т.д.
Внутримолекулярные водородные связи
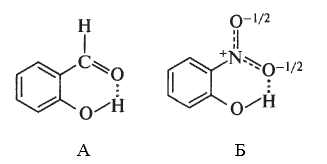
В случаях, когда возможно замыкание шестичленного или пятичленного цикла, образуются внутримолекулярные водородные связи.
Наличие внутримолекулярных водородных связей в салициловом альдегиде и о-нитрофеноле является причиной отличия их физических свойств от соответствующих мета- и пара-изомеров.
$o$-Нитрофенол является единственным из трех изомерных представителей нитрофенолов, который способен перегоняться с водяным паром. На этом свойстве основано его выделение из смеси изомеров нитрофенола, которая образуется в результате нитрования фенолов.
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
Характеристика водородной связи
Водородная связь характеризуется
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Водородная связь.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
2. Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.
Молекула салициловой кислоты.
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Примеры: вода в виде льда, йод, хлор, бром, «сухой лёд» (твердый диоксид углерода), твёрдый аммиак, а также твёрдые органические вещества (метан, бензол, фенол, нафталин, белки и т.д.).
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 о С) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.