Что такое водородное соединение
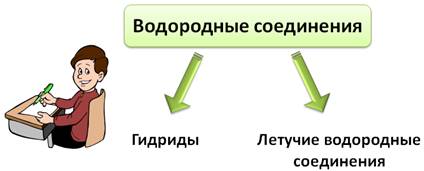
Гидриды
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водородные соединения разделяют на солеобразные гидриды и летучие водородные соединения.
Летучие водородные соединения НЭ – это соединения неметаллов с водородом. Степень окисления водорода равна +1.
| Летучие водородные соединения НЭ – это соединения неметаллов с водородом | Солеобразные гидриды ЭН – это соединения металлов IA, IIA групп и алюминия с водородом |
| Степень окисления водорода равна +1. Для солеобразных гидридов характерны некоторые свойства солей: гидролиз, обменные реакции и т.д. | |
| Элементы IVА гр.: ЭН4 (SiH4 – силан, CH4 – метан) Элементы VА гр.: ЭН3 (NH3 — аммиак, PH3 — фосфин, AsH3 – арсин, SbH3 – стибин) Элементы VIА гр.: Н2Э (Н2S – сероводород, H2Se – селеноводород, Н2Те – теллуроводород и т.д.) Элементы VIIА гр.: НЭ (НF – фтороводород, хлороводород и т.д.) | NaH – гидрид натрия, CaH2 – гидрид кальция и т.д. |
Стибин SbH3 (сурьмянистый водород) — неорганическое бинарное химическое соединение сурьмы с водородом, имеющее чесночный запах.
Арсин AsH3 (мышьяковистый водород, гидрид мышьяка) — гидрид мышьяка, химическое соединение мышьяка и водорода. При нормальных условиях — ядовитый бесцветный газ. Абсолютно чистый химически арсин запаха не имеет, но ввиду неустойчивости продукты его окисления придают арсину чесночный запах. Сильный восстановитель.
Водородная связь
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородные связи возникают между следующими веществами:
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Водородные соединения. Оксиды
Урок 19. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Водородные соединения. Оксиды»
Само название «водородные соединения» говорит о том, что в состав данных соединений входит водород. К таким соединениям относятся гидриды и летучие водородные соединения. Давайте разберемся, в чем их отличие.
Гидриды – это бинарные соединения металлов I и II A групп с водородом. Например: CaH2, NaH, BaH2, LiH. Все эти гидриды твердые, нелетучие, тугоплавкие вещества с ионным типом связи.
Летучие водородные соединения – это бинарные соединения неметаллов с водородом. Эти соединения могут быть как жидкостями (например, Н2О), так и газами (HCl, NH3).
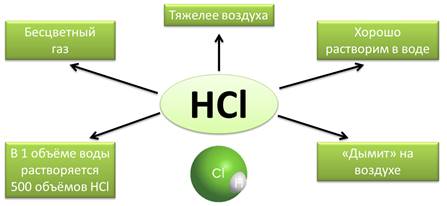
Рассмотрим свойства хлороводорода – HCl. Это бесцветный газ, тяжелее воздуха, хорошо растворим в воде. В 1 объёме воды растворяется 500 объёмов хлороводорода. Хлороводород «дымит» на воздухе, т.е. он поглощает пары воды из воздуха, образуя при этом туманное облако.
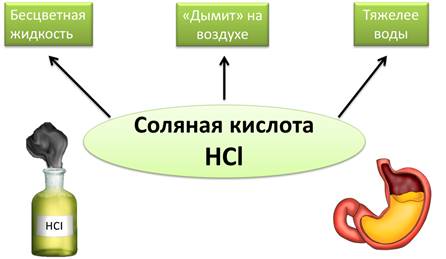
Раствор хлороводорода в воде называют соляной кислотой. Это бесцветная жидкость, «дымит» на воздухе, тяжелее воды. Соляная кислота содержится в желудочном соке человека и некоторых животных.
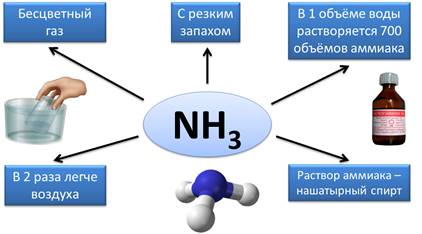
Известным и распространенным водородным соединением является аммиак – NH3. Аммиак является бесцветным газом, имеет резкий запах, в 1 объёме воды растворяется 700 объёмов аммиака, он почти в 2 раза легче воздуха. Раствор аммиака в воде называют нашатырным спиртом, который широко используют в медицине.
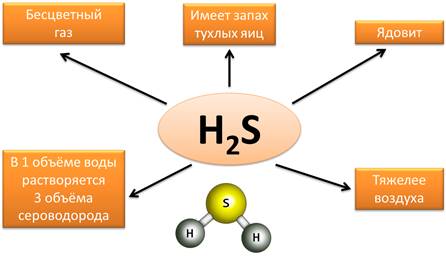
Сероводород – H2S – тоже известное летучее водородное соединение. Он является бесцветным газом, имеет запах тухлых яиц, ядовит, в 1 объеме воды растворяется 3 объёма сероводорода, он тяжелее воздуха.
В названии оксидов сначала указывают слово оксид в именительном падеже (от лат. названия кислорода – «оксигениум»), а затем название элемента в родительном падеже.
Например: CaO – оксид кальция, K2O – оксид калия, Al2O3 – оксид алюминия. А если элемент имеет несколько степеней окисления или переменную валентность, то после названия оксида в скобках римскими цифрами указывают численное значение степени окисления. Например: Fe2O3 – оксид железа (III) (читается: «оксид железа три»), CuO – оксид меди (II) (читается: «оксид меди два»), CrO3 – оксид хрома (VI) (читается: «оксид хрома шесть»).
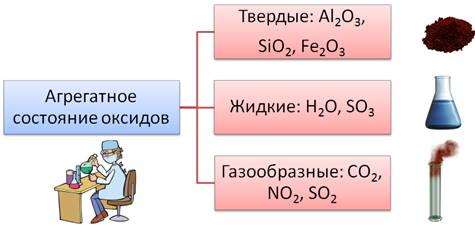
По агрегатному состоянию оксиды делят на твёрдые: к ним относятся такие оксиды, как Al2O3, SiO2, Fe2O3 и др., жидкие оксиды – это H2O, SO3, газообразными являются такие оксиды, как СО2, NO2, SO2 и др.
Познакомимся с вами с наиболее важными оксидами.
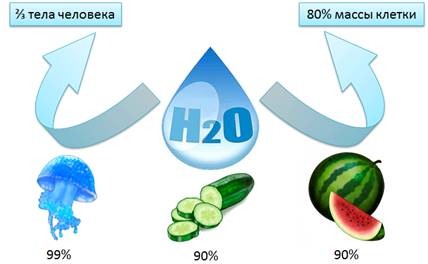
Вода – Н2О – самое распространенное и самое необходимое вещество на планете. Почти ¾ поверхности земного шара занято водой. Однако, это вода морей и океанов, которая является солёной. Она непригодна для питья, для сельского хозяйства, для промышленности. Кроме того, тело человека на 2/3 состоит из воды. Вода составляет до 80% массы клетки и выполняет важные функции: защитную, транспортную и др. У некоторых медуз вода занимает почти 99% от массы тела. Содержание воды в огурцах и арбузах превышает 90%. Большинство реакций и процессов в различных отраслях промышленности тоже протекают в растворах. Однако запасы пресной воды малы, всего 3% от общего объёма, поэтому нужно беречь и экономить воду. Без воды невозможно представить жизнь человека, который потребляет ее для бытовых нужд.
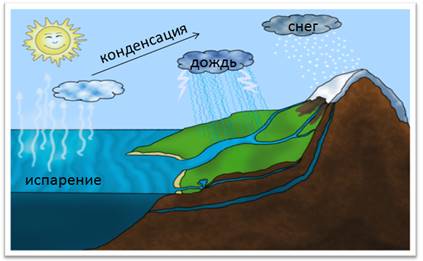
В природе постоянно происходит круговорот воды. Под влиянием солнечного тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в более крупные и выпадают на землю в виде осадков: снега, дождя, града.
Круговорот воды в природе
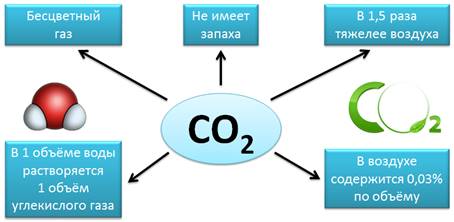
Еще одним известным оксидом является диоксид углерода, углекислый газ, или оксид углерода (IV) – CO2. Это бесцветный газ, не имеет запаха, в 1,5 раза тяжелее воздуха. В 1 объёме воды растворяется 1 объем углекислого газа. В воздухе содержится 0,03% (по объему) диоксида углерода.
Большое количество углекислого газа вызывает удушье. Например, в «Собачьей пещере» вблизи Неаполя, известной еще из древности, заходившие сюда собаки постоянно погибали из-за скопившегося газа, который стелется по дну пещеры слоем до полуметра. Углекислый газ образуется при дыхании, сгорании топлива, тлении и гниении различных организмов. Большое содержание углекислого газа в минеральной воде «Нарзан», находящейся в Кисловодске. Углекислый газ используют для получения газированных вод, а твердый диоксид углерода, или «сухой лед» используют для хранения продуктов питания, в частности мороженого. Т.к. углекислый газ не поддерживает горение, его используют для тушения пожаров. В медицине углекислый газ используют для углекислотных ванн.
Негашеная известь, или СаО, является белым, тугоплавким веществом, которое энергично реагирует с водой, при этом образуется гашеная известь. Негашеная известь применяется для получения вяжущих строительных материалов.
Основная часть литосферы – это оксид кремния (IV) – SiO2. Он входит в состав минералов и горных пород. Этот оксид образует кварц, кварцевый песок, кремнезем, горный хрусталь и др. соединения.
Еще одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3. Он также входит в состав минералов и горных пород. Этот оксид образует корунд, рубин, сапфир, каолин и др. соединения.
Летучие водородные соединения
Строение и физические свойства
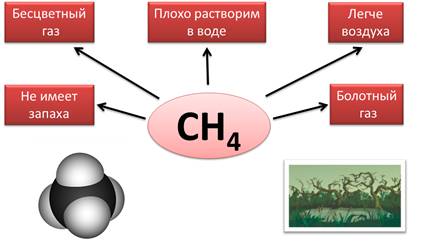
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Водородные соединения: гидриды и их свойства
Способы завершения энергетического уровня
Помимо способов завершения энергетического уровня, существует классификация гидридов, в соответствии с их характером связи. Они подразделяются на 3 большие группы.
Типы гидридов
Стоит рассмотреть основные группы, поскольку побочные группы (полимерные, интерметаллические и комплексные) являются подвидами основных, а также имеют схожие с ними физические и химические свойства.
Ионные гидриды
Ионные (солеобразные) — соединения H2 с металлами IA и IIA (кроме магния), а также с алюминием. Их главное отличие от двух других видов в том, что они активно реагируют с H2O с образованием щёлочи и выделением H2 в виде газа. Самым ярким представителем ионных гидридов является гидрид натрия.
Физические свойства: белые твёрдые вещества с кристаллической решёткой, содержащей катион (плюс) металла и гидрид-анион (минус) Н–. Проводят электрический ток. Устойчивы при нормальных условиях (н.у.).
Как и любое вещество (химический элемент, простое вещество или химическое соединение), ионные гидриды обладают свойствами. Они проявляются в процессе реакции и влияют на неё. Химические свойства:
Применение: для получения металлов из их оксидов, удаления окалины с поверхности металлических изделий, как ракетное топливо.
Получение: при взаимодействии металлов с водородом при t 200-600°С:
Ковалентные соединения
Ковалентные — гидриды, образованные неметаллами IV, V, VI и VII групп, а также бором. Например, гидрид углерода/метан CH4, силан SiH4, гидрид серы/сероводород H2S.
Физические свойства: газообразные, легко воспламеняются на воздухе.
Ковалентные гидриды во многом отличаются от ионных и металлических. Если последние обладают химическими свойствами, схожими с металлами, то свойства ковалентных следует рассмотреть подробнее. Химические свойства:
Применение: для получения полупроводниковых пленочных покрытий, защитных покрытий на поверхности металлов.
Получение: термическое разложение, восстановление галогенидов.
Существуют многочисленные производные ковалентных гидридов, в которых часть атомов H2 замещена атомами галогенов или металлов.
Магний по своим свойствам и химической связи располагается между ионными и ковалентными гидридами. С водой и водными растворами MgH2 реагирует с выделением H2, но не так энергично, как ионные гидриды.
Соединения железа с водородом крайней неустойчивы и в чистом виде не обнаружены. Формула неустойчивого гидрида железа выглядит так: C5H5Fe.
Металлические соединения
Металлические — соединения переходных металлов. Фактически они являются твёрдым раствором H2 в металле, атомы водорода помещаются в кристаллическую решётку металла. Их образованию всегда способствует адсорбция водорода на поверхности металла.
Физические свойства: представляют собой кристаллические вещества с металлическим блеском. Обладают интенсивной окраской, проявляют металлические или полупроводниковые свойства. Устойчивы на воздухе. С кислородом и водой реагируют медленно. Магнитными, механическими, тепло- и электропроводными свойствами схожи с металлами.
Химическая связь очень прочная.
Применение: применяются в качестве источников водорода особой чистоты (который используется в топливных элементах), также для удаления водорода из газовых смесей.
Получение: реакция металла с водородом при обычной температуре или при нагревании: Ti + H2 = (150-200°С) TiH2.
При взаимодействии H2 с интерметаллическими соединениями, такими как TiFe, LaNi5, можно получить гидриды интерметаллидов TiFeH2, LaNi5H6, которые с высокой скоростью обратимо поглощают водород при атмосферном давлении.
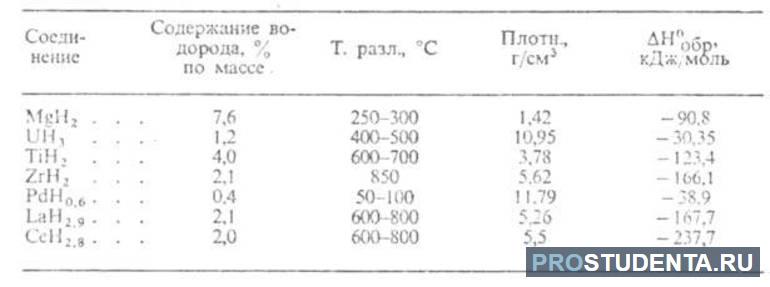
В прикрепленных таблицах указано содержание водорода, температура разложения, плотность и пр., что поможет в более глубоком понимании физических свойств водорода разных типов гидридов.
Особенности водородных соединений
Как и в любом разделе химии, водородные соединения имеют свои исключения. В их числе He, Ne, Ar, Kr, Pm, Os, Ir, Rn, Fr и Ra. Они не образуют бинарные соединения с водородом.
Информация, изложенная выше доказывает то, что химия интереснейший и увлекательный предмет, который стоит потраченного внимания и времени.