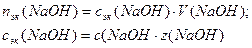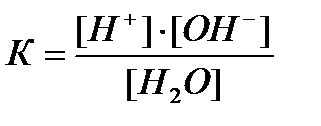Что такое водородный и гидроксильный показатель
Водородный и гидроксидный показатели
Концентрацию ионов H + в растворах принято выражать водородным показателем. Водородный показатель– это безразмерное число, которое характеризует концентрацию катионов водорода в растворах. Обозначение водородного показателя – рН (читается «пэ-аш»). Водородный показатель связан с молярной концентрацией катионов водорода соотношением
рН = –lg[H + ], или рН = –lgC(Н + )
Пользоваться водородным показателем вместо концентрации катионов водорода очень удобно, так как он равен небольшому безразмерному числу в интервале от 0 до14.
Величина рН характеризует среду раствора, которая может быть кислотной, щелочной или нейтральной.
Если рН –7 моль/л, т.е. больше, чем в чистой воде; такой раствор имеет кислотную(часто говорят: кислую) среду. Если рН > 7, то концентрация катионов водорода в растворе менее чем 10 –7 моль/л, т.е. меньше, чем в чистой воде; такой раствор имеет щелочнуюсреду. При рН = 7 среда нейтральная.
pОН = –lg[OH – ], или рОН = –lgC(ОН – )
Cумма водородного и гидроксидного показателей равна отрицательной величине десятичного логарифма ионного произведения воды, то есть числу 14:
Водородный показатель свежеприготовленной дистиллированной воды равен 7,00, но при стоянии она насыщается углекислым газом из воздуха, и в результате реакции
значение рН постепенно снижается до 5,5. Водородный показатель морской воды около 8,0. Сок большинства фруктов и ягод имеет кислую среду с рН = 2,6–4,4. Физиологические жидкости организма имеют различное значение рН: плазма крови – 7,36, слёзы – 7,7, пот – 7,4, слюна – 6,51, моча – 5,8, желудочный сок – 1,65.
Пример 20. Вычислите водородный показатель растворов соляной кислоты (С = 0,005 М) и гидроксида калия (С = 4,2·10 –3 М).
Решение. Оба данных раствора – это растворы сильных электролитов, которые диссоциируют необратимо:
HCl = H + + Cl – ; KOH = K + + OН –
1) Вычисляем рН раствора соляной кислоты:
рН = –lg[H + ] = –lg0,005 = 2,30
2) Вычисляем рОН раствора гидроксида калия:
рОН = –lg[ОH – ] = –lg4,2∙10 –3 = 2,38
3) Вычисляем рН раствора гидроксида калия:
рН = 14 – рОН = 14,00 – 2,38 = 11,62
Пример 21. Вычислите рН раствора циановодородной кислоты (константа диссоциации К = 6,2·10 –10 ) с молярной концентрацией 0,17 М.
Решение. Циановодородная кислота, как слабый электролит, диссоциирует обратимо:
1) Степень электролитической диссоциации вычисляем по закону разбавления Оствальда:
a = 
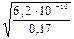
2) Определяем концентрацию катионов водорода:
[H + ] = α∙С(HCN) = 6,0·10 –5 ·0,17 = 1,0·10 –5
3) Вычисляем водородный показатель: рН = –lg[H + ] = –lg1,0∙10 –5 = 5
Для экспериментального определения рН используются индикаторы, специальные приборы (рН-метры) и метод титрования растворов. В качестве индикаторов используются органические вещества, окраска которых меняется в зависимости от концентрации ионов водорода. Использование индикаторов и метод титрования вы изучаются на лабораторном занятии.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Водородный и гидроксильный показатели: рН и рОН



1) нейтральная среда :
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
где [Н + ] – концентрация ионов водорода, моль/л.
Понятие «водородный показатель» было введено датским химиком Серенсеном в 1909 г.: буква «р» – начальная буква датского слова potenz – математическая степень, буква Н – символ водорода.
С помощью рН реакция растворов характеризуется так:
нейтральная рН=7, кислая рН 7.
С помощью рОН реакция растворов характеризуется так:
нейтральная рОН=7, кислая рОН>7, щелочная рОН
IV.Водородный и гидроксильный показатели растворов



Расчет pH и pOH растворов сильных кислот.
Cильные кислоты в растворе диссоциируют полностью:
c(B) – молярная концентрация кислоты, моль/л;
α – степень диссоциации;
Кислотность среды водного раствора сильной кислоты характеризуют водородным показателем рН:
Водородный и гидроксильный показатели взаимосвязаны:
Пример 11.ОпределитеpOH 0,1н раствора Н2SO4, степень электролитической диссоциации которой равна 90%.
Решение. Н2SO4 – сильный электролит, процесс диссоциации описывается уравнением: H2SO4 = 2H + + SO4 2- ; NH + = 2;
1. Определим молярную концентрацию кислоты:
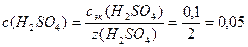
3.Определим рН раствора кислоты:
4. pOH = 14 – pH = 14 – 1,05= 12,95
Пример 12. Определите концентрацию гидроксид-ионов 5%-ного раствора HCl, степень электролитической диссоциации HCl равна 80%, плотность раствора 1,03 г/мл.
1. Определим молярную концентрацию HCl:
Примем m(р-ра)=100г, тогда m(HCl)= 5г,
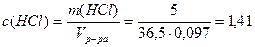
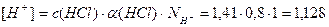
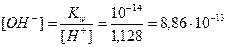
Пример 13. В 3л раствора содержится 0,015 моль HCl и 0,075 моль H2SO4, a(HCl)=1, a(H2SO4)=1. Определите pOH раствора.
Решение.Раствор содержит две сильные кислоты, уравнения их диссоциации:
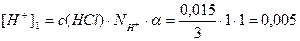
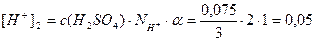
[H + ] = [H + ]1 + [H + ]2 = 0,005 + 0,05 = 0,055 моль/л;
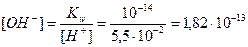
Пример 14.Рассчитайте pH раствора, полученного при смешивании 50 мл 0,1М HCl, 15мл 0,1M NaOH и 935мл H2O.
Решение. При смешивании щелочи и кислоты в растворе происходит реакция нейтрализации:
NaOH + HCl = NaCl + H2O
Реакция среды раствора будет определяться избытком
кислоты или щелочи, оставшейся после реакции.
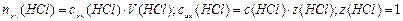
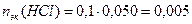
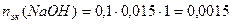
3. Взаимодействующие в ходе реакции вещества подчиняются закону эквивалентов: nэк(HCl) = nэк(NaOH). Следовательно, после реакции в растворе останется избыток HCl в количестве:
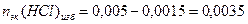
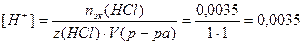
Ионное произведение воды. Водородный показатель. Гидроксильный показатель.



Вода, являясь весьма слабым электролитом, в очень малой степени диссоциирует на ионы:
Данный равновесный процесс описывается константой равновесия:
Так как степень диссоциации воды очень мала, то в уравнении (1) концентрацию воды [Н2О] можно считать величиной постоянной
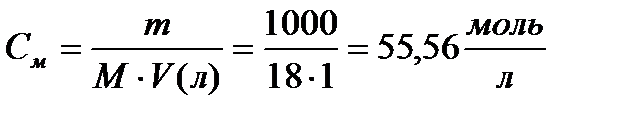
где Кw – ионное произведение воды.
Подставляя значения К и [Н2О] в уравнение (2), получим численное значение ионного произведения воды при 22 0 С.
Зависимость КW от температуры демонстрируется следующими данными:
t, C 0 10 22 30 50 100
Таким образом, КW— величина постоянная лишь при данной температуре.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
Гидроксильным показателем рОН называют десятичный логарифм концентрации гидроксид-ионов, взятый с обратным знаком:
Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить схемой
Ионное произведение воды. Водородный показатель
Вода является практически незаменимым растворителем в экспериментальной и прикладной химии, поэтому необходимо изучение ее свойств. Остановимся на таких понятиях как ионное произведение воды и водородный показатель pH.
Ионное произведение воды
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно и донором и акцептором протонов по отношению к самой себе.
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O + заменить на H +
H2O ↔ H + + OH —
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H + ]·[OH — ]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H + ]·[OH — ]
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Водородный показатель pH
Кислотно – основные свойства растворов определяются величиной концентрации ионов водорода или гидроксила. Мы уже знаем, что ионное произведение воды при определенной температуре постоянно, а [H + ] и [OH — ] — переменные, и по их величинам можно говорить о кислотности или щелочности раствора.
При нейтральном характере раствора, т.е. при равенстве концентраций ионов водорода и гидроксид-ионов [H + ] = [OH — ], получаем следующее выражение:
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняет характер среды.
Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
Следует помнить, что не зависимо от характера среды, в водных растворах всегда существуют оба иона.
Выражение характера среды данным способом информативно, но сопряжено с некоторыми трудностями в случае выражения небольших значений концентрации иона водорода.
Более удобно пользоваться водородным показателем pH.
Водородный показатель pH — это отрицательный логарифм концентрации ионов водорода
Отметим, что изменению [H + ] в 10 раз соответствует изменение pH всего на 1 единицу.
Противоположный водородному показатель — показатель основности раствора рОН
pH и pOH нейтрального раствора равен 7:
| Нейтральная среда | pH = pOH = 7, pH + pOH = 14 |
| Кислая среда | pH ˂ pOH, pH ˂ 7, pH + pOH = 14 |
| Щелочная среда | pH > pOH, pH > 7, pH + pOH = 14 |
На следующем рисунке наглядно показано зависимость характера среды от величины pH
Активность ионов водорода и гидроксид-ионов
Все рассмотренные нами представления об ионном произведении воды справедливы для случая диссоциации химически чистой воды. Если же равновесные концентрации H + или ОH — составляют большие величины, то ионное произведение воды выражается через активности ионов водорода и гидроксид-ионов:
где aH + и aOH — — соответственно активности ионов водорода и ионов гидроксила;
K ` H2O — истинная константа, значение которой не зависит от величины ионной силы раствора.
Для определения характера среды раствора существует много методов, самый простой из них – применение индикаторов. Далее приведены некоторые индикаторы и зависимость изменения их окраски от концентрации ионов водорода.