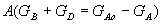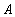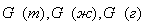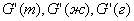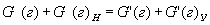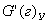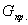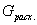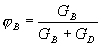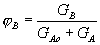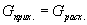| 5. Находим количество вещества реагента по УХР | 6. Определяем массу (объём) реагента по формуле:
m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Источник
Выход реакции. Задачи на выход
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
Количество вещества сульфата аммония:
Теоретическое количество аммиака:
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
Количество вещества метана:
Теоретическое количество дихлорметана:
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м 3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определ ите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Источник
выход продукта
Смотреть что такое «выход продукта» в других словарях:
ВЫХОД ПРОДУКТА — количество продукта (концентрата или металла), получаемое из единицы веса или объема полезного ископаемого; определяется отношением веса полученного продукта (концентрата, металла) к весу исходной руды в процентах. Геологический словарь: в 2 х… … Геологическая энциклопедия
выход продукта — Отношение массы полученного продукта при обогащении к массе исходного материала. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN product yield … Справочник технического переводчика
выход (продукта) — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN output … Справочник технического переводчика
ВЫХОД ПРОДУКТА — [product yield] отношение массы полученного продукта при обогащении к массе исходного материала … Металлургический словарь
высокий выход (продукта) — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN High Yield … Справочник технического переводчика
выход по току — [current efficiency] доля тока (количества электричества), затрачиваемого в электролитическом процессе на получение продукта. Определяют отношением массы фактического прореагировавшего вещества к теоретическому, рассчитанной по закону Фарадея, в… … Энциклопедический словарь по металлургии
выход шлака — [slag yield] технологический показатель, косвенно характеризующий богатство доменной шихты железом. Высокий выход шлака связан с ростом газодин. сопротивления столба шихты в доменной печи и с ростом потерь тепла с отрабатываемым шлаком. Суммарно… … Энциклопедический словарь по металлургии
выход по энергии — [power output] величина, обратная удельному расходу энергии на получение единицы готовой продукции методом электролиза; показывает, какая доля постоянного тока от общего подводимого к ванне количества электроэнергии используется на… … Энциклопедический словарь по металлургии
выход годного — [prime yield] 1. Отношение массы готовых изделий к массе заготовок для них. 2. Доля жидкого металла при плавке в массе металлической завалки; Смотри также: Выход выход шлака выход по энергии выход по току выход продукта … Энциклопедический словарь по металлургии
Выход — [yield; exit]: Смотри также: выход шлака выход по энергии выход по току выход годного выход продукта … Энциклопедический словарь по металлургии
Источник
Расчет практического выхода продукта реакции в химии
Выход продукта химической реакции
Выход продукта химической реакции — масса продукта, образовавшегося в результате реакции.
Если эти два показателя равны, то считают, что реакция идет с количественным выходом. Такую реакцию называют стехиометрической.
Но большинство реакции на практике не дают количественного выхода по следующим причинам:
Поэтому для определения эффективности реакции было введено понятие:
Для реакции с количественным выходом относительный выход равен 100%.
Выход продукта реакции определяется двумя параметрами: селективностью и степенью превращения.
Понятие селективности и материального баланса
Селективность — критерий, с помощью которого в химии определяют отношение массы определенного (целевого) продукта к общей массе полученных продуктов.
Степень превращения (конверсии) показывает отношение количества исходного реагента (обычно более дорогостоящего) к количеству полученного целевого продукта.
Например, этот критерий позволяет оценить, какое количество метана CH4 превратилось в угарный газ CO при конверсии водяным паром. Может быть выражена не только через количество вещества, но и через любые пропорциональные ему величины: массу, объем.
Для обеспечения максимального выхода целевого продукта недостаточно только высокой степени конверсии (значительное количество вещества может вступить в реакцию, но не участвовать в образовании целевого продукта) или хорошей селективности, выход продукта определяется совокупностью этих факторов.
Например, N0 моль исходного вещества А вступило в реакцию, из них прореагировало Nx моль со следующим распределением:
Тогда селективность S реакции по целевому продукту B составит:
Степень превращения реагента A для данного примера будет равна соотношению между числом моль прореагировавшего вещества A к общему числу моль, которые были затрачены на реакцию:
Выход продукта ηB в этом примере будет равен соотношению между числом моль реагента A, пошедшего на образование целевого продукта, к числу моль, которые были затрачены на реакцию:
Таким образом, между выходом продукта B, селективностью процесса относительно образования B и степенью превращения исходного реагента A существует взаимосвязь:
Селективность подразделяют на:
Селективность важна для катализаторов, чтобы избирательно увеличивать скорость целевой реакции при наличии нескольких побочных. Высокой селективностью отличаются ферменты (95 — 100%), для гетерогенных катализаторов этот показатель достигает 70%. Гомогенные занимают промежуточное значение.
Выход, степень превращения и селективность — величины безразмерные, учитываются при составлении материального баланса процесса.
Материальный баланс (баланс масс) выводится на основании закона сохранения массы вещества.
Для химических процессов можно сформулировать его так: суммарная масса исходных веществ в начале реакции должна быть равна суммарной массе всех полученных продуктов (целевых и побочных), включая неиспользованные реагенты и растворители, в конце реакции.
Материальный баланс составляется с расчетом расхода реагентов и полученных продуктов на единицу основного продукта. Поскольку на производство вещества поступают в виде смесей, при составлении материального баланса учитывается масса всех компонентов отдельно для твердой, жидкой и газовой фаз. Для процессов, которые идут в несколько стадий, баланс составляется для каждой стадии отдельно.
Материальный баланс, как и выход продукта, может быть:
Как увеличить выход продукта реакции, способы расчета, формулы
Фактический выход конкретного химического процесса можно увеличивать при регулировании следующих факторов:
Для каждой химической реакции, лежащей в основе промышленного производства, необходимо эффективно использовать ресурсы, максимально повысить выход целевого продукта, но при этом он должен быть надлежащего качества и в достаточном количестве. Для это обязательно рассчитывают выход продукта.
Расчет выхода продукта
Например, если процент выхода равен ω=80%, это означает, что количество полученного продукта составляет 80% от теоретически возможного.
Выход продукта реакции можно выразить также через коэффициент, обозначается буквой η (эта):
Как рассчитать теоретический выход продукта реакции, примеры задач
Алгоритм расчета теоретического выхода ηтеор приведен на примере решения следующей задачи:
При взаимодействии 9,84 г оксида железа (III) и 12 г монооксида углерода СО образовались железо и углекислый газ. Рассчитайте теоретический выход (в молях и граммах) железа.
1. Записать уравнение химической реакции:
2. Расставить коэффициенты так, чтобы в обеих частях уравнения количество атомов каждого элемента было одинаковым:
3. Вычислить молярные массы реагентов и целевого продукта (для взятого примера — Fe). Из таблицы Менделеева или справочника узнать атомные массы Ar всех составляющих элементов и посчитать молярные массы М 1 моля каждого исходного вещества и целевого продукта:
4. Найти количество вещества ν каждого реагента:
Если в условии задачи указана масса только одного реагента, то он считается ключевым, и все дальнейшие расчеты выполняются по нему; ν второго исходного вещества вычислять не нужно (пункт 5 пропускается).
5. Для определения ключевого компонента — реагента, который расходуется быстрее остальных, следует определить продолжительность реакции и теоретический выход:
Это говорит о том, что количество используемого для реакции CO в 7 раз больше, чем количество Fe2O3;
Fe2O3 + 3CO → 2Fe + 3CO2↑.
На одну молекулу Fe2O3 должно приходится 3 молекулы CO.
Можно сделать заключение, что CO взят в избытке и расчет следует вести по Fe2O3, который является ключевым компонентом.
По закону кратных соотношений, чтобы найти теоретическое количество целевого продукта νтеор, нужно количество расчетного компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте:
νтеор= 0,0615 моль :1 × 2= 0,123 моль — это и есть теоретический выход продукта.
7. Масса продукта (Fe), соответствующая данному количеству вещества, будет равна:
Если в задаче требуется рассчитать теоретический выход одного или нескольких побочных продуктов, то для каждого из них вычисляется молярная масса (пункт 3), а затем последовательность действий повторяется с 6 пункта.
На практике также важен расчет фактического выхода продукта ηпракт или массовой доли выхода продукта ω в %.
| Тип задачи | Решение (см. Алгоритм) |
Известно: масса реагента (одного или нескольких) и масса продукта.
Нужно найти: практический выход ηпракт или массовую (объемную) долю ω в % одного или нескольких продуктов реакции.
Пример. При взаимодействии 6,9 г натрия с 100 г воды получили 3 л водорода (н.у.). Вычислите объёмную долю выхода газа (в %).
1. Записать уравнение реакции: Na+ H2O → NaOН + H2↑.
2. Расставить коэффициенты: 2Na+ 2H2O → 2NaOН + H2↑.
3. Вычислить молярные массы реагентов и целевого продукта:
Так как нужно узнать объемную долю выхода продукта, то вместо M(H2) берется значение молярного объема Vm(H2)= 22,4 л/моль (по закону Авогадро, 1 моль любого газа (н.у) занимает объем 22,4 л).
4. Вычислить количество вещества для реагентов:
5. Определить ключевой компонент:
6. Чтобы найти теоретическое количество целевого продукта νтеор, нужно количество ключевого компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте:
Известно: Масса реагента и практический выход продукта.
Нужно найти: Массу продукта реакции.
Пример. Какой объем аммиака в литрах (н.у.) можно получить при взаимодействии 13,4 моль водорода с азотом, если практический выход η(NH3)=0,43?
Пункты 3 и 4 не нужны, так как в условии уже указано количество вещества реагента:
Поскольку дано количество вещества только одного реагента, то расчет ведется по нему. Пункт 5 пропускаем.
6. Чтобы найти теоретическое количество целевого продукта νтеор, нужно количество ключевого компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте:
νтеор(NН3)=13,4:3×2= 8,9 моль.
8. Фактический объем Vпракт= νпракт × Vm= 3,83 моль × 22,4 л/моль= 85,8 л.
Известно: Масса продукта и его практический выход.
Нужно найти: массу реагента.
Пример. Сколько граммов водорода требуется для реакции с углеродом при получении бензола, C6H6, если теоретический выход 105,3 г, а массовая доля выхода равна 95,8%?
3. Вычислить молярные массы реагентов и целевого продукта:
6. Чтобы найти количество реагента, нужно количество продукта реакции разделить на коэффициент при нем и умножить на коэффициент при реагенте:
7. Масса водорода m(H2)= ν(H2)× M(Н2)= 3,9 моль × 2,016 г/моль= 7,8 г.
Источник
|