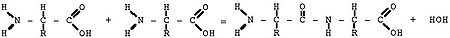Что такое белки формула
Химическая формула белка: подробности
Для полноценной жизни человеку нужны белки, жиры, углеводы. Формула белковой молекулы имеет сложное строение. Рассмотрим особенности состава, а также значение белковых соединений для живого организма.
Исследования
Белки имеют особое значение для жизнедеятельности организмов. В пересчете на сухую массу их процентная концентрация оценивается в 60%. У каждого такого соединения есть свои физические свойства. Структурная формула белков отражается на их химических свойствах, а также на биологическом значении.
Фундаментальные исследования структуры и значимости белковых молекул проводились со второй половины девятнадцатого века. Ученые систематически выявляют новые отличительные характеристики белковых соединений, продумывают области их применения. Существует наука протеомика, в которой изучается формула белка, его особенности.
Пептиды и белки создают уникальный мир, изучением которого занимаются различные естественные науки.
Особенности класса
Белки являются высокомолекулярными соединениями, в составе которых есть азот. Их молекулы выстроены из остатков различных аминокислот, соединенных друг с другом амидными связями.
Формирование представлений о строении белковых молекул
Первые попытки понять, как выглядит структура белков, формула этих соединений, были сделаны еще в XVIII-XIX веках. Именно в этот исторический период из мышц, крови, молока были выделены вещества, обладающие сходными свойствами. Полученные соединения свертывались при высоких температурах, в воде образовывали вязкие и клейкие растворы, при их сгорании ощущался запах натуральной шерсти.
В 1728 году Беккари удалось выделить из обычной пшеничной муки вещество, которое назвали клейковиной. Формула белка была неизвестна, но он был по свойствам сходен с яичным белком.
Разложение белковых молекул сыграло важную роль в изучении их структуры. Браконно провел многочасовое разложение тканей животных в кислой среде. После нейтрализации смеси им был получен фильтрат, в процессе выпаривания которого был получен гликоген. Исследователю удалось выделить из белковой молекулы первую аминокислоту.
Химическая формула белка была выявлена только 1846 году. После многочисленных экспериментов в составе этих органических соединений были обнаружены сера, углерод, фосфор, азот.
Голландским врачом и химиком Мульдером была предложена протеиновая теория, определена формула белка.
Теории строения белковых молекул
После исследований элементарного состава была определена формула белка, представленная в виде смеси радикалов и аминогрупп. После детального изучения продуктов, образующихся при процессе гидролиза белков, химику Данилевскому удалось выявить присутствие в их соединениях пептидной (амидной связи).
Немецкий химик Фишер выдвинул смелую теорию, названную элементарными рядами, получив яичный альбумин. Именно его считают «отцом химии белковых соединений».
Исследования немецкого ученого помогли понять, какое строение имеет белок. Формула химическая этих соединений им не была установлена, но именно Фишер подтвердил линейное расположение в структуре белковых молекул аминокислотных остатков.
Ему удалось объяснить и многообразие этих высокомолекулярных соединений с помощью различного расположения аминокислотных фрагментов в биополимере.
Для выявления величины молекулярной массы белковых соединений была использована центрифуга. Ученым удалось не только выделить ферменты из семян канавалии, но и получить кристаллы трипсина и пепсина.
В середине прошлого века Полингом была разработана модель вторичной белковой структуры, которую назвали альфа-спиралью. Постепенно были расшифрованы третичные структуры инсулина, гемоглобина, осуществлен синтез инсулина.
Особенности структуры белков
В настоящее время никто из биохимиков не сомневается в том, что белки являются основой структуры живых организмов. Они характеризуются высокой упорядоченностью, разнообразием. Движение, сокращение мышц является результатом работы белковых молекул. Жизнь невозможна без полноценного обмена веществ, происходящего в организмах. Деятельность всех обменных процессов регулируется белками-ферментами.
В природе существует порядка 1012 разных белков, которые обеспечивают функционирование 106 видов организмов, имеющих разное строение. Такое многообразие белковых молекул допускает разнообразные варианты сочетания аминокислотных остатков, индивидуальные для каждого живого организма.
Например, клетка Е. coli включает порядка трех тысяч разных белков, а нашем организме насчитывается порядка пятидесяти тысяч белковых молекул. В природных биополимерах находится множество сравнительных простых структур, которые представлены аминокислотами, которые объединены полипептидными связями.
Какова формула белков? Химия не дает однозначного ответа на этот вопрос. Выделяют двадцать важнейших аминокислот, которые объединяются между собой в разной последовательности, формируя различные белковые молекулы.
Например, если есть две исходные аминокислоты, то можно сформировать только два варианта пептидов. При наличии четырех исходных мономеров можно получить двадцать четыре изомера.
При сочетании двадцати аминокислот образуется 2,4 на 1018 формул соединений. В природе не существует каких-либо случайных сочетаний, каждый вид характеризуется специфическим набором белков, который считают наследственной информацией, которая закодирована в структуре ДНК.
Благодаря той информации, которая зашифрована в первичной структуре белковой молекулы, можно осуществлять синтез белков. Линейная полипептидная цепочка самопроизвольно скручивается в трехмерную структуру. Образование трехмерной структуры происходит не хаотично, а в определенном порядке, согласно информации, которая содержится в аминокислотном сочетании.
Содержание белков в живых организмах
Так как общая формула белков подтверждает наличие в них углерода, азота, кислорода, можно предположить количественное содержание этих элементов в живом организме. В организме человека максимально богаты белковыми молекулами органы и ткани. Многие из этих биополимеров растворяются в воде. Максимальное содержание белков выявлено в селезенке, легких, мышцах (около 80 процентов сухой массы).
В качестве источника белка выступают растения и микроорганизмы. Чтобы изучать особенности структуры этих высокомолекулярных соединений, их первоначально выделяют из мышц, крови, шерсти, волос.
Характерные признаки
Для обнаружения мономеров используют кислотный, щелочной либо ферментативный гидролиз. Подобный прием является одним из основных вариантов проведения качественного анализа белковых молекул.
Аминокислоты: особенности, свойства
A-аминокислоты являются производными карбоновыми кислотами, где на аминогруппу замещен водородный атом.
Отметим, что подобное строение характерно для всех аминокислот, которые включены в природные белки.
Часть полипептидов состоит из одного исходного мономера, что позволяет проводить их качественный анализ. Среди специфических свойств белков необходимо упомянуть возможность к денатурации, сопровождающаяся потерей основных химико-физических параметров, а также утратой биологических функций. В этом процессе разрушаются пептидные связи, нет возможности восстановить биополимер.
Протеиногенные аминокислоты
Все аминокислоты, входящие в состав белковых молекул, называют протеиногенными.
Они относятся к L-аминокислотам, содержат аминогруппу в α-положении. Например, глицин является простейшим представителем данного класса соединений. Существует подразделение их по структуре, кислотно-основным характеристикам, биологическому действию.
Данный вариант физиологической классификации аминокислоты является условным, зависит от индивидуальных особенностей живого организма. Для полноценного роста курицы необходимы одиннадцать незаменимых аминокислот.
Те организмы, которые не сохранили в процессе эволюции незаменимых кислот, вынуждены потреблять недостающие соединения для строительства белковых молекул с пищей.
Заключение
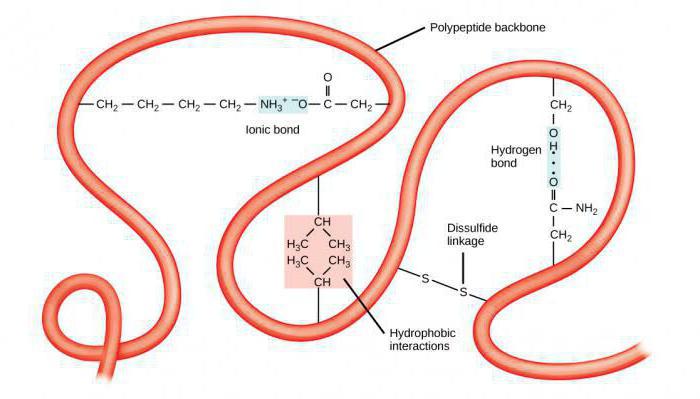
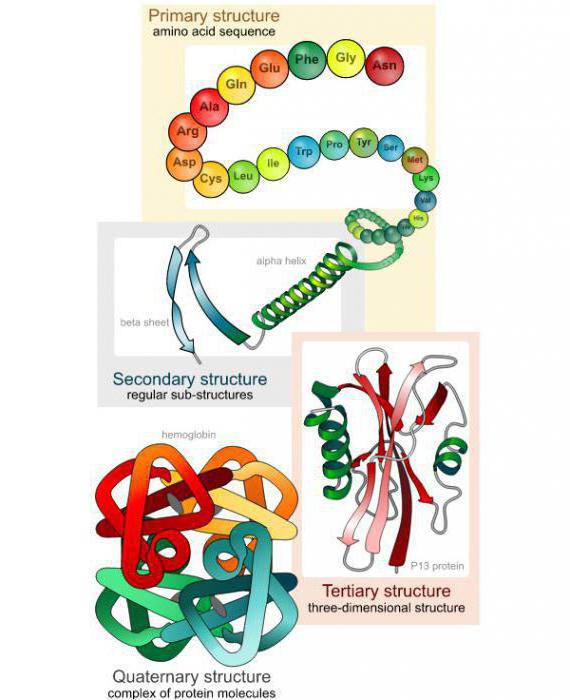
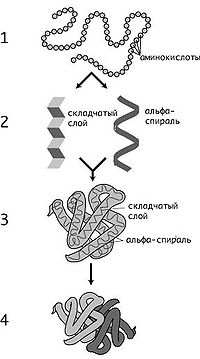
Выделяют первичные, вторичные, третичные, а также четвертичные структуры белковых молекул, у каждого уровня есть свои отличительные характеристики. Простейшей является первичная структура, характеризующаяся сочетанием аминокислотных остатков. Вторичное строение предполагает укладку цепи в определенную последовательность с помощью водородных связей, получая спираль.
Пространственное расположение полипептидной цепочки образует третичную структуру. Белки подразделяют на глобулярные формы, имеющие эллипсовидный вид. Есть и фибриллярные, отличающиеся вытянутой формой. Некоторые биополимеры имеют и четвертичную структуру, сформированную с помощью сложных химических связей.
БЕЛКИ
Полезное
Смотреть что такое «БЕЛКИ» в других словарях:
БЕЛКИ — БЕЛКИ, или протеины, высокомолекулярные коллоидальные органические вещества, построенные из остатков аминокислот. Б. по своему количественному содержанию в организме животных занимают среди твердых составных частей его одно из первых мест, а по… … Большая медицинская энциклопедия
БЕЛКИ — (Sciurus), род беличьих. Дл. тела 20 31 см. Хорошо лазают и передвигаются по деревьям. Длинный (20 30 см) пышный хвост служит рулём при прыжках. Ок. 40 видов, в Сев. полушарии и на С. Юж. Америки, в горных и равнинных лесах, включая островные… … Биологический энциклопедический словарь
белки — 1. БЕЛКИ, ов; мн. (ед. белок, лка; м.). 1. Выпуклые непрозрачные оболочки глаз белого цвета. Б. у неё голубоватые. 2. Разг. сниж. О глазах. Вращать белками. ◁ Белочный, ая, ое. Б ые оболочки глаз. 2. БЕЛКИ, ов; мн. (ед. белок, лка; м.). Сложные… … Энциклопедический словарь
Белки — 1. БЕЛКИ, ов; мн. (ед. белок, лка; м.). 1. Выпуклые непрозрачные оболочки глаз белого цвета. Б. у неё голубоватые. 2. Разг. сниж. О глазах. Вращать белками. ◁ Белочный, ая, ое. Б ые оболочки глаз. 2. БЕЛКИ, ов; мн. (ед. белок, лка; м.). Сложные… … Энциклопедический словарь
БЕЛКИ — природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в длинные цепи. Молекулярная масса от нескольких тысяч до нескольких миллионов. В зависимости от формы белковой… … Большой Энциклопедический словарь
БЕЛКИ — БЕЛКИ, природные высокомолекулярные органические соединения, состоящие из остатков 20 аминокислот. В зависимости от формы молекулы различают фибриллярные (нитевидные) и глобулярные (шарообразные) белки. В состав сложных белков входят углеводы… … Современная энциклопедия
БЕЛКИ — мн. бельма, талы, буркала, шары, баньки, вытараски, выторочки, большие глаза. Что белки выпучил? | сиб. белки, бельцы, белогорье, снеговые горы. Белочная пена, яичная, сбитый белок. Белковая глазная оболочка, роговая. Белковый лес, с белью. Белец … Толковый словарь Даля
белки — горные хребты и вершины в Сибири, которые поднимаются выше границы леса и покрыты снегом в течение всего или большей части года. Напр., Катунские Белки на Алтае, Агульские Белки в Вост. Саянах. География. Современная иллюстрированная энциклопедия … Географическая энциклопедия
БЕЛКИ — (белок) вершины гор Юж. Сибири, покрытые снегом в течение всего лета или его большей части (напр., Агульские Белки) … Большой Энциклопедический словарь
БЕЛКИ — (белок), вершины гор Южной Сибири, покрытые снегом в течение всего лета или его большей части (например, Агульские белки). Источник: Энциклопедия Отечество … Русская история
БЕЛКИ’ — протеины, высокомолекулярные органич. соединения, построенные из остатков аминокислот. Играют первостепенную роль в жизнедеятельности, выполняя многочисл. функции в их строении, развитии и обмене веществ. Мол. м. Б. от БЕЛКИ’ 5000 до мн.… … Биологический энциклопедический словарь
Белки
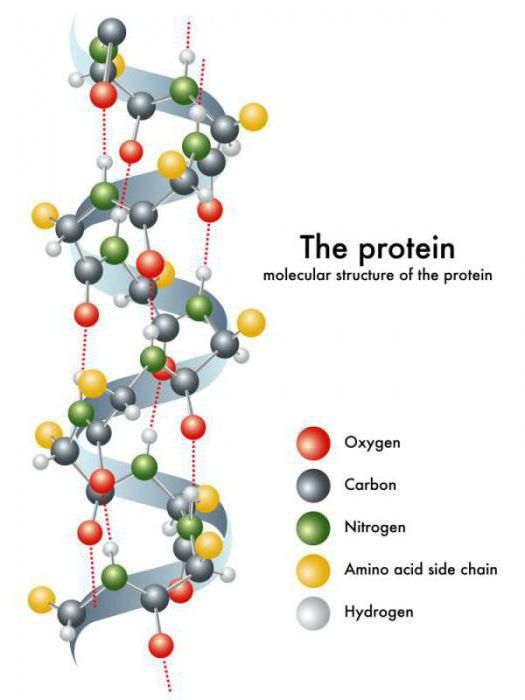
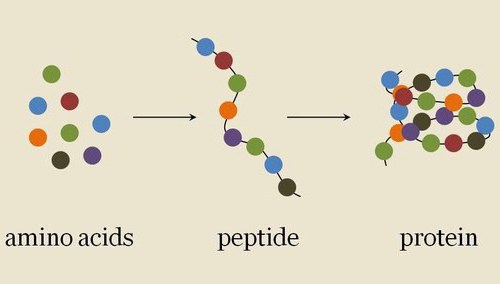
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями.
Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Макромолекулы белков имеют стереорегулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Структуры белков
| Первичная структура — последовательность α-аминокислотных звеньев в полипептидной цепи | Вторичная структура – спиральная структура полипептидной цепи, закрепленная водородными связями между группами N-H и С=О |
 |  |
Химические свойства белков
Качественные реакции на белки
Денатурация белка
Это разрушение структуры белка при нагревании, изменении кислотности среды, действии излучения, спирта, тяжелых металлов, радиации.
Пример денатурации — свертывание яичных белков при варке яиц.
Денатурация бывает обратимой и необратимой.
Анализируя продукты гидролиза, можно установить количественный состав белков.
3.8.2. Белки
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | ||
| третичная |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Белки
Белки́ (протеи́ны, полипепти́ды [1] ) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Содержание
История изучения
Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота. В конце 1950-х годов компания Armour Hot Dog Co. смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, [8] продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов, были получены в 1960-х годах и с помощью ЯМР в 1980-х годах. В 2006 году Банк данных о белках (Protein Data Bank) содержал около 40 000 структур белков.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.
Свойства
Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3000 до 3700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius [9] ).
Белки являются амфотерными полиэлектролитами (полиамфолитами), при этом группами, способными к ионизации в растворе, являются карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь ε-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды pH, при которой молекулы данного белка не несут электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI
12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины.
Белки различаются по степени растворимости в воде, но большинство белков в ней растворяются. К нерастворимым относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в состав шёлка и паутины. Белки также делятся на гидрофильные и гидрофобные. К гидрофильным относятся большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относятся большинство белков, входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны [11] (у этих белков обычно есть и небольшие гидрофильные участки).
Денатурация
Простые и сложные белки
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки классифицируют на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты. Эти фрагменты небелковой природы в составе сложных белков называются «простетическими группами». В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
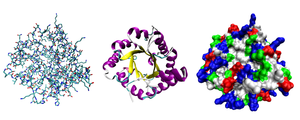
Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10 130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
Такой трёхкодонный код сложился эволюционно рано. Но существование различий в некоторых организмах, появившихся на разных эволюционных стадиях, указывает на то, что он был не всегда таким.
Согласно некоторым моделям, сначала код существовал в примитивном виде, когда малое число кодонов обозначало сравнительно небольшое число аминокислот. Более точное значение кодонов и большее число аминокислот могли быть введены позже. Сначала только первые два из трёх оснований могли быть использованы для узнавания [что зависит от структуры тРНК].
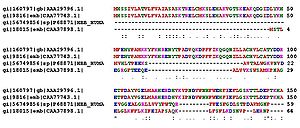
Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, гемоглобины разных организмов, имеют во многих местах цепи идентичные, консервативные остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые вариабельными. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
Уровни организации
Окружение белков
По общему типу строения белки можно разбить на три группы:
Образование и поддержание структуры белков в живых организмах
Синтез белков
Химический синтез
Биосинтез белков
Универсальный способ: рибосомный синтез
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код составляется из трёхбуквенных «слов», называемых кодонами; каждый кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание АУГ соответствует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более чем одним кодоном. Гены, кодирующие белки, сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) белками РНК-полимеразами.
Процесс синтеза белка на основе молекулы мРНК называется трансляцией. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена метиониновая транспортная РНК (тРНК). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5′ к 3′ концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами (кодоном) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомальной РНК (рРНК), образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции. Ферменты аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C-концу.
Нерибосомный синтез
Внутриклеточный транспорт и сортировка белков
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные компартменты клетки — ядро, митохондрии, эндоплазматический ретикулум (ЭПР), аппарат Гольджи, лизосомы и др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в определённый компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка). В некоторых случаях меткой служат посттрансляционно присоединённые к белку олигосахариды. Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путём везикулярного транспорта. В ядро белки, обладающие сигнальной последовательностью для ядра, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.
Посттрансляционная модификация белков
После завершения трансляции и высвобождения белка из рибосомы аминокислоты в составе полипептидной цепи подвергаются разнообразным химическим модификациям. Примерами посттрансляционной модификации являются:
Функции белков в организме
Так же как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки — необходимые компоненты всех живых организмов, они участвуют в большинстве жизненных процессов клетки. Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — органелл, секретируются во внеклеточное пространство для обмена сигналами между клетками, гидролиза пищи и образования межклеточного вещества.
Каталитическая функция
Структурная функция
Защитная функция
Существуют несколько видов защитных функций белков:
Регуляторная функция
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют транскрипцию, трансляцию, сплайсинг, а также активность других белков и др. Регуляторную функцию белки осуществляют либо за счёт ферментативной активности (например, протеинкиназы), либо за счёт специфического связывания с другими молекулами, как правило, влияющего на взаимодействие с этими молекулами ферментов.
Сигнальная функция
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, о́рганами и разными организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов.
Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
Гормоны переносятся кровью. Большинство гормонов животных — это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови.
Клетки взаимодействуют друг с другом с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста.
Транспортная функция
Запасная (резервная) функция белков
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
Рецепторная функция
Моторная (двигательная) функция
Белки в обмене веществ
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в биосинтетических путях, например, аспартаткиназа, которая катализирует первый этап в образовании лизина, метионина и треонина из аспартата, отсутствуют у животных.
Единых норм потребления белков человеком нет. Микрофлора толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм.
Биофизика белка
Методы изучения
Седиментационный анализ (центрифугирование) позволяет делить белки по размерам, различая белки по значению их константы седиментации, измеряемой в сведбергах (S).
Для определения количества белка в образце используют ряд методик: [64]