Что такое белки коротко
Белки
теория по биологии 🌿 цитология
Строение белков
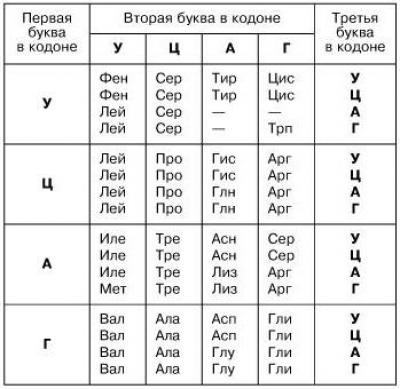
Аминокислоты ассоциируются с генетическим кодом, так как последовательности нуклеотидов кодируют триплеты нуклеотидов. Такие задачи изучаются в школе и встречаются в ЕГЭ. Всем, кто сталкивался с генетикой, хорошо знакома таблица
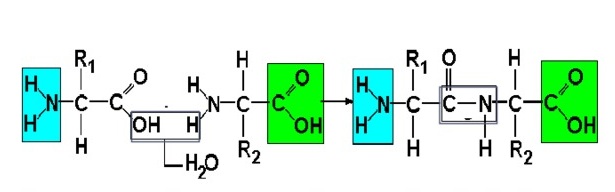
В один белок может входить много аминокислот. Они соединяются в цепь посредством образования пептидных связей: азот одной аминокислоты связывается с углеродом другой аминокислоты:
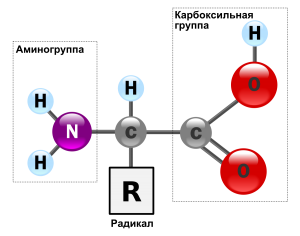
Строение белка. Зеленым цветом обозначена карбоксильная группа аминокислоты, голубым цветом — аминогруппа аминокислоты
Некоторые аминокислоты животный
Классификация белков
Протеины –
Протеиды – белки, в состав которых, кроме белковых молекул, входят небелковые молекулы.
Для того чтобы не путаться в понятиях, нужно вспомнить, что принимают спортсмены для того, чтобы скорее нарастить мышечную массу, то есть протеиновые коктейли, батончики и т.д. Именно протеиновые, это слово на слуху, пусть теперь оно ассоциируется с этой классификацией.
Уровни организации белковой молекулы
Структура белка именуется просто по счету, в зависимости от сложности укладки.
Первичная структура белка представляет собой прямую цепь из аминокислот. Она является главной и определяющей свойства, форму и функции белка.
Вторичная структура белка – уже две цепи. Однако эти цепи не идут параллельно друг другу. Они скручены в спираль и связаны водородными связями, которые их удерживают за счет того, что их много.
Третичная структура белка – глобула. Глобула означает шар, что и является описанием структуры белка. В этом случае прочность обусловлена тремя видами связей: водородными, ионными и дисульфидными.
Четвертичная структура белка – это как бы глобула из глобул. Она встречается не у всех белков. Белок крови
Регенерация — восстановление организмом утраченных или повреждённых органов и тканей, а также восстановление целого организма из его частей.
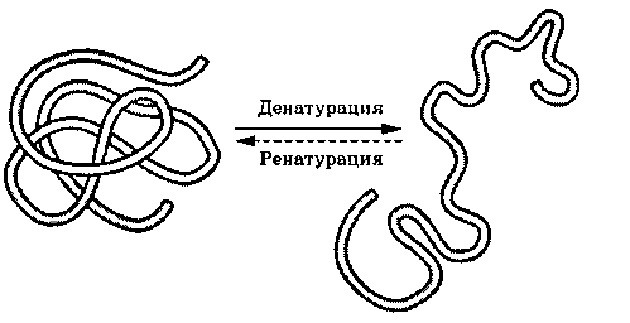
Денатурация и ренатурация
Функции белков
Белки входят в состав всего в клетке: мембраны и органоиды. Кроме того, есть белки, которые очень важно знать:
Ферменты – катализаторы (= ускорители химических реакций) белковой природы. С ферментами происходит тесное знакомство в разделе «пищеварение». Есть одно важное правило, которое нужно обязательно запомнить: все ферменты – белки, но не все белки – ферменты.
Белки-транспортеры осуществляют перенос веществ через мембрану клетки. Очень наглядным примером транспорта белками является белок-переносчик гемоглобин, благодаря которому мы дышим. В мышцах существует аналог этого белка – миоглобин (приставка мио- означает «сокращение», тем самым называя месторасположение белка).
Кроме оборонительной и атакующей функции во благо защиты организма, есть и латающая. При порезе и кровопотере молекулы белка тромбина объединяются для того, чтобы закрыть поврежденный сосуд, а тем временем, тонкие нити белка фибрина переплетаются на поверхности раны, образуя тоненькую пленочку. Если порез был несерьезным, то кровотечение успешно остановлено.
Некоторые белки являются гормонами. Они отвечают за регуляцию физиологических процессов организма. Наиболее известным примером белкового
Как и углеводы с жирами, белки тоже могут быть расщеплены для получения энергии. Однако, чаще всего, аминокислоты, полученные в результате распада белка, снова используются организмом для построения других белков. Это делает для экономии энергии и биологического материала, ведь в случае повторного использования, не нужно тратиться на синтез новых соединений. При расщеплении 1 г белка высвобождается 17,6 кДж энергии.
Задание EB11693 Установите соответствие между классами органических веществ и выполняемыми ими функциями в клетке.
| ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВ ВЕЩЕСТВА | ВЕЩЕСТВА |
A) запасание энергии B) хранение генетической информации Д) входит в состав клеточных стенок и мембран Е) реализация генетической информации (синтез белка) 2) нуклеиновые кислоты (ДНК, РНК) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В | Г | Д | Е |
Для начала вспомним какие вообще есть классы органических веществ в клетке.
Это белки, жиры, углеводы и нуклеиновые кислоты. Белки, жиры и углеводы являются источниками энергии, но у них есть и более локальные функции:
| Белки | Жиры | Углеводы | Нуклеиновые кислоты |
| Структурная | + | + | |
| Энергетическая | + | + | + |
| Защитная | + | + | |
| Ферментативная | + | ||
| Двигательная | + | ||
| Транспортная | + | ||
| Регуляторная | + | ||
| Рецепторная | + | ||
| Хранение и передача ген.информации | + | ||
| Биосинтез белка | + |
Выберем вначале то,что относится к нуклеиновым кислотам: биосинтез белка и хранение генетической информации.
PS: сигнальная и рецепторная функция — одно и то же.
pазбирался: Ксения Алексеевна | обсудить разбор | оценить
На данной схеме изображена реакция между двумя аминокислотами, что известно из вопроса. Между ними действуют пептидные связи.
Пептидная связь — это химическая связь, возникающая между двумя молекулами в результате реакции конденсации между карбоксильной группой (-СООН) одной молекулы и аминогруппой (-NH2) другой молекулы, при выделении одной молекулы воды (H2O).
pазбирался: Ксения Алексеевна | обсудить разбор | оценить
Лекция № 3. Строение и функции белков. Ферменты
Строение белков
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Свойства белков
Купить проверочные работы
по биологии


Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н + определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
Перейти к лекции №2 «Строение и функции углеводов и липидов»
Перейти к лекции №4 «Строение и функции нуклеиновых кислот АТФ»
Смотреть оглавление (лекции №1-25)
Белок: функции, нормы, особенности и источники
Материал проверила и прокомментировала Горбачёва Наталья Леонидовна, диабетолог, диетолог, эндокринолог, ведущий специалист сети клиник «Семейная»
Что такое белок
Белки — главный строительный материал организма. Он участвует в создании мышц, сухожилий, органов и кожи, а также нужен для производства ферментов, гормонов, нейромедиаторов и различных молекул, которые выполняют множество важных функций. Белки состоят из более мелких молекул, аминокислот, которые соединяются вместе, как бусы на нитке. Эти связанные аминокислоты образуют длинные белковые цепи, которые затем складываются в сложные формы. Некоторые аминокислоты организм производит самостоятельно, другие можно восполнить только с помощью еды.
Функции белка в организме
Рост мышц и повышение выносливости
Организму необходим протеин, ведь мышцы в основном состоят из белка. Как и большинство тканей тела, мышцы динамично разрушаются и восстанавливаются, поэтому им необходим строительный материал для роста. Чтобы мышечная масса увеличивалась, в организме должен быть положительный белковый баланс. Его также называют азотным, из-за высокого содержания этого элемента в протеине. Употребление белка помогает не только нарастить мышцы при занятиях спортом, но и предотвратить их потерю, если вы придерживаетесь строгих диет [1] [2].
Биохимические процессы
Белки — ферменты, они помогают тысячам биохимических реакций, происходящих внутри клеток организма [3]. В том числе активируют метаболизм посредством объединения с другими молекулами — субстратами. Ферменты также могут функционировать и вне клетки, например, пищеварительные — лактоза и сахароза, которые помогают переваривать сахар. От их количества зависит пищеварение, свертывание крови и энергетический баланс. Дисбаланс некоторых ферментов может привести к сбоям в работе большинства систем организма [4].
Гормональный баланс
Некоторые белки представляют собой гормоны, которые как химические посредники помогают взаимодействовать различным клеткам организма. Их производят эндокринные ткани и железы, а затем белки транспортируются по внутренним органам. Эти гормоны делят на три группы: белок и пептиды, стероиды и амины [5].
Структура тканей
Некоторые белки являются волокнами, придающими жесткость клеткам: кератин, коллаген и эластин. Они помогают формировать каркас тканей тела [6]. Кератин — строительный материал для кожи, волос и ногтей, коллаген — структурный белок костей, кожи, связок и сухожилий, а эластин позволяет тканям возвращаться в первоначальную форму после растяжений и сокращений.
Правильный pH
Белок играет жизненно важную роль в регулировании концентрации кислот и оснований в крови и других жидкостях организма [7]. Этот баланс измеряется с помощью шкалы pH от 0 до 14, где 0 — максимально кислый, 7 — нейтральный, 14 — наиболее щелочной. Протеины — один из способов регулирования этих показателей. Например, гемоглобин — тоже белок, из которого состоят эритроциты. Он связывает небольшое количество кислоты, помогая поддерживать нормальный уровень pH в крови.
Хороший иммунитет
Белки помогают формировать иммуноглобулины или антитела для борьбы с инфекцией [8] [9]. Антитела — белки в крови, которые помогают защитить организм от бактерий и вирусов. Вырабатывая их в качестве реакции на вторжение чужеродных элементов, клетки в дальнейшем лучше противостоят похожим заболеваниям.
Баланс жидкости
Альбумин и глобулин — белки крови, которые помогают сохранить баланс жидкости в организме, удерживая воду в клетках [10] [11]. При недостатке протеина могут возникать отеки, так как жидкость вытесняется в промежутки между клетками [12].
Нормализация веса
Белок важен для тех, кому необходимо нормализовать вес. Некоторые эксперименты ученых подтверждают, что увеличение количества белка в рационе ведет к повышению скорости метаболизма и снижению аппетита [13]. Протеин хорошо насыщает, в результате чего реже хочется перекусывать, снижается объем порций в основных приемах пищи [14] [15]. В одном из исследований женщины 12 недель употребляли белковую пищу в количестве 30% от дневной калорийности рациона. В среднем каждая из участниц эксперимента потеряла порядка пяти килограмм веса, сохранив здоровые пищевые привычки [16].
Норма белка в день
Если вы каждый день едите продукты животного происхождения, такие как мясо, рыбу, яйца или молочные продукты, вы, вероятно, получаете достаточно белка. Если придерживаетесь растительной диеты, получить незаменимые аминокислоты, необходимые организму, будет сложнее. Среднестатистические нормы протеина в рационе на один килограмм веса:
В некоторых случаях требуется больше белка, например, в периоды болезни, интенсивных занятий спортом, а также при беременности и кормлении грудью [17] [18]. Данные о точном количестве вещества разнятся, поэтому правильно будет проконсультироваться с лечащим врачом, который подберет индивидуальный рацион, исходя из особенностей организма. Так, авторы одного исследования утверждают, что беременным женщинам в день необходимы 1,2–1,52 г протеина на один кг веса [19]. Другие врачи рекомендуют потреблять дополнительно 1,1г белка на кг веса [20]. Суточная норма белка во время грудного вскармливания составляет 1,3 г на килограмм в день плюс 25 дополнительных граммов [21].
Активным людям требуется больше белка, чем тем, кто ведет малоподвижный образ жизни. Спортсменам, предпочитающим тренировки на выносливость, необходимо около 1,2–1,4 г на каждый кг веса [22] [23]. Достаточное количество протеина необходимо для предотвращения развития заболеваний, таких как остеопороз. Пожилым людям, а также тем, кто восстанавливается после травмы или операции, требуется до 1–1,3 г на один кг массы тела [24] [25].
Сколько белка в яйцах, курице и твороге
Эти продукты врачи и диетологи чаще всего упоминают как отличные источники протеина:
Яйца. Содержат 6-7 г белка на штуку среднего размера. Содержатся они именно в белковой части яйца. Поэтому в фитнес-меню часто присутствуют блюда без желтка, но на самом деле, при сбалансированном рационе нет смысла от них отказываться.
Курица. Если необходимо добавить белка в рацион, выбирайте куриную грудку — в ней больше волокон и меньше жира. На 100 г продукта — 27% белка. Оптимальный ингредиент для повышения уровня белка в организме, если вы не придерживаетесь растительной диеты.
Творог. В 200-граммовой пачке творога содержится 35 г белка, что соответствует почти трети среднестатистической дневной нормы. Отдавайте предпочтение творогу средней жирности, так как обезжиренного усваивается меньше необходимым микроэлементов.
Продукты, богатые белком
В первую очередь, протеин попадает в организм из животных продуктов. Средние показатели белка на 100 г продукта:
Вегетарианцам и веганам стоит позаботиться о наличии растительного белка в рационе. Это могут быть бобовые, крупы, соевые и цельнозерновые продукты:
Норма белка в моче и крови
Лучший способ проверить, хватает ли организму белка, — сдать анализы, например биохимический анализ крови. В норме концентрация белка в крови взрослого человека должна составлять 62–86 г/л, а у детей — от 45 до 80 г/л. Снижение этих показателей возникает в результате ряда заболеваний, в том числе первичных иммунодефицитов, нарушениях обмена веществ, дисфункциях желудочно-кишечного тракта, а также дефицита протеина в рационе.
Превышение нормы встречается редко, но оно может указывать на хронические тяжелые инфекции (такие как туберкулез), ускоренный распад эритроцитов, системные опухоли или обезвоживание организма.
С-реактивный белок — фракция протеинов плазмы, которая повышается при наличии в организме воспалительного процесса. Синтезируется в ответ на попадание в кровь токсинов патологических микроорганизмов и обезвреживает их путем их связывания, а также запускает иммунные реакции. С-реактивный белок в норме отсутствует в крови (либо его показатели не превышают 0,4 мг/л). Большие значения указывают на развитие патологий: инфекционных и вирусных заболеваний, панкреатита, пиелонефрита, гепатита, язвенного колита и онкологии.
Помимо крови, белок учитывают в анализе мочи. Небольшое его количество встречается и у здоровых людей, в норме — до 140 мг/л (до 0,140 г/л). При активной физической нагрузке показатели не должны превышать 250 мг/сутки (0,250 г/л). Для того, что точнее узнать потери белка с мочой, необходимо проводить исследование его концентрации в суточных анализах. Их назначают при заболеваниях мочевыделительной системы и почек, инфекциях, а также для контроля осложнений, в том числе при приеме препаратов, оказывающих нефротоксическое действие — поражение почек.
Переизбыток белка
Высокое потребление белка может нанести вред людям с заболеваниями почек [26]. Двумя основными факторами риска почечной недостаточности являются высокое кровяное давление (гипертония) и диабет. И то, и другое провоцируется переизбытком белка [27] [28]. Точное количество необходимого протеина варьируется в зависимости от возраста, состояния здоровья и образа жизни. Исследование с участием здоровых мужчин, занимающихся силовыми тренировками, показало, что ежедневное употребление 3 г белка на кг массы тела в течение года не имело никаких неблагоприятных последствий для здоровья [29]. Даже 4,4 г на кг веса в течение двух месяцев не вызывало никаких побочных эффектов [30].
Нет никаких доказательств того, что потребление белка в разумных количествах причиняет вред здоровым людям. Напротив, существует множество доказанных преимуществ. Однако, если у вас заболевание почек, следует следовать советам врача и ограничить потребление протеинов.
Богатое белками, но бедное жирами и углеводами питание — нагрузка на почки и печень. Переизбыток белка на фоне нехватки других необходимых организму веществ выражается в проблемах с пищеварением, неприятном запахе изо рта и постоянной жажде.
Недостаток белка
Помимо показателей медицинских анализов есть и другие признаки недостатка протеина, которые вы можете заметить перед походом к врачу.
Постоянный голод
Белки насыщают и заряжают энергией надолго, но в качестве перекуса многие из нас используют не белковые продукты, а содержащие углеводы: бананы, печенье, конфеты, выпечку и бутерброды. Еда, богатая углеводами, приводит к быстрому подъему уровня сахара (и мы чувствуем себя сытыми) и такому же быстрому падению (через полчаса мы снова голодны). Этот же эффект вызывает тягу к сладкому: организму не хватает сил, а конфета — самый быстрый способ их получить. Правда, ненадолго.
Слабые волосы и ногти
Ногти и волосы — это тоже белок, а точнее, кератин. Для их здоровья регулярное потребление белковой пищи абсолютно необходимо, иначе организму неоткуда будет брать строительный материал. При дефиците белка волосы становятся тонкими, слабыми и тусклыми, плохо растут и секутся, а ногти начинают ломаться и расслаиваться.
Медленное заживление ран
Если даже маленькая царапина заживает дольше недели, это тоже может быть признаком недостатка белка. Он входит в состав клеток мышечной ткани, кожи и крови, поэтому, если макроэлемента не хватает, на ремонт повреждений у организма уходит гораздо больше времени.
Частые инфекционные болезни
По мнению доктора Алиссы Рамси из американской Академии питания и диетологии, белок также необходим для построения клеток иммунной системы — если вы едите мало белковых продуктов, со временем защита организма может ослабеть.
Без белка замедляется выработка интерферона и лизоцима, «защитников», отбивающих атаки патогенов. Иммунитет перестает справляться с бактериями и вирусами, и мы болеем чаще. Причем любыми инфекционными заболеваниями: у людей на низкобелковой диете часто диагностируют инфекции.
Отеки
Дефицит белка приводит к нарушению водно-солевого баланса, из-за чего жидкость скапливается в тканях. Результат — мешки под глазами и опухшее по утрам лицо, отеки лодыжек и стоп, чувство тяжести в ногах, которое появляется уже в середине дня, даже если вы носите удобную обувь.
Снижение веса
У нашего организма свои приоритеты. Если белка не хватает, то все поступающие протеины направляются туда, где они жизненно необходимы, то есть к внутренним органам. Мышцам при этом почти ничего не достается, и они начинают уменьшаться в объеме. Правда, снижение мышечной массы при белковой недостаточности заметить трудно — за счет отеков вес может оставаться относительно стабильным или снижаться очень медленно. Зато вы точно заметите другие признаки постепенной атрофии мышечной ткани — слабость и быструю утомляемость. Люди, желающие скорректировать вес, часто отказываются от жиров или белка, но это ошибка. Важно соблюдать баланс: основу правильной диеты составляют мясо, рыба (или продукты с высоким содержанием белка растительного происхождения), крупы и овощи.
Плохое настроение
Белок, помимо всего прочего, важен для синтеза нейромедиатора серотонина. Именно он отвечает за хорошее настроение и стрессоустойчивость. Недостаток серотонина приводит не только к хандре, плаксивости и мрачным мыслям, но и к бессоннице, повышенной тревожности, нервозности и склонности взрываться по пустякам.
Комментарии эксперта
Горбачёва Наталья Леонидовна, диабетолог, диетолог, эндокринолог, ведущий специалист сети клиник «Семейная»
«Правильный белковый обмен веществ — баланс между распадом и синтезом белков. Организму должно хватать аминокислот для построения новых соединений. Степень усвоения белка зависит от его происхождения и способа термической обработки. Элемент не способен накапливаться в организме, его излишки выводятся с помощью почек. Поэтому чрезмерное потребление белка негативно сказывается на их состоянии
Причинами нарушений белкового обмена могут стать наследственные заболевания: подагра, а также тяжелые состояния, такие как онкопатологии, следствие радиационного облучения и прочее. Но в большинстве случаев у взрослого человека симптомы нарушения биосинтеза белков говорят о несбалансированном рационе питания.
Недостаток белков — актуальная проблема. Одних она настигает при избавлении от лишнего веса, других — при вегетарианстве, а третьих — из-за заболеваний пищеварительной и эндокринной систем. Дефицит белков может не проявляться клинически, но последствия недостатка протеина довольно печальны:
Если биосинтез белков нарушен на этапе построения, человек может страдать от белкового отравления. Характерными признаками интоксикации являются поражение печени и почек, нарушения работы ЖКТ. Переизбыток белка влияет на центральную нервную систему вплоть до серьезных поражений при врожденных нарушениях обмена веществ. При ухудшении самочувствия необходимо сдать анализы и получить рекомендации специалиста. »