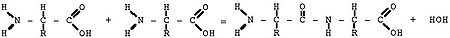Что такое белки кратко 5 класс
Белки
Белок является важным строительным материалом нашего организма. Из него состоит каждая клетка организма, он входит в состав всех тканей и органов. Кроме того, особая разновидность белков исполняет роль ферментов и гормонов в живом организме.
Помимо строительной функции, белок также может являться источником энергии. А в случае избытка белка, печень «предусмотрительно» преобразует белок в жиры, которые откладываются про запас в организме (как избавиться от такого жира?).
В теле человека содержится 22 аминокислоты: 13 аминокислот организм может синтезировать самостоятельно из имеющегося строительного материала, а 9 из них он может получить только с пищей.
В процессе усвоения организмом белки распадаются на аминокислоты, которые в свою очередь поставляются в разные части организма, для выполнения своих основных функций. Белки (в виде аминокислот) входят в состав крови, являются составляющими гормональной системы, щитовидной железы, влияют на рост и развитие организма, регулируют водный и кислотно-щелочной баланс организма.
Продукты богатые белками:
Указано ориентировочное количество в 100 г продукта
| + Еще 40 продуктов богатых белком (указано количество грамм в 100 г продукта): | ||||||||||
| Индейка | 21,6 | Палтус | 18,9 | Брынза | 17,9 | Вареная колбаса | 12,1 | |||
| Куриный окорочок | 21,3 | Телятина | 19,7 | Сельдь | 17,7 | Пшено | 12,0 | |||
| Мясо кролика | 21,2 | Говядина | 18,9 | Говяжья печень | 17,4 | Овсянка | 11,9 | |||
| Горбуша | 21 | Свиная печень | 18,8 | Свиные почки | 16,4 | Свинина жирная | 11,4 | |||
| Креветки | 20,9 | Баранья печень | 18,7 | Фундук | 16,1 | Хлеб пшеничный | 7,7 | |||
| Куры | 20,8 | Цыплята | 18,7 | Минтай | 15,9 | Сдобная выпечка | 7,6 | |||
| Семга | 20,8 | Миндаль | 18,6 | Сердце | 15 | Рисовая каша | 7 | |||
| Семя подсолнечника | 20,7 | Кальмар | 18 | Грецкий орех | 13,8 | Хлеб ржаной | 4,7 | |||
| Сайра мелкая | 20,4 | Скумбрия | 18 | Докторская варенка | 13,7 | Кефир нежирный | 3 | |||
| Баранина | 20 | Творог нежирный | 18 | Гречневая ядрица | 12,6 | Молоко | 2,8 | |||
Суточная потребность в белках
Рекомендуемая потребность в белках для взрослого человека 0,8 г на 1кг веса. Этот показатель можно найти в таблицах расчета идеальной массы тела. Фактический вес человека в данном случае не учитывается, вследствие того, что аминокислоты предназначены для клеточной массы тела, а не для жировых отложений.
Согласно правилам диетологии, белковая пища должна составлять около 15% от общей калорийности ежедневного рациона. Хотя этот показатель может варьироваться в зависимости от рода деятельности человека, а также состояния его здоровья.
Потребность в белках возрастает:
Потребность в белках снижается:
Усваиваемость белков
Когда человек употребляет углеводы, процесс их переваривания начинается еще во время пребывания их во рту. С белками же всё по-другому. Их переваривание начинается только в желудке, при помощи соляной кислоты. Однако, поскольку молекулы белка являются очень крупными, перевариваются белки достаточно трудно. Для улучшения усвоения белков, необходимо употреблять продукты, содержащие белок в наиболее усваиваемой и легкой его форме. К таковым относится белок яиц, а также белок, содержащийся в кисломолочных продуктах, таких как кефир, ряженка, брынза и т.д.
Согласно теории раздельного питания, белковая пища хорошо сочетается с различной зеленью и листовыми овощами. Современные диетологи утверждают, что белок лучше усваивается в присутствии жиров и углеводов, которые являются основными источниками энергии для организма.
Поскольку белковая пища в организме задерживается значительно дольше углеводистой, то чувство сытости после употребления белков сохраняется значительно дольше.
Полезные свойства белка и его влияние на организм
В зависимости от своей специализации белки выполняют в организме различные функции. Транспортные белки, например, занимаются доставкой витаминов, жира и минералов ко всем клеткам организма. Белки-катализаторы ускоряют различные химические процессы, происходящие в организме. Также существуют белки, которые борются с различными инфекциями, являясь антителами к различным заболеваниям. Кроме того, белки являются источниками важных аминокислот, которые необходимы как строительный материал для новых клеток и укрепления уже имеющихся.
Взаимодействие с эсенциальными элементами
Все в природе взаимосвязано, и также все взаимодействует в нашем организме. Белки, как часть всеобщей экосистемы, взаимодействуют с другими элементами нашего организма – витаминами, жирами и углеводами. Мало того, помимо простого взаимодействия, белки участвуют также в трансформации одного вещества в другое.
Что касается витаминов, то на каждый грамм потребленного белка, необходимо употребить 1 мг витамина С. При недостатке витамина С, будет усвоено только то количество белка, на которое хватит содержащегося в организме витамина.
Опасные свойства белков и предостережения
Признаки нехватки белка в организме
Признаки избытка белка в организме
Факторы, влияющие на содержание белка в организме
Состав и количество пищи. Так как незаменимые аминокислоты организм не может синтезировать самостоятельно.
Возраст. Известно, что в детском возрасте количество белка, необходимого для роста и развития организма, более чем в 2 раза превышает потребность в белке человека средних лет! В пожилом возрасте все обменные процессы протекают гораздо медленнее, а, следовательно, потребность организма в белках существенно сокращается.
Физический труд и профессиональный спорт. Для поддержания тонуса и работоспособности спортсменам и людям, занимающимся интенсивным физическим трудом, требуется увеличенная в 2 раза норма потребления белка, так как в их организме очень интенсивно проходят все обменные процессы.
Белковая пища для здоровья
Как мы уже говорили, существуют 2 большие группы белков: белки, являющиеся источниками заменимых и незаменимых аминокислот. Незаменимых аминокислот всего 9: треонин, метионин, триптофан, лизин, лейцин, изолейцин, фенилаланин, валин. Именно в этих аминокислотах особо нуждается наш организм, так как усваиваются они только из пищи.
В современной диетологии существует такое понятие, как полный и неполный белок. Белковая пища, содержащая все незаменимые аминокислоты, называется полным белком, неполным белком считается пища, содержащая лишь некоторые из незаменимых аминокислот.
К продуктам, содержащим полноценный высококачественный белок, относятся мясные, молочные продукты, морепродукты и соя. Пальма первенства в списке таких продуктов принадлежит яйцам, которые по медицинским критериям считаются золотым стандартом полноценного белка.
Неполноценный белок чаще всего содержится в орехах, различных семенах, хлебных злаках, овощах, бобовых, некоторых фруктах.
Сочетая в одном приеме пищи продукты, содержащие неполноценный белок с полноценным, можно добиться максимального усвоения неполноценного белка. Для этого достаточно включить в свой рацион лишь небольшое количество продуктов животного происхождения, и польза для организма будет существенной.
Белок и вегетарианство
Некоторые люди по своим морально-этическим убеждениям, полностью исключили мясные продукты из своего рациона. Наиболее известные из них – Ричард Гир, звезда «Голубой лагуны» Брук Шилдс, великолепная Памела Андерсон, а также непревзойденный российский юморист Михаил Задорнов.
Однако, для того, чтобы организм не чувствовал себя обделенным, необходима полноценная замена рыбе и мясу. Тем, кто употребляет молоко, творог, яйца, конечно же, легче. Тем же, кто полностью отказался от животных белков, приходится проявлять большую изобретательность, чтобы организм не страдал от недостатка белка. Особенно это касается детского быстрорастущего организма, который при недостатке аминокислот способен притормозить рост и нормальное развитие.
Благодаря определенным исследованиям, связанным с изучением усвоения растительного белка организмом, стало известно, что определенные сочетания такого белка могут обеспечить организм полным набором незаменимых аминокислот. Вот эти сочетания: грибы–злаки; грибы–орехи; бобовые–злаки; бобовые–орехи, а также разные виды бобовых, сочетающиеся в одном приеме пищи.
Но это всего лишь только теория и пройдет время, прежде чем она будет полностью подтверждена либо опровергнута.
Авокадо сравнимо по содержанию белка со свежим коровьем молоком (в нем содержится около 14% белкового вещества). Кроме того, фрукт содержит полиненасыщенные жирные кислоты Омега-6 и пищевые волокна. Орехи, гречка, брюссельская и цветная капуста, а также шпинат и спаржа завершают наш далеко не полный список продуктов, богатых растительным белком.
Белки в борьбе за стройность и красоту
Для желающих оставаться всегда подтянутыми и красивыми, диетологи рекомендуют придерживаться определенной схемы питания до и после тренировок:
Мы собрали самые важные моменты о белках в этой иллюстрации и будем благодарны, если вы поделитесь картинкой в социальной сети или блоге, с ссылкой на эту страницу:
Внимание! Информация носит ознакомительный характер и не предназначена для постановки диагноза и назначения лечения. Всегда консультируйтесь с профильным врачом!
Презентация по окружающему миру на тему «Белки» (5 класс)
Описание презентации по отдельным слайдам:
Б Е Л К И ДЖАФАРОВА СААДАТ ЗУБЕИР КЫЗЫ Учитель биологии ГБОУ СОШ № 45 ЦАО г.Москвы
«Жизнь — это открытые саморегулирующиеся и самовоспроизводящиеся системы совокупностей живых организмов, построенные из сложных биологических полимеров — белков и нуклеиновых кислот». Основой всего живого считаются нуклеиновые кислоты и белки, так как они функционируют в клетке, образовывают сложные соединения, которые входят в структуру всех живых организмов. Все живые организмы в природе состоят из одинаковых уровней организации, это общая для всех живых организмов характерная биологическая закономерность.
Белки— высокомолекулярные органические соединения – (ВМС), нерегулярные биополимеры, состоящие из мономеров- аминокислот, соединенных пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков.
СТРОЕНИЕ АМИНОКИСЛОТ В аминокислотах выделяют три функциональные группы: 1.Аминогруппа 2.Карбоксильная группа 3.Радикал ( они разные у всех аминокислот)
ПЕПТИДНАЯ СВЯЗЬ Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Денатурация. Резкое изменение условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной, третичной и вторичной структур белка, называемой денатурацией. Самый известный случай денатурации белка в быту — это приготовление куриного яйца ОБРАТИМАЯ Если сохранена первичная структура НЕОБРАТИМАЯ Если первичная Структура разрушена
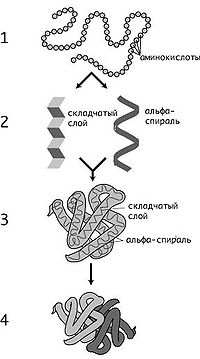
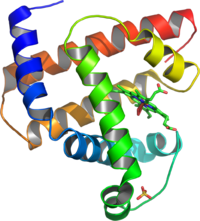
Уровни структуры белка.
Первичная структура — последовательность аминокислот в полипептидной цепи. Определяется и соответствует последовательности нуклеотидов в молекуле ДНК
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями.
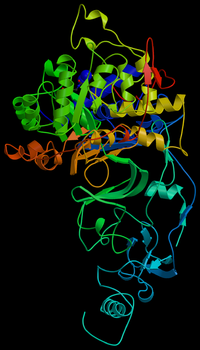
Третичная структура — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. В стабилизации третичной структуры принимают участие: ковалентные связи; ионные взаимодействия; водородные связи; гидрофобные взаимодействия.
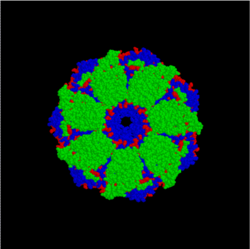
Четверичная структура — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Функции белков. Функция Определение Пример 1. Строительная Материал клетки Кератин, коллагены 2. Транспортная Переносят различные вещества Гемоглобин 3. Защитная Обезвреживают защитные вещества Иммуноглобулины 4. Каталитическая Ускоряют протекание химических реакций в организме Ферменты 5. Двигательная Выполняют все виды движений Миозин, актин 6. Регуляторная Регулируют обменные процессы Гормоны
ЧТО ОБЩЕГО У ЛЮДЕЙ НА ПРЕДЫДУЩЕМ СЛАЙДЕ? КАК ЭТИ ФОТОГРАФИИ СВЯЗАНЫ С ТЕМОЙ УРОКА?
ИТОГИ УРОКА: 1.Что узнали? 2.Для чего это нужно? 3.Насколько это важно? 4.Как вас изменили эти знания?
Домашнее задание 1.Составить синквейн со словами: белок, аминокислота, радикал. 2.& 3 по учебнику Общая биология: Учеб. Для 10–11 кл. Д.К.Беляев, П.М.Бородин, Н.Н.Воронцов и др. М.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
«Жизнь- это открытые саморегулирующиеся и самовоспроизводящиеся системы совокупностей живых организмов,построенных из сложных биологических полимеров- белков и нуклеиновых кислот».
Основой всего живого считаются нуклеиновые кислоты и белки, так как они функционируют в клетке, образовывают сложные соединения, которые входят в структуру всех живых организмов. Все живые организмы в природе состоят из одинаковых уровней организации, это общая для всех живых организмов характерная биологическая закономерность. (слайд2)
Белки- высокомолекулярные органические соединения- (ВМС), нерегулярные биополимеры, состоящие из мономеров-аминокислот, соединенных пептидной связью. В живыхорганизмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. (слайд 3)
Уровни структуры белка
Вторичная структура-локальное упорядованивание фрагмента полипептидной цепи,стабилизированное водородными связми и гидрофобными взаимодействиями (слайд 12)
Третичная структура-пространственное строение полипептидной цепи-взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. в стабилизации третичной структуры принимают участие химические связи (слайд 13)
Четвертичная структура-субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса(слайд 14)
Презентация по технологии на тему: «Белки и их роль в питании человека» (5 класс)
Описание презентации по отдельным слайдам:
БЕЛКИ И ИХ РОЛЬ В ПИТАНИИ ЧЕЛОВЕКА Презентация к уроку технологии 5 класс Автор: учитель технологии Л. Н. Анощенко
Белки – важнейший компонент здорового питания, источник жизненных сил!
Потребность в белках взрослого здорового человека зависит от возраста, пола, физической активности
Источники животного белка в питании МЯСО МОЛОКО Р Ы Б А ЯЙЦА
Основные поставщики растительного белка ХЛЕБ КРУПЫ БРЮССЕЛЬСКАЯ КАПУСТА
НЕДОСТАТОК БЕЛКА ПРИВОДИТ к дистрофии к замедленному росту к снижению иммунитета
Продукты, богатые белками творог сыр яйца птица говядина печень рыба соя крупы
Спасибо за внимание! Главное – рассчитать необходимое для организма количество белков!
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Технология: теория и методика преподавания в образовательной организации
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1539248
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Минпросвещения разработает внеучебные курсы для школьников
Время чтения: 1 минута
Утверждены сроки заключительного этапа ВОШ
Время чтения: 1 минута
В Москве новогодние утренники в школах и детсадах пройдут без родителей
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
В России планируют создавать пространства для подростков
Время чтения: 2 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Белки
Белки́ (протеи́ны, полипепти́ды [1] ) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Содержание
История изучения
Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота. В конце 1950-х годов компания Armour Hot Dog Co. смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, [8] продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов, были получены в 1960-х годах и с помощью ЯМР в 1980-х годах. В 2006 году Банк данных о белках (Protein Data Bank) содержал около 40 000 структур белков.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.
Свойства
Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3000 до 3700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius [9] ).
Белки являются амфотерными полиэлектролитами (полиамфолитами), при этом группами, способными к ионизации в растворе, являются карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь ε-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды pH, при которой молекулы данного белка не несут электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI
12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины.
Белки различаются по степени растворимости в воде, но большинство белков в ней растворяются. К нерастворимым относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в состав шёлка и паутины. Белки также делятся на гидрофильные и гидрофобные. К гидрофильным относятся большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относятся большинство белков, входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны [11] (у этих белков обычно есть и небольшие гидрофильные участки).
Денатурация
Простые и сложные белки
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки классифицируют на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты. Эти фрагменты небелковой природы в составе сложных белков называются «простетическими группами». В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
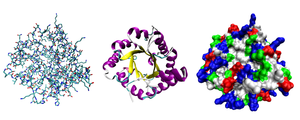
Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10 130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
Такой трёхкодонный код сложился эволюционно рано. Но существование различий в некоторых организмах, появившихся на разных эволюционных стадиях, указывает на то, что он был не всегда таким.
Согласно некоторым моделям, сначала код существовал в примитивном виде, когда малое число кодонов обозначало сравнительно небольшое число аминокислот. Более точное значение кодонов и большее число аминокислот могли быть введены позже. Сначала только первые два из трёх оснований могли быть использованы для узнавания [что зависит от структуры тРНК].
Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, гемоглобины разных организмов, имеют во многих местах цепи идентичные, консервативные остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые вариабельными. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
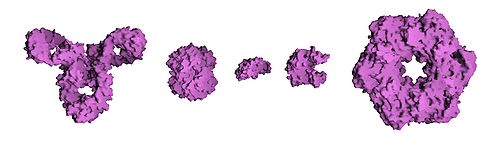
Уровни организации
Окружение белков
По общему типу строения белки можно разбить на три группы:
Образование и поддержание структуры белков в живых организмах
Синтез белков
Химический синтез
Биосинтез белков
Универсальный способ: рибосомный синтез
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код составляется из трёхбуквенных «слов», называемых кодонами; каждый кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание АУГ соответствует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более чем одним кодоном. Гены, кодирующие белки, сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) белками РНК-полимеразами.
Процесс синтеза белка на основе молекулы мРНК называется трансляцией. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена метиониновая транспортная РНК (тРНК). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5′ к 3′ концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами (кодоном) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомальной РНК (рРНК), образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции. Ферменты аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C-концу.
Нерибосомный синтез
Внутриклеточный транспорт и сортировка белков
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные компартменты клетки — ядро, митохондрии, эндоплазматический ретикулум (ЭПР), аппарат Гольджи, лизосомы и др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в определённый компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка). В некоторых случаях меткой служат посттрансляционно присоединённые к белку олигосахариды. Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путём везикулярного транспорта. В ядро белки, обладающие сигнальной последовательностью для ядра, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.
Посттрансляционная модификация белков
После завершения трансляции и высвобождения белка из рибосомы аминокислоты в составе полипептидной цепи подвергаются разнообразным химическим модификациям. Примерами посттрансляционной модификации являются:
Функции белков в организме
Так же как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки — необходимые компоненты всех живых организмов, они участвуют в большинстве жизненных процессов клетки. Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — органелл, секретируются во внеклеточное пространство для обмена сигналами между клетками, гидролиза пищи и образования межклеточного вещества.
Каталитическая функция
Структурная функция
Защитная функция
Существуют несколько видов защитных функций белков:
Регуляторная функция
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют транскрипцию, трансляцию, сплайсинг, а также активность других белков и др. Регуляторную функцию белки осуществляют либо за счёт ферментативной активности (например, протеинкиназы), либо за счёт специфического связывания с другими молекулами, как правило, влияющего на взаимодействие с этими молекулами ферментов.
Сигнальная функция
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, о́рганами и разными организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов.
Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
Гормоны переносятся кровью. Большинство гормонов животных — это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови.
Клетки взаимодействуют друг с другом с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста.
Транспортная функция
Запасная (резервная) функция белков
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
Рецепторная функция
Моторная (двигательная) функция
Белки в обмене веществ
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в биосинтетических путях, например, аспартаткиназа, которая катализирует первый этап в образовании лизина, метионина и треонина из аспартата, отсутствуют у животных.
Единых норм потребления белков человеком нет. Микрофлора толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм.
Биофизика белка
Методы изучения
Седиментационный анализ (центрифугирование) позволяет делить белки по размерам, различая белки по значению их константы седиментации, измеряемой в сведбергах (S).
Для определения количества белка в образце используют ряд методик: [64]