Что такое бинарные соединения в химии 8 класс
Урок химии в 8 классе «Бинарные соединения»
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Муниципальное бюджетное образовательное учреждение
основная общеобразовательная школа №6
урок химии в 8 классе
Важнейшие классы бинарных соединений.
Оксиды и водородные соединения
Подготовила и провела
учитель химии Щетинина И.В
Цель : познакомиться с важнейшими классами бинарных соединений –оксидами и водородными соединениями.
Образовательная: с формировать первоначальные знания об оксидах и водородных соединениях, показать значение важнейших представителей в природе и жизни человека;
Развивающая : развивать умение классифицировать оксиды, давать им химические названия, определять степени окисления по формуле, выводить формулы бинарных соединений по степеням окисления элементов;
Воспитательная: у мение осуществлять самостоятельную деятельность на уроке,
умения адекватной самооценки и самоконтроля. Воспитывать культуру умственного труда, развивать коммуникативные качества.
Метапредметные и личностные результаты:
1. Сформировать умение самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности (формулировка вопроса урока)
2. Сформировать умение в диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.
1. Сформировать умение владеть смысловым чтением
2. Сформировать умение преобразовывать информацию из одного вида в другой (текст
3. Анализировать, сравнивать, классифицировать и обобщать.
1. Сформировать умение самостоятельно организовывать учебное взаимодействие в паре.
2. Отстаивая свою точку зрения, приводить аргументы, подтверждая их фактами.
Постепенно выстраивать собственное целостное мировоззрение.
2. Осознавать потребность и готовность к самообразованию, в том числе и в рамках самостоятельной деятельности вне школы.
3. Сформировать умение оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья.
компьютер, проектор, газированная вода, минеральная вода, образцы оксидов, нашатырный спирт, соляная кислота, презентация
Учебник по химии 8 класс, О.С. Габриелян.
Тип урока : комбинированный урок (с использованием презентации).
Формы урока : Фронтальная, индивидуальная, парная
Организация начала урока
Включение в деловой ритм. Подготовка класса к работе.
Подготовка к активной учебной деятельности
Какую тему мы начали изучать? («Соединения химических элементов»)
Перед вами на слайде формулы. Что у них общего? (все они состоят из 2-х элементов)
Да, такие соединения называют бинарными.
Вставьте пропущенные слова и сформулируйте определение бинарных соединений
Попробуйте классифицировать все эти вещества на 2 группы. (Выполняют работу)
Сегодня на уроке мы познакомимся с важнейшими классами бинарных соединений.
Учитель : Давайте сформулируем тему урока.
Важнейшие классы бинарных соединений. Оксиды и водородные соединения. Предположите, какие задачи мы должны сегодня решить.
— познакомиться с представителями оксидов и водородных соединений, с физическими свойствами веществ, их значением и для человека;
— показать огромное значение их в природе и в жизни человека;
Изучение нового материала
Учитель: Одним из классов бинарных соединений являются оксиды
Задание 1.Среди перечисленных веществ найдите оксиды:
CaBr2, MgO, P2O5, Na2S, KF, Li2O, OF2, SO3
Почему вы объединили эти соединения в одну группу?
— В состав всех этих соединений входит кислород.
Оксиды – широко распространенный в природе класс неорганических соединений. Познакомимся с некоторыми оксидами. К оксидам относиться песок (диоксид кремния с небольшим количеством примесей), глина (оксид алюминия с небольшим количеством примесей, углекислый газ (диоксид углерода), большинство руд металлов содержат оксиды железа красный железняк ( Fe 2 O 3 ), магнетит ( Fe 3 O 4 )
Оксиды отличаются по агрегатному состоянию: твердые, жидкие, газы.
Ребята, вы знаете, что такое
ГИППОПОТАМОМОНСТРОСЕСКВИППЕДАЛИОФОБИЯ – это страх пред длинными словами или речью.
Какие виды фобии вам известны? (клаустро-, нео-, аэро-,) хемофобия – боязнь химии. Это пристальное разглядывание этикеток на продуктах питания Е-360 на баночке с майонезом, разговоры о нитратах в овощах и т.п.
В химии много таких слов, и их не надо бояться, потому что они порой означают самые простые вещи.
На слайде слово ДИГИДРОГЕНМОНООКСИД О каком веществе идет речь?
«…, у тебя нет ни запаха, ни вкуса, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое» Антуан де Сент Экзюпери
Учитель: у вас на цветных карточках текст. Прочитав его, вы должны ответить на вопрос: о каком веществе идет речь? ВОДА. И подсказка на слайде. Вода – самое удивительное, самое распространённое вещество на Земле. Сегодня на уроке мы уделим этому веществу большое внимание.
Самостоятельная работа в группах
Сейчас я предлагаю вам поработать в группах.
Работа с учебником: стр. 91-95. Заполните недостающую строчку в таблице, прочитав соответственную информацию в учебнике
Учащиеся в парах работают с текстом учебника, рассматривают образцы оксидов и заполняют таблицу «Важнейшие оксиды в природе и жизни человека”
По ходу заполнения таблицы учитель комментирует и добавляет информацию
Важнейшие оксиды в природе и жизни человека
Оксид водорода, вода
Потребление воды человеком: слив воды в туалете, умывание,
стирка, мытье посуды, полив, приготовление пищи, напитков
Сухой лед для хранения
газированных напитков, тушение пожаров
рубин, сапфир, корунд, основную массу особых глин –бокситов
Образует кварц, кварцевый песок,
горный хрусталь, кремнезем, аметист, агат
Образует гашеную известь, в строительстве для получения вяжущих материалов.
Вода является важнейшим ресурсом для поддержания жизни и источником всего живого на Земле, но её неравномерное распределение на континентах не раз становилось причиной кризисов и социальных катастроф. Дефицит пресной питьевой воды в мире знаком человечеству с древнейших времён, и с последнего десятилетия двадцатого века он постоянно рассматривается как одна из глобальных проблем современности. При этом, по мере роста населения нашей планеты, значительно увеличивались масштабы водопотребления, и, соответственно, вододефицита, что впоследствии стало приводить к ухудшающимся условиям жизни и замедлило экономическое развитие стран, испытывающих дефицит.
Углекислый газ. Объёмная доля его в атмосфере – 0.03%. содержание его непостоянно. В городах, особенно вблизи заводов его больше, чем в селах. И в разное время года содержание СО 2 неодинаково. Как вы думаете почему?
Углекислый газ образуется при дыхании живых организмов, сгорании топлива, гниении органических веществ. Он входит в состав вулканических газов, содержится в минеральных водах. Так, в Грузии есть источник Боржоми, в г. Кисловодск – Нарзан, в Липецке тоже есть источник, богатый углекислым газом.
Углекислый газ необходим для поддержания жизни как планеты, так и отдельно взятого организма. СО2 влияет на климат, являясь своеобразным одеялом. Без него невозможен метаболизм: с углекислым газом из организма выходят продукты обмена. А ещё это незаменимый компонент любимых всеми газированных напитков. Именно углекислый газ создаёт игривые пузырьки, щекочущие в носу. При этом для здорового человека он абсолютно безопасен.
Свойства углекислого газа
Лабораторная работа. Получение и определение углекислого газа.
Напоминаю вам о технике безопасности. У вас на столах стоят стаканчики с кусочками мрамора. При добавлении к нему раствора соляной кислоты образуется углекислый. Газ, который, как известно не поддерживает горения. Поэтому тлеющая лучина, которую вы внесете в стаканчик потухнет.
Это свойство СО 2 используется при тушении пожаров.
При увеличении давления до 60 атм. Углекислый газ превращается в бесцветную жидкость, при испарении которой часть его превращается в снегообразную массу – т.н. «сухой лед».
Ответьте, есть ли на Земле проблемы, связанные с углекислым газом?
В настоящее время проблема парникового эффекта является одним из наиболее глобальных экологических вопросов, стоящих перед человечеством. Суть этого явления состоит в том, что солнечное тепло остается у поверхности нашей планеты в виде оранжерейных газов. Главной причиной парникового эффекта является попадание в атмосферу промышленных газов, один из которых – углекислый .
Оксид кальция (негашеная известь ) – белое тугоплавкое вещество, которое энергично взаимодействует с водой (показываю опыт в литровой банке). При добавлении к оксиду кальция воды начинается бурная реакция с выделением большого количества теплоты. Раствор так сильно разогревается, что начинает кипеть. Поэтому называется этот процесс гашение. В результате образуется гашеная известь, из которой делают строительные материалы, обладающие вяжущими свойствами.
Оксид кремния и оксид алюминия образуют основную массу земной коры – литосферу. Эти оксиды входят в состав многих минералов. Из диоксида кремния состоит кварц, горный хрусталь – разновидность кварца, кварцевый песок. Из оксида алюминия состоят драгоценные камни, например, корунд и особая разновидность глин – бокситы.
Можно рассказать об оксиде хрома три, оксиде цинка.
Водородные соединения в природе и жизни человека
Сообщения учащихся: «Сероводород», «Аммиак», «Хлороводород»
Составьте и заполните таблицу “Водородные соединения”
неприятным запахом, немного растворим в воде
Бинарные соединения – оксиды. Химия. 8 класс. Конспект урока
УМК «Химия. 8 класс» О. С. Габриеляна.
Тип урока: изучение нового материала
Цели:
Образовательные: сформировать понятие «оксид».
Воспитывающие: способствовать экологическому воспитанию учащихся, используя приобретенные знания на уроке для оценки влияния химического загрязнения окружающей среды на организм человека и другие объекты.
Задачи (шаги, с помощью которых достигаются цели урока):
Ход урока
I. Организационный момент
Приветствие учащихся, готовность к уроку.
II. Актуализация знаний, проверка домашнего задания
Самостоятельная работа (10 минут) – 6 вариантов.
Расставить степени окисления в соединениях:
III. Новая тема
Демонстрирую: стакан с водой, стакан с песком, образец яшмы, колбу с углекислым газом.
– Что объединяет все эти вещества? (Учащиеся высказывают предположения).
Итак, тема урока: «Оксиды».
На доске написаны формулы оксидов:
Учитель предлагает проанализировать эти формулы.
В ходе анализа справа от формул учитель делает краткую запись на доске, а учащиеся в тетради:
1. Сложные вещества.
На доске написаны формулы веществ:
Учащиеся выбирают формулы оксидов, мотивируя свой выбор.
Учащиеся дают более точное определение оксидам. (Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород со степенью окисления –2). Учащиеся записывают определение в тетрадь.
Учащиеся записывают алгоритм в тетрадь.
Al2О3 – оксид алюминия – глинозём.
SiO2 – Кварц, кремнезём, речной песок, яшма – оксид кремния.
СаО – оксид кальция – негашеная известь.
MnO2 – оксид марганца (IV) – пиролюзит.
MgO – оксид магния – жженая магнезия.
Fe2O3 – оксид железа (III) – красный железняк (гематит).
Те оксиды, с которыми вы познакомились используются человеком в строительстве, для производства металлов, стекла, как поделочные материалы.
IV. Первичное закрепление знаний
Составьте формулы названных в тексте оксидов (одно название оксида – 1 ученик у доски, остальные в тетрадях).
В земной коре – литосфере – находится оксид алюминия ________ (глина), оксид кремния (IV) _____ (песок), оксид железа (III) ______ (содержится в красном железняке). Водная оболочка Земли – гидросфера – оксид водорода _____. В воздухе есть оксид углерода (IV) ______ (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) _____ (угарный газ), оксид серы (IV) ______ (сернистый газ), оксид азота (II) ____ и оксид азота (IV) ______.
Ответ: оксид алюминия – Al2O3, оксид кремния – SiO2, оксид железа (III) – Fe2O3, оксид водорода – Н2О, оксид углерода (IV) – СО2, оксид серы (IV) – SO2, оксид азота (II) – NO, оксид азота (IV) – NO2.
V. Подведение итогов
Мы сегодня научились находить формулы оксидов среди других веществ, называть оксиды и составлять формулы по названиям. Познакомились с отдельными представителями оксидов.
Бинарные соединения
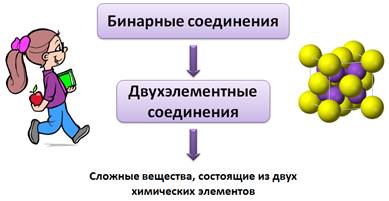
Бина́рные соедине́ния — химические вещества, образованные, как правило, двумя химическими элементами. Термин «бинарные соединения» обычно не применяется в отношении основных и кислотных оксидов. При этом несолеобразующие оксиды включают в бинарные соединения. Многоэлементные вещества, в формульной единице которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения.
Бинарные соединения, несмотря на кажущуюся простоту их химического состава, представляют собой следующий после простых веществ принципиально важный объект изучения природы вещества. С химической точки зрения, этот класс веществ обладает и качественно иными характеристиками, с которыми не приходится сталкиваться при изучении простых веществ. Во-первых, помимо внешних факторов, влияющих на состояние и свойства вещества (температура и давление), здесь появляется и внутренний фактор — состав, и связанная с ним проблема постоянства и переменности состава, имеющая фундаментальное значение в химии. Во-вторых, при описании бинарных соединений впервые формируются такие базисные понятия, как валентность, степень окисления, поляризация химической связи. Здесь, в отличие от простых веществ, появляются гетерополярная составляющая химической связи и все эффекты, связанные с разностью электроотрицательностей компонентов.
Исключительно важную роль играют бинарные соединения с классификационной точки зрения. Многие из них относятся и к так называемым характеристическим соединениям, отражающим типичные степени окисления и их сравнительную стабильность. К таким соединениям относятся прежде всего оксиды, летучие водородные соединения, а также галогениды.
Содержание
Номенклатура
Бинарные соединения — это собирательная группа веществ, которые имеют различное химическое строение. Поэтому их номенклатура может варьироваться в зависимости от генетической принадлежности.
Названия простых бинарных веществ, как правило, образуются добавлением к названию более электроотрицательного элемента суффикса -ид. При необходимости к названиям элементов добавляют кратные приставки или указывают в скобках степень окисления электроположительного элемента без пробела:
В сложных бинарных соединениях суффикс -ид добавляется к названиям элементов, находящихся в низших степенях окисления:
Многие широко известные бинарные соединения носят тривиальные названия, среди них уже приведенный выше фосген, вода H2O аммиак NH3, веселящий газ N2O и другие.
Свойства
Группа бинарных соединений включает в себя очень большое число веществ, и, естественно, все эти вещества различаются по физическим свойствам. Среди бинарных соединений есть представляющие собой при нормальных условиях газы (например, аммиак, фосфин), жидкости (например, тетрахлорид титана TiCl4, дисульфид углерода CS2) и твердые вещества (например, нитрид бора BN, карбид кремния SiC)
Химическая связь в бинарных соединениях — ковалентная полярная (в соединениях неметаллов и некоторых амфотерных элементов) или ионная (в солях бескислородных кислот).
Многие бинарные соединения гидролизуются водой, например фосфин или хлорид алюминия.
Получение
Часто бинарные соединения можно получить прямым взаимодействием простых веществ между собой:
Другие бинарные вещества могут получаться более сложным путем — через реакции обмена или окислительно-восстановительные реакции:
Применение
В силу того, что к данной группе веществ можно отнести очень большое их количество, можно сказать, что бинарные соединения применяются практически во всех областях деятельности человека, от приготовления пищи до использования в качестве сырья для крупнотоннажных производств. Ниже приведены примеры использования некоторых веществ, относящихся к бинарным соединениям.
Аммиак
В химической промышленности аммиак используется в качестве прекурсора для получения азотной кислоты и для производства химических удобрений. Кроме того, аммиак используется в большом количестве разнообразных химических синтезов, в том числе в тонком органическом синтезе. В жидком аммиаке химически растворяются многие вещества, например, калий, натрий, сера. Аммиак применялся в качестве хладагента в первых холодильниках, и до недавнего времени превалировал в промышленных холодильных установках.
Гексафторид урана
Летучий гексафторид урана UF6 применяется для разделения изотопов урана в процессе его обогащения, а также как фторирующий агент.
Карбид вольфрама
Оксид диазота
«Веселящий газ» N2O в смесях с кислородом применяется в медицине как агент для ингаляционного общего наркоза.
Хлороводород
Водный раствор хлороводорода (соляная кислота) широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамата натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Литература
Андреева Л. Л., Лидин Р. А., Молочко В. А. Химические свойства неорганических веществ. Учебное пособие для вузов. — М.: Химия, 1996
Полезное
Смотреть что такое «Бинарные соединения» в других словарях:
Нестехиометрические соединения — Бертоллиды (термин в память К.Л. Бертолле) соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Это нестехиометрические бинарные соединения переменного состава, зависящего от способа получения. Многочисленные… … Википедия
НИКЕЛЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат связь NiЧС. Связь Ni с орг. лигандом может осуществляться по s и p типу (соотв. s и p комплексы). s К о м п л е к с ы. Соед. Ni с s связью NiЧС относятся в осн. к типам [Ni(R2)L2] и [NiX(R)L2] (R = Alk или Аr, L = PR 3, амины и др., Х… … Химическая энциклопедия
МЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ — (металлиды), обладают металлич. св вами, в частности электрич. проводимостью, что обусловлено металлич. характером хим. связи. К М. с. относятся соед. металлов друг с другом интер металлиды и мн. соед. металлов (в осн. переходных) с неметаллами.… … Химическая энциклопедия
полупроводниковые материалы — полупроводники, применяемые для изготовления электронных приборов и устройств. Используют главным образом кристаллические полупроводниковые материалы (например, легированные монокристаллы кремния или германия, химические соединения некоторых… … Энциклопедический словарь
Химическая номенклатура — страдает беспринципностью и синонимизмом, благодаря чему она трудна для изучения (ср. отзыв о ней Дюма Орто). Древние называли различные вещества частью по их происхождению, частью по месторождению, частью же употребляли для них случайные… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Плутоний — 94 Нептуний ← Плутоний → Америций Sm ↑ Pu … Википедия
Неорганическое вещество — или неорганическое соединение это химическое вещество, химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые… … Википедия
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ — кристаллы, образованные из молекул, связанных друг с другом слабыми ван дер ваальсовыми силами или водородной связью (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ, МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ). Внутри молекул между атомами действует более прочная, обычно… … Физическая энциклопедия
Фосфиды — Фосфиды бинарные соединения фосфора с другими менее электроотрицательными химическими элементами, в которых фосфор проявляет отрицательную степень окисления. Получение Большинство фосфидов представляют собой соединения фосфора с типичными… … Википедия
Оксид цезия — Общие … Википедия
Степень окисления. Бинарные соединения
Урок 18. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Степень окисления. Бинарные соединения»
Бинарные соединения еще называют двухэлементными соединениями, потому что «би» от лат. – два. Т.е. бинарные соединения – это сложные вещества, состоящие из двух химических элементов.
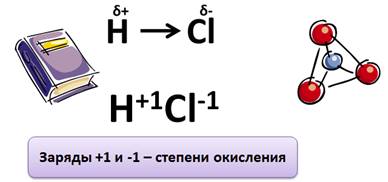
Ковалентная полярная связь
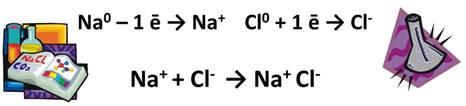
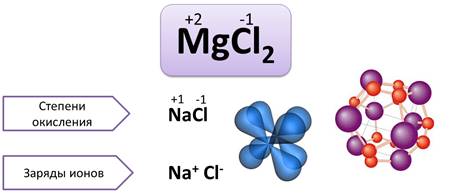
Степень окисления – это условный заряд атомов химического элемента в соединении, если предположить, что оно состоит только из ионов.
Степень окисления может быть положительной, отрицательной и нулевой. Положительную степень окисления имеют как металлы, так и неметаллы, кроме фтора, гелия и неона. Максимальная степень окисления равна номеру группы. Т.е. у N высшая степень окисления равна +5, т.к. он находится в V группе. Отрицательную степень окисления имеют только неметаллы, т.к. они присоединяют электроны до завершения внешнего уровня. Минимальная степень окисления равна № группы – 8. Т.о. у N минимальная степень окисления будет 5 – 8 = –3. Кроме максимальной и минимальной степени окисления есть еще промежуточная степень окисления. Например, у N она равна +3.
Степень окисления F всегда –1, потому что он самый электроотрицательный элемент и принимает электроны при образовании химической связи. Например, в соединении NaF, у F степень окисления (–1).
У кислорода степень окисления –2, потому что он второй элемент по электроотрицательности, исключение cоставляет соединение кислорода с фтором, где его степень окисления +2. Например, в соединении CaO, степень окисления О (–2), а в соединении OF2, степень окисления О (+2).
У металлов степень окисления всегда положительная, т.к. они отдают электроны другим атомам. Степень окисления металлов А групп численно совпадает с валентностью. Например, в соединении Na2O степень окисления Na (+1), т.к. он является металлом, значит, у него только положительная степень окисления, а 1, потому что он является металлом I A группы, значит, и валентность его – единица. Аналогично и в соединении BaS, степень окисления Ва (+2), т.к. он металл II A группы, в соединении Al2O3, степень окисления Al (+3), т.к. это металл III А группы.
Степень окисления Н всегда (+1), за исключением его соединений с металлами, где у него степень окисления (–1). Например, CaH2, KH, LiH, в этих соединениях у водорода степень окисления (–1).
Как было сказано, валентность численно совпадает со степенью окисления. Однако не всегда. Степень окисления имеет знак заряда, а валентность – нет.
Валентность – это число связей, которыми атом связан с другими атомами, а степень окисления – это условный заряд атомов.
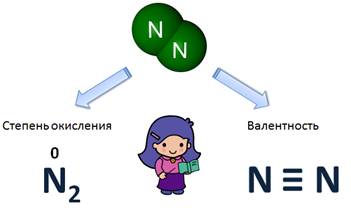
Сравним валентность и степень окисления у азота (N2). Степень окисления равна 0, т.к. это простое вещество, а вот валентность равна III, потому что атом азота связан с другим атомом азота тройной связью.
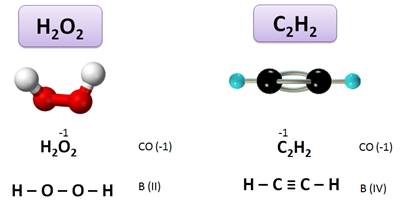
Или в пероксиде (Н2О2) степень окисления О (–1), а валентность равна II, т.к. О связан двумя связями с атомами водорода: Н – О – О – Н.
А в ацетилене (С2Н2) степень окисления С (–1), а валентность IV:
Учитывая, что суммарная степень окисления равна 0, можно найти степени окисления элементов в соединении, а также составить формулу соединения, зная степени окисления.
Определим степени окисления элементов в соединении Fe2O3. Степень окисления О нам известна (–2). Следовательно, три атома О будут иметь общий заряд (–6), т.к. (–2) · 3 = –6. Тогда общий заряд двух атомов железа будет равен (+6), помните, что суммарный заряд равен 0. Значит, степень окисления одного атома Fe будет (+3), т.к. (+6) ׃ 2 = +3.
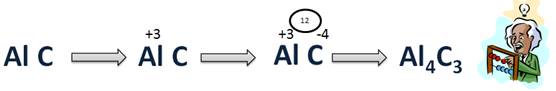
Составим формулу соединения Al с C. Для этого запишем символы элементов Al, C. Углерод на втором месте, потому что он более электроотрицательный. Al – элемент III A группы. Он является металлом, поэтому он отдаст свои 3 электрона и получит степень окисления (+3), а С – элемент IV A, он примет еще 4 электрона для завершения своего внешнего уровня, на котором уже есть 4 электрона, при этом получит степень окисления (–4). Запишем значения степеней окисления в формулу сверху. Теперь найдем наименьшее общее кратное. Оно будет 12. Затем НОК разделим на абсолютные значения степеней окисления и получим соответствующие индексы. 12 : 3 = 4, значит индекс у Al – 4, 12 : 4 = 3, значит индекс у С – 3. Следовательно, формула будет Al4C3.
Чтобы дать название бинарному соединению нужно сделать следующим образом: сначала называют более электроотрицательный элемент – это неметалл. Его латинское название стоит в именительном падеже и употребляется с суффиксом – ид. Например: оксид, хлорид, сульфид, нитрид. Второе слово обозначает элемент менее электроотрицательный, его название стоит в родительном падеже.
Na2S – сульфид натрия, K2O – оксид калия, BaCl2 – хлорид бария, Mg3N2 – нитрид магния. Если элемент имеет переменную степень окисления, то после названия в скобках римскими цифрами указывают степень окисления. Например, назовём следующие соединения: MnO2, CO2, P2O5.
Название бинарного соединения
В некоторых случаях, число атомов элементов обозначают при помощи названий числительных на греческом языке. Т.е. 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента и т.д. Например, СО – монооксид углерода, или оксид углерода (II); СО2 – диоксид углерода, или оксид углерода (IV).
Для того чтобы химики всего мира понимали друг друга, необходимо было создать единую терминологию и номенклатуру, т.е. названия веществ. Впервые в 1785 г. такими учеными, как А. Лавуазье, А. Фуркруа, Л. Гитоном де Мерво и К. Бертолле, были разработаны принципы номенклатуры. В настоящее время принципы номенклатуры и терминологии разрабатывает Международный союз теоретической и прикладной химии (ИЮПАК).