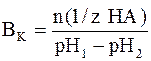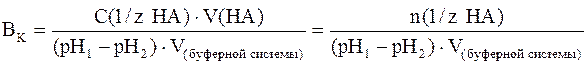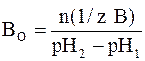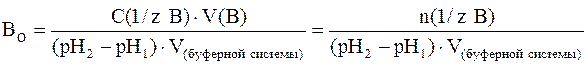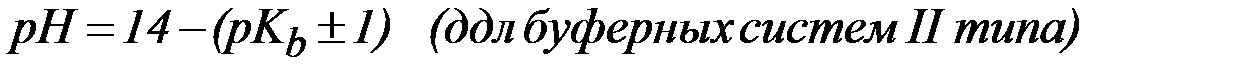Что такое буферная емкость химия
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Буферная емкость
Тема: Буферная емкость.
Мотивация изучения темы. Знание свойств буферных систем и умение применять их для решения практических задач врачу необходимо потому, что буферные системы играют ведущую роль в поддержании кислотно-щелочного равновесия (КЩР) в организме как в физиологических условиях, так и в условиях патологии.
Способность буферных систем сохранять постоянство рН ограничена. Увеличивать концентрацию кислоты и щелочи, существенно не меняя рН буферного раствора, можно лишь в ограниченных количествах.
Буферные системы имеют две количественные характеристики – рН и буферную емкость (β). Буферная емкость – предел, в котором проявляется буферное действие, т. е. способность сохранять значение рН при внесении кислот или оснований.
Цель: Изучить буферную емкость, буферные системы организма.
1. Приобрести навыки расчета буферной емкости по кислоте и по щелочи.
2. Закрепить навыки расчета рН буферных систем.
Задания для самостоятельной работы студента во внеучебное время (самоподготовка).
А. Контрольные вопросы
1. Типы буферных растворов (название, состав).
2. Механизм буферного действия (на примере кислотного и основного буферных растворов).
3. Расчет рН буферных систем (уравнение Гендерсона-Гассельбаха для расчета рН кислотного и основного буферных растворов).
4. Факторы, влияющие на рН буферного раствора.
5. Буферная емкость (определение, формулы расчета, единицы измерения).
6. Факторы, влияющие на буферную емкость.
Б. Список рекомендуемой литературы:
4. Практикум по общей и биоорганической химии /под ред. – 3-е изд.-М.: изд. центр «Академия», 2008.-240с
В. Обучающий материал.
Буферной емкостью (β) называют величину, измеряемую числом моль или ммоль эквивалента кислоты или щелочи, которое нужно добавить к 1л буферного раствора, чтобы изменить его рН на единицу.
Буферная емкость характеризует способность буферного раствора противодействовать смещению реакции среды при добавлении кислоты или щелочи. Математически буферная емкость определяется следующим образом:
а) буферная емкость по кислоте: б) буферная емкость по щелочи:


V(HA), V(B) – объемы добавленной кислоты НА или щелочи В (мл или л);


V(б. р.) – объем буферного раствора (мл или л);
Единица измерения буферной емкости – моль/л. Буферная емкость зависит от ряда факторов:
1. Чем больше количества компонентов кислотно-основной пары: основание/сопряженная кислота в растворе, тем выше буферная емкость этого раствора.
Допустим, имеются два ацетатных буфера, концентрация компонентов в которых составляет 10 и 100 ммоль/л. Соотношение [кислота] : [соль] у них одинаково:
1)
рН этих растворов одинаков. При добавлении к ним по 5 ммоль HCl прореагируют по 5 ммоль соли, и образуется по 5 ммоль слабой кислоты СН3СООН. Соотношение компонентов станет равным соответственно:
1) 
Таким образом, рН первого буфера резко сместится, рН второго – почти не изменится. Следовательно, чем выше концентрация компонентов буферного раствора, тем устойчивее величина их соотношения, тем выше буферная емкость.
2. Буферная емкость зависит от соотношения концентраций компонентов буферного раствора. Чем ближе это соотношение к единице, тем выше буферная емкость. Следовательно, буферная емкость зависит от рН раствора.
Возьмем два ацетатных буфера, содержащих в сумме равное количество кислоты и соли (по 100 ммоль):
1) 
В результате добавления к каждому буферу по 10 ммоль HCl величины дробей изменятся:
1) 
Во втором буфере, где дробь была равна единице, величина ее изменилась меньше, чем в первом буфере. Следовательно, наибольшей буферной емкостью обладают растворы, в которых соотношение компонентов буфера приближается к единице (при равном значении числителя и знаменателя дроби).
Таким образом, если рН буферного раствора зависит только от константы диссоциации слабой кислоты или основания и соотношения концентраций компонентов буфера, то буферная емкость зависит и от соотношения концентраций компонентов буфера, и от концентраций компонентов буферного раствора.
Г. Обучающие задачи
Задача №1 К 100мл крови для изменения рН от 7,36 до 7,0 надо добавить 36мл 0,05н раствора HCl. Рассчитайте буферную емкость крови по кислоте.
V(крови)= 100мл
C(fэквHCl)= 0,05моль/л
Ответ: βк = 0,05 моль/л.
Д. Задачи для самостоятельного решения.
Задача 1. Рассчитать объем HCl (концентрация 0,1 моль/л), который нужно прибавить к 1л крови, чтобы изменить рН от 7,36 до 7,0. Буферная емкость по кислоте равна 0,01 моль/л. (Ответ: 36мл).
Задача 2. Рассчитать рН бикарбонатного буфера, в котором соотношение кислоты к соли 4:3. К(Н2СО3) = 3,3·10-7
Задача 3. Рассчитать рН аммиачного буферного раствора, в котором соотношение основания к соли 5:2. К (NH4OH) = 1,78 ×10-5. (Ответ: рН = 9,65)
Буферная емкость



Способность буферных систем противодействовать резкому изменению рН при добавлении к ним сильной кислоты или основания является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество вносимых в раствор сильной кислоты или щелочи не превышает определенной величины. В противном случае наблюдается резкое изменение рН, т.е. буферное действие раствора прекращается.
Это связано с тем, что в результате протекающей реакции изменяется соотношение молярных концентраций компонентов буферной системы: Скислоты/Ссоли или Соснования/Ссоли.
При этом концентрация компонента, реагирующего с добавленной кислотой или щелочью, уменьшается, а концентрация второго компонента возрастает, т.к. он дополнительно образуется в ходе реакции.
Количественно буферное действие раствора характеризуется с помощью буферной емкости (В). При этом различают буферную емкость по кислоте (Вк.) и буферную емкостьпо основанию или щелочи (Во.).
Буферной емкостью по кислоте является то количество химического эквивалента сильной кислоты, которое нужно добавить к 1 литру (1 дм 3 ) буферной системы, чтобы уменьшить её рН на единицу. Ее можно рассчитать по следующей формуле:
где n(1/z HA) – число молей химического эквивалента сильной кислоты, добавленное к 1 литру буферной системы;рН1 – водородный показатель системы до добавления сильной кислоты;рН2 – водородный показатель системы после добавления сильной кислоты.
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем, выраженный в литрах или дм 3 ) формула для подсчета буферной емкости будет иметь следующий вид:
где С(1/z НА) – молярная концентрация химического эквивалента сильной кислоты в добавляемом растворе; V(НА) – объем (л) добавленного раствора сильной кислоты; V(буферной системы) – объем буферного раствора, к которому добавляют раствор кислоты.
Соответственно буферной емкостью по основанию является то количество химического эквивалента сильного основания (щелочи), которое нужно добавить к 1 литру (1 дм 3 ) буферной системы, чтобы вызвать увеличение ее рН на единицу:
где n(1/z В) – число молей химического эквивалента основания, которое добавили к 1 литру буферного раствора; рН1 – водородный показатель раствора до добавления основания; рН2 – водородный показатель раствора после добавления основания.
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем) формула для подсчета буферной емкости по основанию примет следующий вид:
где С(1/z В) – молярная концентрация химического эквивалента основания в добавляемом растворе; V(В) – объем (л) добавленного раствора сильного основания; V(буферной системы) – объем буферного раствора (л), к которому добавляют раствор сильного основания.
Буферная емкость. От каких факторов зависит.



Буферная емкость(В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
Буферная емкость зависит от ряда факторов:
1. Чем больше абсолютное содержание компонентов пары основание/сопряженная кислота, тем выше буферная емкость буферного раствора.
2. Буферная емкость зависит от соотношения количеств компонентов буферного раствора, а следовательно, и от рН буфера. Буферная емкость максимальна при равных количествах компонентов буферной системы и уменьшается с отклонением от этого соотношения.
3. При различном содержании компонентов буферные емкости раствора по кислоте и по щелочи отличаются.
Расчет величины рН буферных растворов.
Область (зона) буферного действия отличается от 

Понятие растворимости. Какие факторы влияют на растворимость твердых веществ.
Растворимость вещества (Р)– молярная концентрация вещества в насыщенном растворе.
Растворимость твердых веществ зависит от:
· природы растворенного вещества и растворителя
Растворимость газов зависит от:
Произведение растворимости малорастворимого сильного электролита. Расчет ПР.
В насыщенном растворе малорастворимого сильного электролита при данной температуре произведение молярных концентраций его ионов, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная и называется произведением растворимости.