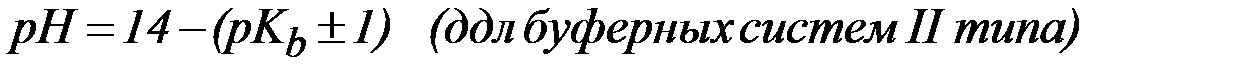Что такое буферная емкость раствора
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Буферная ёмкость раствора
Буферная ёмкость раствора (от англ. buffer — амортизатор, англ. buff — смягчать толчки) — такое количество кислоты или основания, нужное для изменения pH буферного раствора ровно на 1.
Буферный раствор
Буферная смесь, буферный раствор, буферная система — сочетание веществ, система, поддерживающая постоянство pH.
Примечания
Полезное
Смотреть что такое «Буферная ёмкость раствора» в других словарях:
буферная ёмкость раствора — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN buffer capacity … Справочник технического переводчика
Буферная ёмкость — Буферная ёмкость: Буферная ёмкость раствора способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+). Буферная ёмкость способность экосистемы противостоять загрязнению. Буферная… … Википедия
Фиксаж — Основная статья: Фиксирование (фотография) Не следует путать с фиксативом. Фиксаж (фр. fixage, от лат. fixus прочный, закреплённый), или закрепитель в фотографии раствор веществ, предназначенный для закрепления… … Википедия
Выщелачивание подземное — (a. underground leaching; н. Untertage Auslaugung; ф. ljxiviation en place; и. lixiviacion subterranea) способ разработки рудных м ний избират. переводом полезного компонента в жидкую фазу в недрах c последующей переработкой… … Геологическая энциклопедия
Буферные растворы. Буферная емкость. Механизм действия буферных растворов. Применение их в анализе. Роль буферных растворов в процессах жизнедеятельности
В лабораторной практике часто приходится работать с растворами, которые имеют определенное значение рН. Такие растворы называют буферными.
Буферные растворы – растворы, рН которых практически не изменяется при добавлении к ним небольших количеств кислот и оснований или при их разбавлении.
Буферные растворы могут быть четырех типов:
1. Слабая кислота и её соль. Например, ацетатный буферный раствор СН3СООН + СН3СООNа (рН=4,7).
2. Слабое основание и его соль. Например, аммиачный буферный раствор NH4OH + NH4Cl (рН=9,2).
3. Раствор двух кислых солей. Например, фосфатный буферный раствор NaH2PO4 + Na2HPO4 (рН=8). В этом случае соль играет роль слабой кислоты.
Аминокислотные и белковые буферные растворы.
Механизм действия.
СН3СООNа + НСl = СН3СООН + NаСl
При добавлении к ацетатному буферному раствору щелочи (например, NaОН) происходит реакция:
Буферная емкость.
Всякий буферный раствор практически сохраняет постоянство рН лишь до прибавления определенного количества кислоты или щелочи, то есть обладает определенной буферной емкостью.
Буферная емкость – то предельное количество (моль) сильной кислоты или щелочи, которое можно добавить к 1 л буферного раствора, чтобы рН его изменился не более чем на единицу.
Приготовление.
Буферные свойства проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого. Поэтому буферные растворы часто готовят смешением растворов равной концентрации обоих компонентов либо прибавлением к раствору одного компонента соответствующего количества реагента, приводящего к образованию равной концентрации сопряженной формы.
Для приготовления аммиачной буферной смеси смешивают 100 мл раствора NH4Cl с массовой долей его 10% и 100 мл раствора NH4OH с массовой долей 10% и разбавляют полученную смесь дистиллированной водой до 1 л.
Применение.
Буферные растворы широко применяются в химическом анализе, биохимическом анализе для создания и поддержания определенного значения рН среды при проведении реакций.
Например, ионы Ва 2+ отделяют от ионов Са 2+ осаждением дихромат-ионами Сr2О7 2- в присутствии ацетатного буферного раствора; при определении многих катионов металлов с помощью трилона Б методом комплексонометрии используют аммиачный буферный раствор.
Буферные растворы обеспечивают постоянство биологических жидкостей и тканей. Главными буферными системами в организме являются гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Причем, действие всех буферных систем взаимосвязано. Поступившие из вне или образовавшиеся в процессе обмена веществ ионы водорода связываются одним из компонентов буферных систем. Однако, при некоторых заболеваниях может происходить изменение значения рН крови. Смещение значения рН крови в кислую область от нормальной величины рН 7,4 называется ацидозом, в щелочную область – алкалозом. Ацидоз возникает при тяжелых формах сахарного диабета, длительной физической работе и при воспалительных процессах. При тяжелой почечной или печеночной недостаточности или при нарушении дыхания может возникнуть алкалоз.
Буферная емкость. От каких факторов зависит.



Буферная емкость(В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
Буферная емкость зависит от ряда факторов:
1. Чем больше абсолютное содержание компонентов пары основание/сопряженная кислота, тем выше буферная емкость буферного раствора.
2. Буферная емкость зависит от соотношения количеств компонентов буферного раствора, а следовательно, и от рН буфера. Буферная емкость максимальна при равных количествах компонентов буферной системы и уменьшается с отклонением от этого соотношения.
3. При различном содержании компонентов буферные емкости раствора по кислоте и по щелочи отличаются.
Расчет величины рН буферных растворов.
Область (зона) буферного действия отличается от 

Понятие растворимости. Какие факторы влияют на растворимость твердых веществ.
Растворимость вещества (Р)– молярная концентрация вещества в насыщенном растворе.
Растворимость твердых веществ зависит от:
· природы растворенного вещества и растворителя
Растворимость газов зависит от:
Произведение растворимости малорастворимого сильного электролита. Расчет ПР.
В насыщенном растворе малорастворимого сильного электролита при данной температуре произведение молярных концентраций его ионов, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная и называется произведением растворимости.