Что такое буллы в легких с обеих сторон
Буллезная болезнь легких. Буллы лёгких
1. Общие сведения
Дыхательная система человека, казалось бы, идеально приспособлена и «сконструирована» эволюцией для газообменных процессов, и единственное, что может снизить ее КПД – это недостаточное содержание кислорода в воздухе. Однако это, к сожалению, далеко не так. Органы дыхания сложны по строению и подвержены многочисленным заболеваниям, некоторые из которых связаны не с недостатком, а с избытком воздуха, завоздушиванием внутренних полостей легочно-бронхиальной газообменной системы.
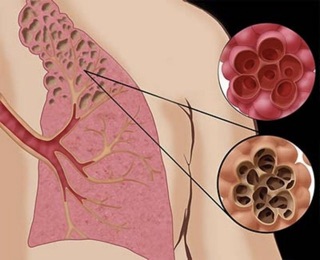
Многим известно слово «эмфизема», которое означает избыточное содержание или скопление воздуха там, где его не должно быть вообще – как, например, при эмфиземе легких (патологическое расширение альвеол) или эмфиземе подкожной (возникающей при некоторых видах легочной травмы). Иногда говорят также об эмфиземе буллезной, или просто о буллезной болезни (буллы легких); можно встретить термины «блебы» (от англ. blebs – пузыри), «буллезное легкое», «ложная легочная киста» и т.д. В общей сложности употребляется свыше 20 очень близких по смыслу нозологических определений, – что и создает некоторую путаницу, поскольку каждый из терминов подразумевает те или иные нюансы сходных, но не тождественных патологических изменений.
Согласно одному из наиболее точных определений, которое было дано на международном CIBA-симпозиуме в 1958 году, буллой следует считать воздушную полость размером более 1 см (в отличие от более мелких пузырей-блебов, которые представляют собой скопления воздуха под плеврой и в легочной ткани). Таким образом, буллы – это патологическое расширение легочных альвеол, в значительной степени утративших эластичность и способность сокращаться до нормальных размеров; буллезная болезнь (буллезная эмфизема) – расширение, увеличение легких за счет образования булл, гигантские варианты которых могут достигать 10 см в диаметре.
Статистические данные выявляют ряд возрастных и гендерных тенденций в структуре заболеваемости. В частности, установлено почти двукратное преобладание мужчин среди пациентов с буллезной болезнью, прямая корреляция частоты выявления с возрастом обследованных, и т.п.
2. Причины
Этиопатогенез буллезной болезни остается предметом исследований и обсуждений. К основным причинам формирования альвеолярных булл относят, в частности, инфекционные заболевания легких, возрастные дистрофические изменения в стенках альвеол, экологические факторы (загрязнение воздуха в крупных городах), наличие хронического бронхита, туберкулеза, бронхиальной астмы. Во всех без исключения исследованиях, посвященных данной проблеме, подчеркивается патогенная роль курения; так, те или иные изменения эмфиматозного типа обнаруживаются у 99% курильщиков, и этот фактор риска является доминирующим в 90% случаев диагностированной буллезной болезни.
В ряде исследований подтверждается также роль таких факторов, как высокая плотность населения и низкий социально-экономический уровень развития региона (следствием чего является нездоровый рацион питания), переохлаждения, врожденные аномалии ферментогенеза и др.
3. Симптомы и диагностика
Буллезная болезнь чревата сокращением содержания связанного кислорода в крови и нарушениями вывода отработанной углекислоты; это может привести к сердечной недостаточности (вплоть до остановки сердечной деятельности) и ряду других серьезных осложнений – в частности, истончению и разрыву альвеолярных стенок при интенсивной физической нагрузке или сильном кашле, воспалениям легочных мешков и т.д.
Однако начальные стадии, как правило, бессимптомны; лишь при значительной площади легочной ткани, пораженной буллезными расширениями, появляется одышка, физическая и умственная утомляемость, снижение массы тела (нередко с непропорциональным расширением межреберных пространств и грудной клетки в целом), хрипы и присвист в дыхании, «мокрый» кашель. По мере нарастания сердечной и дыхательной недостаточности присоединяется специфическая симптоматика в виде болей в груди, цианозной бледности, характерного цвета ногтей и пр.
Диагностика проводится с применением спирометрической аппаратуры, рентгеновских и томографических методов, лабораторных анализов крови (вкл. специальное исследование процессов газообмена).
4. Лечение
Следует отметить, что на данном этапе развития медицины патологические изменения легочной паренхимы являются необратимыми; таким образом, речь может вестись только о приостановлении процесса и паллиативном смягчении его последствий. Решающее значение имеет стадийность: чем раньше выявлена буллезная тенденция, тем эффективней указанные меры. Лечение обычно носит комплексный или комбинированный характер, т.е. может включать как консервативные, так и радикальные подходы (малоинвазивное хирургическое вмешательство эффективней медикаментозной терапии). В зависимости от установленной этиологии и доминирующей симптоматики, могут быть показаны диуретики, бронхолитики, антибиотики (при наличии сопутствующего или фонового воспаления), гормональные средства. Назначается также особая дыхательная гимнастика и ЛФК, периодические курсы профилактического лечения. Строго обязательным является пожизненное исключение вредных привычек и нормализация образа жизни; в некоторых случаях рекомендуется сменить место работы, – если есть основания считать профессиональную вредность одним из этиопатогенетических факторов.
При соблюдении всех перечисленных выше условий прогноз сравнительно благоприятный; в противном случае буллезная болезнь прогрессирует, результатом чего является инвалидность, а при дальнейшем утяжелении легочно-сердечной недостаточности – летальный исход.
Лечение пациентов с буллезной эмфиземой на фоне дисплазии соединительной ткани в первичном звене здравоохранения
Спонтанный пневмоторакс (СП) — состояние, возникающее в результате скопления воздуха в плевральной полости вследствие возникновения патологического сообщения плевральной полости с воздухоносными путями, не связанное с травмами или лечебными воздействиями
Спонтанный пневмоторакс (СП) — состояние, возникающее в результате скопления воздуха в плевральной полости вследствие возникновения патологического сообщения плевральной полости с воздухоносными путями, не связанное с травмами или лечебными воздействиями [1]. По мнению большинства авторов, непосредственной причиной СП является буллезная эмфизема с прогрессирующим истончением стенок и разрывом субплеврально расположенных эмфизематозных булл и субплевральных пузырей [3, 6, 9].
В современной литературе исследователи рассматривают буллезную эмфизему легких и СП как одно из многочисленных проявлений прогредиентного системного процесса, обусловленного наследственным поражением соединительной ткани. Не вызывает сомнения и отражена в соответствующих диагностических алгоритмах высокая вероятность развития буллезной эмфиземы и спонтанного пневмоторакса при относительно редко встречающихся генетических синдромах, например, синдроме Марфана и Элерса–Данло [10]. Однако гораздо большее практическое значение имеет высокий риск возникновения СП при недифференцированных формах дисплазии соединительной ткани (ДСТ), признаки которой широко распространены в популяции и являются предметом изучения специалистов самого разного профиля.
В работах, посвященных ДСТ, есть сообщения о высокой частоте встречаемости случаев спонтанного пневмоторакса у лиц молодого возраста. Так, в наблюдениях Г. И. Нечаевой у пациентов в возрасте 18–35 лет с признаками ДСТ распространенность спонтанного пневмоторакса составила около 10% [7], С. М. Гавалов и В. В. Зеленская, наблюдая детей с бронхиальной астмой на фоне ДСТ, зарегистрировали развитие СП у 5% пациентов, причем в половине случаев осложнение не было связано с тяжелым приступом удушья [4]. Г. П. Василенко и Г. Н. Верещагина использовали термин «диспластическое легкое», основным проявлением которого считали спонтанный пневмоторакс, причем отмечали склонность к рецидивирующему течению и большой вероятности послеоперационных осложнений [2]. Имеются данные, подтверждающие значение генетически обусловленной «слабости» соединительной ткани в развитии буллезной эмфиземы. Так, В. И. Нечаев указывает, что генетические маркеры ДСТ среди больных с буллезной эмфиземой встречаются в 8,9 раз чаще, чем среди практически здоровых лиц [5]. По нашим данным среди пациентов с первичным СП признаки ДСТ диагностируются в 75% случаев. Доминирующими являются признаки, связанные с нарушениями формообразования костного скелета, которые характеризуются как костно-суставной синдром. Почти 70% пациентов имеют астенический тип конституции, более чем в половине случаев диагностируются нарушения осанки за счет деформации позвоночника, у трети пациентов наблюдаются различные варианты деформации грудной клетки, а также гипотония и гипотрофия мышц [8].
Задачи по восстановительному лечению пациентов с ДСТ после перенесенного первичного СП и профилактике прогрессирования буллезных изменений в легких не могут быть решены в полной мере, если во внимание не будет принято наличие других проявлений системного диспластического процесса, требующих индивидуального дифференцированного подхода.
Пациентам с ДСТ после перенесенного эпизода первичного СП проводится программа реабилитации, рассчитанная на два 12?недельных курса при посещении занятий 3 раза в неделю. Комплексное восстановительное лечение включает образовательные программы, дозированные физические нагрузки, респираторную гимнастику, рациональную психотерапию. Для коррекции вегетативной дисфункции, стабилизации синтеза коллагена и других компонентов соединительной ткани, стимуляции метаболических и коррекции биоэнергетических процессов пациентам с ДСТ проводится метаболическая терапия по следующим направлениям: стимуляция коллагенообразования (аскорбиновая кислота, витамины группы В, препараты меди, цинка, магния, кальция, антигипоксанты); коррекция нарушений синтеза и катаболизма гликозаминогликанов (хондроитинсульфат (Хондроксид), глюкозамина сульфат (ДОНА)), стабилизация минерального обмена (витамин D2 и его активные формы, препараты кальция); коррекция уровня свободных аминокислот крови (метионин, глутаминовая кислота, глицина); улучшение биоэнергетического состояния организма (Рибоксин, Милдронат и Мексидол).
Назначение препаратов магния у пациентов с буллезной эмфиземой легких на фоне признаков ДСТ имеет важное значение для достижения сбалансированной активности коллагеназ и эластаз, а также биосинтетических ферментов глюкозаминогликанов с целью уменьшения прогрессирования буллезных изменений в легких.
Магнерот ® — препарат магния. Действующее вещество магния оротат. В состав препарата входит оротовая кислота, которая способствует росту клеток, участвует в процессе обмена веществ. Оротовая кислота (которую называют также витамином В13), помимо участия в обмене магния, обладает собственной метаболической активностью: соединение является одним из метаболических предшественников пиримидиновых нуклеотидов, что необходимо для нормального хода анаболических процессов. Магнерот® назначается пациентам по 2 таблетки 3 раза/сутки в течение 7 дней, затем — по 1 таблетке 2–3 раза/сутки ежедневно. Продолжительность курса лечения — не менее 4–6 недель.
Для оценки эффективности восстановительного лечения с использованием препарата Магнерот ® проведено проспективное сравнительное исследование, в которое включено 45 пациентов с ДСТ после перенесенного эпизода первичного СП (39 мужчин и 6 женщин, средний возраст 22 (19–26) года). В качестве группы сравнения были привлечены результаты обследования 34 пациентов с буллезной эмфиземой и ДСТ после эпизода СП, по каким-либо причинам отказавшихся от реабилитационных мероприятий. Основная группа и группа сравнения были сопоставимы по полу, возрасту и характеру хирургического пособия.
У пациентов с ДСТ после перенесенного первичного СП, которые прошли комплексную программу реабилитации, реже наблюдались жалобы на ограничение физической активности и значительно уменьшилась одышка по шкале MRS (табл. 1).
Как следует из табл. 2, у пациентов основной группы после восстановительного лечения значительно увеличились скоростные и объемные показатели функции внешнего дыхания (жизненная емкость легких (ЖЕЛ), объем форсированного выдоха за первую секунду (ОФВ1), отношение ОФВ1 к форсированной ЖЕЛ (ОФВ1/ФЖЕЛ), мгновенная объемная скорость после выдоха 50% ФЖЕЛ (МОС50%) и средняя объемная скорость середины выдоха (СОС25–75%)) и статистически значимо превышали аналогичные показатели контрольной группы.
У пациентов после прохождения восстановительного лечения статистически значимо увеличились показатели силы дыхательных мышц по сравнению с группой сравнения (табл. 3).
.gif)
.gif)