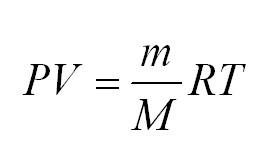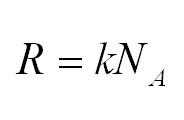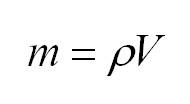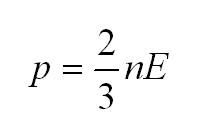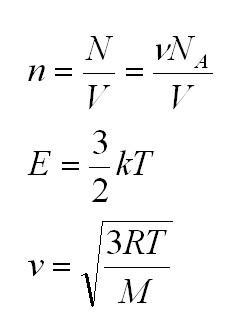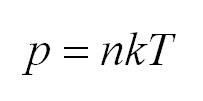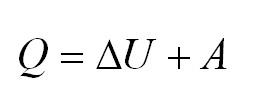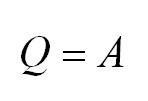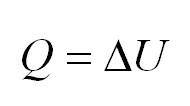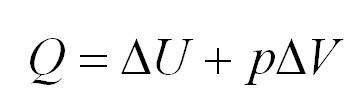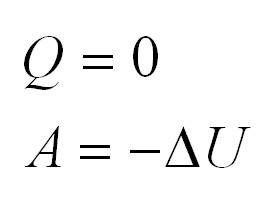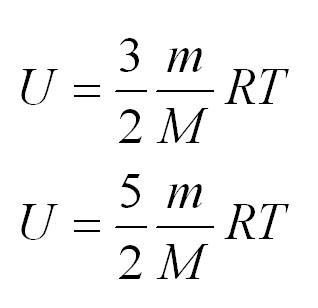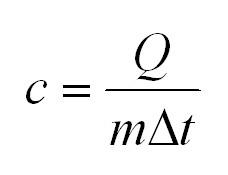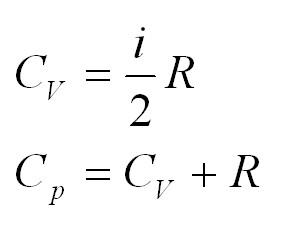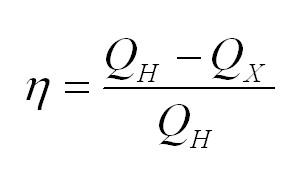Что такое дельта в термодинамике
Первый закон термодинамики. Как рассказать просто о сложном?
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях.
1. Определение первого закона термодинамики
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях. Собственно, именно с анализа принципов первых тепловых машин, паровых двигателей и их эффективности и зародилась термодинамика. Можно сказать, что этот раздел физики начинается с небольшой, но очень важно работы молодого французского физика Николя Сади Карно.
Самым важным законом, лежащим в основе термодинамики является первый закон или первое начало термодинамики. Чтобы понять суть этого закона, для начала, вспомним что называется внутренней энергией. ВНУТРЕННЯЯ ЭНЕРГИЯ тела — это энергия движения и взаимодействия частиц, из которых оно состоит. Нам хорошо известно, что внутреннюю энергию тела можно изменить, изменив температуру тела. А изменять температуру тела можно двумя способами:
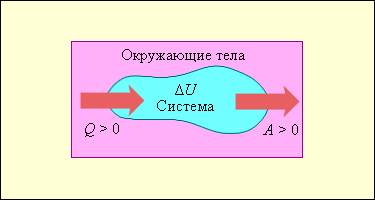
Нам, также известно, что работа, совершаемая газом, обозначается Аг, а количество переданной или полученной внутренней энергии при теплообмене называется количеством теплоты и обозначается Q. Внутреннюю энергию газа или любого тела принято обозначать буквой U, а её изменение, как и изменение любой физической величины, обозначается с дополнительным знаком Δ, то есть ΔU.
Сформулируем ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ для газа. Но, прежде всего, отметим, что когда газ получает некоторое количество теплоты от какого-либо тела, то его внутренняя энергия увеличивается, а когда газ совершает некоторую работу, то его внутренняя энергия уменьшается. Именно поэтому первый закон термодинамики имеет вид:
Так как работа газа и работа внешних сил над газом равны по модулю и противоположны по знаку, то первый закон термодинамики можно записать в виде:
Понять суть этого закона довольно просто, ведь изменить внутреннюю энергию газа можно двумя способами: либо заставить его совершить работу или совершить над ним работу, либо передать ему некоторое количество теплоты или отвести от него некоторое количество теплоты.
2. Первый закон термодинамики в процессах
Применительно к изопроцессам первый закон термодинамики может быть записан несколько иначе, учитывая особенности этих процессов. Рассмотрим три основных изопроцесса и покажем, как будет выглядеть формула первого закона термодинамики в каждом из них.
3. Применение
Первое начало термодинамики (первый закон) имеет огромное значение в этой науке. Вообще понятие внутренней энергии вывело теоретическую физику 19 века на принципиально новый уровень. Появились такие понятия как термодинамическая система, термодинамическое равновесие, энтропия, энтальпия. Кроме того, появилась возможность количественного определения внутренней энергии и её изменения, что в итоге привело учёных к пониманию самой природы теплоты, как формы энергии.
Ну, а если говорить о применении первого закона термодинамики в каких-либо задачах, то для этого необходимо знать два важных факта. Во-первых, внутренняя энергия идеального одноатомного газа равна: 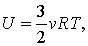
Первый закон термодинамики



Связь тепловых эффектов qP(∆H)и qV(∆U)…
Хими́ческая термодина́мика — раздел физической химии, изучающий процессы химического взаимодействия веществ методами термодинамики. Химическая термодинамика базируется на двух основных законах, называемых также первым и вторым началами термодинамики. Первый закон термодинамики обычно известен как закон сохранения энергии. Первый закон термодинамики не может быть выведен математически, его содержание вытекает из обобщения многолетнего опыта человечества. Первые идеи о законе сохранения материи и ее движения были высказаны в 1748 г. Ломоносовым. Уже тогда он считал, что причиной теплоты является движение молекул вещества. Идеи Ломоносова получили подтверждение в работах Майера, Гельмгольца и Джоуля, которые установили, что теплота и работа являются энергетически эквивалентными эффектами, свидетельствующими об изменении внутренней энергии системы.
Первый закон термодинамики формулируется следующим образом: изменение внутренней энергии закрытой системы определяется количеством переданной теплоты и совершенной работы.
Математическая форма первого закона:
В изолированной системе ∆U = 0, значение внутренней энергии не изменяется, так как q = 0 и A = 0.
Состояние системы можно описать рядом свойств, но для однозначной его характеристики достаточно знать четыре свойства, наиболее легко определяемых экспериментально: давление р, объем V, температуру T и концентрацию C. Эти свойства называют термодинамическими параметрами системы. От их значений в начальном и конечном состояниях системы зависит изменение внутренней энергии и остальных термодинамических функций.
Таким образом, после перехода закрытой системы из начального состояния в конечное приращение движения во всех его формах (∆U) в системе равно движению, полученному системой через ее границы в форме теплоты, минус движение, отданное системой через ее границы в форме работы расширения.
Разность q-A в общем случае определяет только приращение внутренней энергии системы, но не значение этой энергии в данном состоянии системы.
Независимость значения разности q-A от пути процесса является следствием сохранения и превращения движения, следствием эквивалентности между теплотой и работой.
· Количество выделившейся или поглощенной теплоты в конкретной химической реакции называется ее тепловым эффектом.
Тепловой эффект относят либо ко всей реакции (единица — кДж), либо к 1 моль одного из реагентов- или продуктов реакции (единица — кДж/моль), а значение q записывают со знаком минус для экзотермической реакции и со знаком плюс для эндотермической реакции. Например:
Так как тепловой эффект зависит от агрегатного состояния вещества, его обозначают нижними индексами справа у химических формул.
Согласно первому закону термодинамики при поддержании в системе неизменным ее объема (∆V = O) и при отсутствии других видов работы Am = 0 и, следовательно, ∆U= qV.
При поддержании постоянства давления в системе и отсутствии других видов работ, кроме работы расширения AM = р∆V, тепловой эффект реакции будет равен
Для перехода системы из начального (1) в конечное (2) состояние можно записать:
Сумма U + pV является функцией состояния системы и называется энтальпией H: H = U + pV.
С учетом этого обозначения выражение можно привести к виду
Таким образом, тепловой эффект реакции, проведенной при постоянном давлении, есть изменение энтальпии.
Поскольку значение ∆Н зависит от термохимических параметров, систему приводят к стандартному состоянию. Таким стандартным состоянием являются обязательное равенство температур исходных веществ и продуктов реакции и поддержание постоянного давления каждого газообразного участка реакции, равного 1 атм (101325 Па) или внешнего атмосферного давления в 1 атм, если все участники реакции находятся в твердом или жидком состоянии. Изменение энтальпии в стандартном состоянии системы отмечают верхним индексом «о»: ∆Н 0 (T). Температуру, при которой определена стандартная энтальпия реакции, указывают особо, но чаще всего берут 298 К. В этом случае стандартная энтальпия реакции обозначается символом ∆Н 0 298. Например, термохимическое уравнение
показывает, что при поддержании давления каждого участника реакции в 1 атм, а общего их давления в 4 атм и температуры 298 К будет выделяться 41 кДж теплоты.
· Уравнения химических реакций, записанные с указанием значения ∆Н и агрегатного состояния участников реакции, называют термохимическими.
В растворах в качестве стандартного состояния для растворителя всегда выбирают состояние чистой жидкости. Для растворенных веществ за стандартное состояние принимают гипотетическое состояние раствора, который обладает свойствами предельно разбавленного раствора с концентрацией вещества В, равной 1 моль/л.
Первый закон термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В этом случае справедливой будет формула внутренней энергии газа:
Первый закон термодинамики для изобарного процесса дает:
Первый закон термодинамики для изотермического процесса выражается соотношением
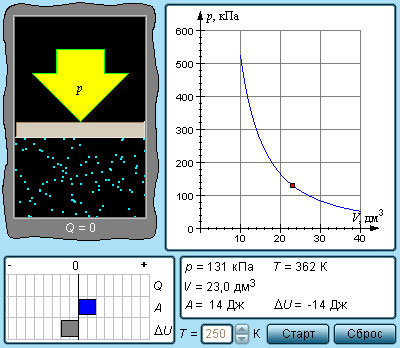
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
Адиабатический процесс относится к изопроцессам.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Термодинамика для «чайников»: первое начало, или почему невозможно построить вечный двигатель
В продолжение нашего курса «Физика для чайников» начнем рассматривать основы такого важнейшего раздела как термодинамика.
Активное развитие термодинамики началось в девятнадцатом веке. Именно тогда люди начали строить первые паровые машины, а потом активно внедрять их в производство. Началась промышленная революция, и, естественно, всем хотелось увеличить коэффициент полезного действия машин, чтобы произвести больше продукции, доехать подальше и в конце-концов получить больше денег. Все это очень хорошо стимулировало развитие науки и наоборот. Но давайте ближе к сути вопроса.
Парогенераторная прожекторная установка
Термодинамика – раздел физики, изучающий макроскопические системы, их наиболее общие свойства, способы передачи и превращения энергии в таких системах.
Что такое макроскопические системы? Это системы, состоящие из очень большого числа частиц. Например, баллон с газом или воздушный шар. Описание таких систем методами классической механики просто невозможно – ведь мы не можем измерить скорость, энергию и другие параметры каждой молекулы газа в отдельности. Тем не менее, поведение всей совокупности частиц подчиняется статистическим закономерностям. По сути любой видимый нами (невооруженным глазом) предмет может быть определен как термодинамическая система.
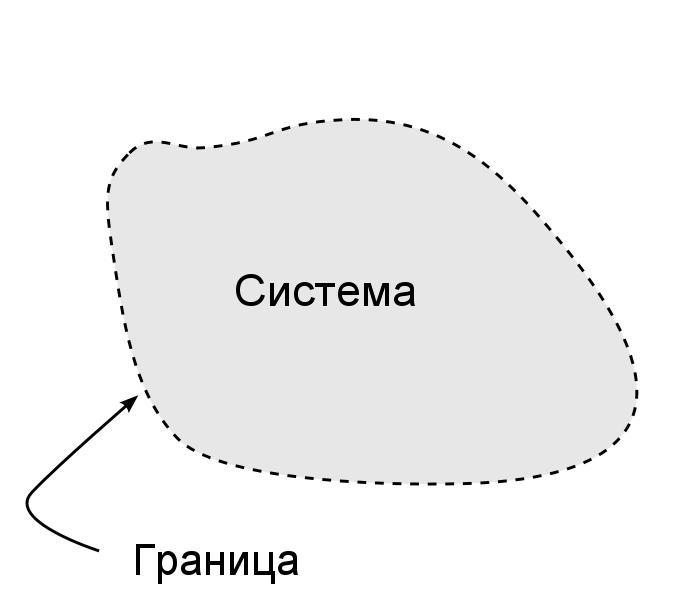
Термодинамическая система – реально или мысленно выделяемая макроскопическая физическая система, состоящая из большого числа частиц, не требующая для своего описания привлечения микроскопических характеристик отдельных частиц. Соответственно, для описания термодинамической системы используются макроскопические параметры, не относящиеся к каждой частице, но описывающие систему целиком. Это температура, давление, объем, масса системы и проч.
Важно отметить, что термодинамические системы могут быть замкнутыми и незамкнутыми. Замкнутая система – это такая система, которую при помощи реальной или воображаемой оболочки оградили от окружающей среды, при этом количество частиц в системе остается постоянным.
Система может находится в разных состояниях. Например, мы взяли баллон с газом и начали его нагревать. Тем самым мы изменили энергию молекул газа, они стали двигаться быстрее, и система перешла в какое-то новое состояние с более высокой температурой. Но что будет, если систему оставить в покое? Тогда система через какое-то время придет в состояние термодинамического равновесия.
Термодинамическое равновесие – это состояние системы, в котором ее макроскопические параметры (температура, объем и др.) остаются неизменными с течением времени.
Термодинамика стоит на трех своих столпах. Существуют три основных постулата или три закона термодинамики. Они называются соответственно первым, вторым и третьим началами термодинамики. Рассмотрим первое начало или первый закон термодинамики.
Первое начало термодинамики
Первое начало термодинамики гласит:
В любой изолированной системе запас энергии остается постоянным.
К слову, у данного постулата есть еще несколько эквивалентных формулировок. Приведем их ниже:
Количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил.
Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Запишем также математическое выражение первого начала термодинамики:
Почему невозможен вечный двигатель первого рода?
Людей издревле привлекала ее величество Халява. Философский камень, превращающий любой металл в золото, скатерть самобранка, с которой не нужно готовить, джин, исполняющий любые желания. Еще одной такой идеей была идея вечного двигателя.
Если никто не пытался найти скатерть-самобранку, то вечный двигатель пытались изобрести очень много раз. На протяжении веков разные люди спрашивали себя: как построить вечный двигатель? Согласно историческим записям первым такую попытку предпринял в двенадцатом веке некий индийский ученый. Затем было еще множество попыток, в том числе плотно занимался вопросом и Леонардо да Винчи. Наконец, в девятнадцатом веке светлые головы Германа Гельмгольца и Джеймса Джоуля сформулировали первое начало динамики и подтвердили его опытами, чем развеяли все сомнения. В помощь также статья, о том, как делать презентацию в ворде и powerpoint.
Вечный двигатель Леонардо да Винчи
Вечный двигатель невозможен, потому что так устроен мир. Об этом говорят нам законы термодинамики. Согласно первому началу термодинамики, количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил. Например, газ, помещенный в цилиндр с поршнем, получая определенное количество теплоты, увеличивает свою внутреннюю энергию, молекулы движутся быстрее, газ занимает больший объем и толкает поршень (работа против внешних сил). Иными словами, если работа совершается без внешнего притока энергии, она может совершаться лишь за счет внутренней энергии системы, которая рано иди поздно иссякнет, преобразовавшись в совершенную работу, на чем все закончится и система придет к состоянию термодинамического равновесия. Ведь энергия в мире никуда не уходит и не приходит, ее количество остается постоянным, а меняется лишь форма. Конечно, Вы обратили внимание на то, что речь идет о так называемом вечном двигателе первого рода (который может совершать работу без энергии). Спешим заверить, существование вечного двигателя второго рода также невозможно и объясняется вторым началом термодинамики, о котором мы поговорим в ближайшем будущем.
Энергия и ее формы
Надеемся, знакомство с термодинамикой прошло для Вас приятно и Вы полюбите ее всем сердцем. Если же этого не произойдет, Вы всегда можете поручить выполнение задач по термодинамике нашим авторам, пока сами занимаетесь более приятными делами.
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Внутренняя энергия одноатомного и двухатомного идеального газа
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.