Что такое гем биохимия
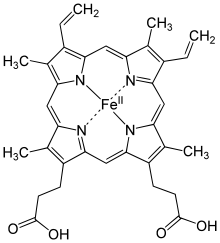
Гем (биохимия)
Известен ряд различных гемов, отличающихся заместителями порфиринового ядра:
| Гем A | Гем B | Гем C | Гем O | ||
|---|---|---|---|---|---|
| № PubChem | 7888115 | 444098 | 444125 | 6323367 | |
| Брутто-формула | C49H56O6N4Fe | C34H32O4N4Fe | C34H36O4N4S2Fe | C49H58O5N4Fe | |
| Заместитель при C3 |  | —CH(OH)CH2Far | —CH=CH2 | —CH(цистеин-S-ил)CH3 | —CH(OH)CH2Far |
| Заместитель при C8 | —CH=CH2 | —CH=CH2 | —CH(цистеин-S-ил)CH3 | —CH=CH2 | |
| Заместитель при C18 | —CH=O | —CH3 | —CH3 | —CH3 | |
Наиболее распространенным гемом является Гем B — железный комплекс протопорфирина IX, входящий в состав гемоглобинов, миоглобинов и цитохромов.
Позвоночные синтезируют гем из более простых азотистых соединений (глицина и сукцината) и из резервного железобелкового комплекса — ферритина, находящегося в селезёнке, печени, костном мозге. Гем, выделенный из крови различных позвоночных животных, имеет одинаковую химическую структуру.
Свободный гем легко окисляется на воздухе до гематина, в котором атом железа трёхвалентен. Многолетние исследования структуры гема завершились синтезом гемина — солянокислого гематина (Г. Фишер, 1929).
См. также
Ссылки
Примечания
невитамины: Кофактор F430 · ATP · CTP · S-Аденозилметионин · PAPS · Глутатион · Кофермент B · Кофермент М · Убихинон (Кофермент Q) · Метанофуран · BH4 · H4MPT
простетические группы
| Корриноиды | Метилкобаламин · Аденозилкобаламин · Цианокобаламин · Гидроксокобаламин | ||||||||||
| Порфирины |
| ||||||||||
| Редуцированные порфирины |
|
Полезное
Смотреть что такое «Гем (биохимия)» в других словарях:
Гем — Гем: Гем (биохимия) производное порфирина, содержащего в центре молекулы атом двухвалентного железа. Гем (мифология) персонаж, влюблённый в свою сестру. … Википедия
ПЕРОКСИДАЗЫ — (донор: пероксид водорода оксидоредук тазы), ферменты класса оксидоредуктаз, катализирующие окисление с помощью H2O2 разл. неорг. и орг. в в по схеме: E, E1 и E2 соотв. исходная П. и ее окисленные формы; ДН 2, ДН Х и Д соотв. исходный,… … Химическая энциклопедия
Гемоглобин — Молекула гемоглобина: 4 субъединицы глобина окрашены в разные цвета … Википедия
Биологические пигменты — У этого термина существуют и другие значения, см. Пигмент. Хлоропласты в клетках … Википедия
Ферменты — (от лат. fermentum – закваска) энзимы, специфические белковые катализаторы, присутствующие во всех живых клетках. Почти все биохимические реакции, протекающие в любом организме и в своём закономерном сочетании составляющие его Обмен… … Большая советская энциклопедия
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
Фолиевая кислота — См. также: Фолиевая кислота (лекарственное средство) Фолиевая кислота … Википедия
Очоа, Северо — В Википедии есть статьи о других людях с такой фамилией, см. Очоа. Северо Очоа исп. Severo Ochoa de Albornoz Дата рождения: 25 сентября 1905(1905 09 25) … Википедия
S-Аденозилметионин — Для этой статьи не заполнен шаблон карточка <<Вещество>>. Вы можете помочь проекту, добавив его … Википедия
S-Adenosyl methionine — S Аденозил метионин, C15H23N6O5S+ S аденозилметионин (SAM, SAMe, SAM e) это кофермент, принимающий участие в реакциях переноса метильных групп. Впервые был описан в Италии ученым Кантони в 1952 году.[1] Молекулярная масса 399,447 г/моль. S… … Википедия
Гемоглобин
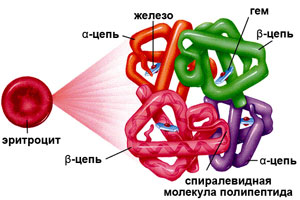
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
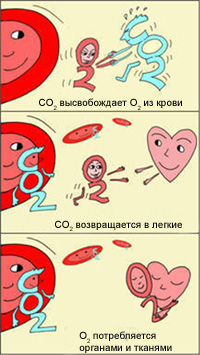
Эффект был описан датским физиологом Христианом Бором http://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Гем необходим для многих ферментов
Гем является небелковой частью многих гемопротеинов:
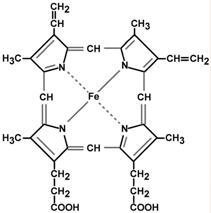
Строение и синтез гема
Строение гема
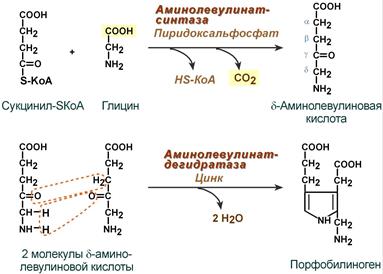
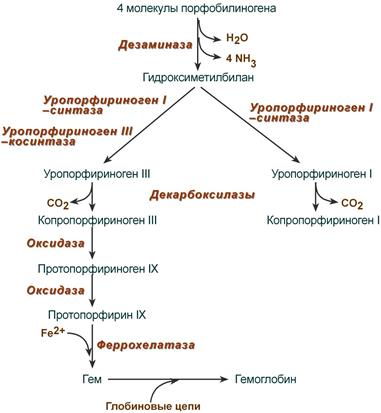
Синтез порфобилиногена
Судьба обоих типов уропорфириногена двояка: они могут окисляться до уропорфирина (на рисунке не показано) или декарбоксилироваться до копропорфириногена соответствующего типа.
Синтез гема из порфобилиногена
Копропорфириноген III возвращается в митохондрии и окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез «своих» белков.
Регуляция синтеза гема
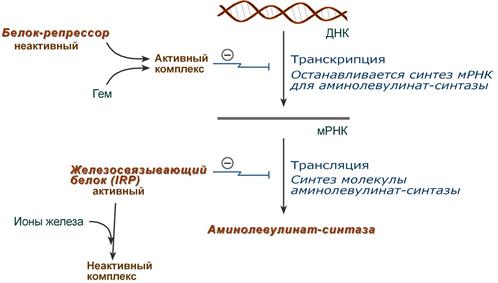
1. Гем :
Регуляция синтеза аминолевулинатсинтазы
2. Ионы железа. Их достаточное количество оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы.
В клетке имеется железосвязывающий белок (англ. IRP, iron-responsive element-binding proteins – белок, связывающий железочувствительный элемент), который при отсутствии ионов железа обладает сродством к железочувствительному участку IRE (англ. iron-responsive element ) на матричной РНК фермента. Это связывание блокирует трансляцию мРНК в рибосоме, т.е. подавляет синтез белковой цепи.
При наличии ионов железа они связываются с железосвязывающим белком, образуя с ним неактивный комплекс, и это инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышению активности аминолевулинатсинтазы способствуют различные соединения, усиливающие работу микросомальной системы окисления (жирорастворимые вещества, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, и снижается внутриклеточная концентрация свободного гема. В результате происходит усиление синтеза фермента.
Что такое гем биохимия
Крупнейшее событие в ходе эволюции нашей планеты – открытие процесса фотосинтеза – повлекло за собой неизбежное изменение состава земной атмосферы в плане увеличения доли молекулярного кислорода. Появление такого эффективного биологического окислителя, как О2, дало гетеротрофным организмам возможность более эффективного извлечения энергии органических связей путем дыхания. Последовавшее затем возникновение крупных многоклеточных привело к проблеме транспорта кислорода в ткани биологических систем. Но, поскольку кислород очень плохо растворим в воде (всего 4,9 мл газа в 100 мл Н2О), очевидным решением этой проблемы стало появление гуморальных посредников, доставляющих дыхательные газы по адресу. Таким образом, в ходе эволюционного прогресса у большинства многоклеточных сформировалась система белковых дыхательных пигментов, главным из которых является гемоглобин (Hb) [1–3].
Гемоглобин (Hb) (от греч. haemo – кровь и лат. globus – шар), красный железосодержащий хромопротеин, обнаруженный у всех эукариотических организмов, от одноклеточных (дрожжи и др.) до беспозвоночных и высших позвоночных животных. Он способен обратимо связывать молекулярный кислород в количестве 20 мг О2, на 100 мл крови [4]. В биологических системах Hb выполняет две важнейшие функции: а) транспорт дыхательных газов; б) поддержание кислотно-основного равновесия (стоит заметить, что гемоглобиновый буфер является самым мощным в организме (примерно 3/4 от общей буферной емкости крови) [5].
Гемоглобин называют модельным белком, свойства, функции и структура которого наиболее полно изучены по сравнению с другими протеинами человека. Отмечая ключевую роль этого хромопротеина в системе дыхания, непревзойденный гемоглобинолог Макс Перутц назвал Hb «молекулярным легким» [6].
Гемоглобин – внутриклеточный компонент. На его долю приходится 90 % всего белка красных кровяных телец. Примечательно, что в собственном метаболизме эритроцита кислород не используется [7]. Молекулярная масса большинства изотипов этого пигмента колеблется в пределах 64,5–68 кД. Размер – 6,8 нм. pI – 6,8. Первичная структура характеризуется высоким содержанием гистидина [4, 8].
Все типы гемоглобина являются тетрамерами, построенными из пары α-субъединиц, и специфической для каждого типа иной пары. Каждый из четырех протомеров построен из двух неравных частей: небелковая структура – гем (4 % массы молекулы Hb, обеспечивает окраску и ковалентную связь с кислородом) и белковая глобула – глобин (96 % массы, чаще представлен либо 141 (α-цепь), либо 146 (β-, γ-, δ-цепи) аминокислотными остатками) [4, 8].
Комплекс, составленный из одной глобиновой субъединицы и одного гема, называется Сведберговой единицей. Таким образом, молекула Hb построена из четырех Сведберговых единиц, слабо связанных между собой нековалентными связями (гидрофобными, электростатическими, водородными) [8].
Синтез гема происходит в митохондриях. Глобин, как и любой белок, синтезируется на рибосомах. Их объединение в мультимер осуществляется в фазу созревания полихроматофильного нормобласта [9].
Лигандом молекулы гемоглобина, присоединяющим кислород, является ион Fe2+. Это взаимодействие обратимо и зависит от парциального давления O2. В артериальной крови практически весь Hb (95–98 %) связан с кислородом. В венозной крови содержание оксигемоглобина составляет 67–75 %, остальная часть приходится на долю свободного (редуцированного) Hb [1, 4, 5].
Норма общего Hb в крови у мужчин составляет 135–170 г/л, у женщин – 120–150 г/л [10].
В крови у новорожденного содержится 140–190 г/л этого белка, но к концу первого месяца его уровень снижается до нормального для взрослого. Динамика средней концентрации Hb крови в период от рождения до 12 лет представлена в таблице [9].
Средние уровни Hb в крови в раннем постнатальном периоде
В плане градации Hb выделяют:
? нормальные формы: восстановленный (редуцированный) Hb, оксигенированный Hb, карбгемоглобин и метгемоглобин.
? производные: карбоксигемоглобин, сульфгемоглобин, метгемоглобин, циангемоглобин и др.
? типы (изотипы) – принципиально различные подвиды Hb, кодирующиеся отдельными генами, различающиеся строением протомеров глобина. Очевидно, гемоглобины разных типов отличаются первичной, вторичной, третичной и четвертичной структурами [10].
К основным типам гемоглобина человека относятся следующие:
? HbА1 – является преобладающим в крови взрослого (98 % от общего Hb). Тетрамер, его молекула построена из двух α- и двух β-субъединиц (141 и 146 аминокислотных остатков соответственно). Его синтез начинается уже на 6–8 неделях гестации и продолжается до конца жизни [8, 11].
? HbА2 (минорный, 2 α- и 2δ-протомера). Его концентрация в крови взрослого 1,5–3,5 % от общего Hb. Уровень этого изотипа возрастает при гипохромных и мегалобластных анемиях, серповидноклеточной анемии, β-талассемии. Снижение его концентрации в крови отмечается при δ-талассемии, гемоглобинопатии Н, эритролейкозе [8, 9, 11].
? Примитивный (эмбриональный) Hb (HbР). Обладает более высокой (чем HbA1) тропностью к О2. Является самым ранним гемоглобином эмбриона. Синтезируется в раннем эмбриогенезе (с 4 по 12 нед) в желточном мешке [8, 11].
? Плодовый (фетальный) гемоглобин (HbF, тетрамер, 2 α- и 2 γ-цепи). Его продукция начинается с 12-й недели внутриутробного развития, и к 6 месяцам полностью замещает HbP в крови. К моменту рождения концентрация HbF составляет 55–85 % от общего. В крови взрослого человека его доля составляет 1,5 % от общего Hb [8, 11].
a-, b-, g- и d-гены гемоглобина расположены на коротких плечах 11-й и 16-й хромосом [11, 12].
Известно около 200 патологических типов Hb, причиной возникновения которых являются мутации. Данные протеины регистрируются в крови человека при состояниях, называемых гемоглобинопатиями (M Hyde Parc, Bristol, Sydney и др.) [13–15].
По причине стремительного прогресса биохимических методик индикации, в последние годы роль отдельных типов гемоглобина, как диагностических и прогностических маркеров, приобретает все большее прикладное значение.
Особо следует сказать о методологии количественного определения гемоглобинов. В большинстве стран в качестве общепринятых применяются колориметрические методы, рекомендованные комитетом по стандартизации Европейского и Международного общества по гематологии (1964), среди которых доминирующим является унифицированный гемоглобинцианидный метод. Оптические способы обнаружения гемоглобинов практичны, доступны и просты, но имеют существенный недостаток: они имеют низкую селективность, не позволяющую регистрировать отдельные типы гемоглобина [9, 10].
Существуют также методики лабораторного количественного анализа гемоглобинов путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Но они является полуселективными, так как определяют только фракции гемоглобинов со сходной электрофоретической подвижностью, а не индивидуальные типы этого белка [10].
В последние десятилетия в медицинской практике наблюдается тенденция перехода от регистрации фракций веществ (общий белок, общий гемоглобин и др.) к определению отдельных форм вещества. Такой подход повышает качество диагностики и прогностической оценки. Очевидно, медицина XXI века нуждается в принципиально новых технологиях тестирования гемоглобинового профиля по каждому из основных его изотипов [16].
Наиболее адекватно отвечают вышеуказанным требованиям уже давно известные иммунохимические методы определения белков (ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини и др.). Они до сих пор остаются максимально специфичными, точными, чувствительными и надежными [10, 16].
Попытки моделирования иммунохимических методов количественного анализа некоторых фракций гемоглобинового профиля предпринимались еще с начала прошлого столетия. В данных работах исследователи исходили из убеждения, что разработка и внедрение в клиническую диагностику иммунохимических диагностических тест-систем на значимые типы гемоглобина целесообразно и актуально, так как значительно оптимизирует и облегчит лабораторную оценку статуса красной крови. В дальнейшем научный интерес в этом направлении был снижен вследствие внедрения в международную клиническую практику оптических циангемоглобиновых методов индикации. Но в последние десятилетия, в связи с усовершенствованием иммунохимических методик и ростом научного интереса к отдельным компонентам гемоглобинового спектра с одной стороны, ростом потребности в специфических диагностических тестах на конкретные типы этого протеина, с другой стороны, отмечается активизация работы немногочисленных научных групп по разработке и внедрению в медицинскую практику новых, современных иммунохимических тест-систем на различные генотипы гемоглобина человека [17–19].
Определение количества Hb в крови имеет большое клиническое значение. Снижение его концентрации отмечается при анемиях различной этиологии. Повышение Hb крови может быть как физиологическим, так и патологическим. Умеренные повышения встречаются при гемолитических анемиях, анемии Кули, гемоглобинозе С и др. Значительные увеличения встречаются при всех гемоглобинуриях [4, 8, 20].
Существует множество нозологических форм, при которых имеет важное значение не только изменение количества общего гемоглобина крови, но и отдельных его типов, изменение соотношения которых в клинической практике используют для диагностики различных патологических состояний [8, 21–23].
Например, при снижении скорости синтеза α-цепей возникает α-талассемия. При возникновении мутаций в β-гене нарушается синтез β-полипептидной цепи, возникает β-талассемия, что приводит к образованию повышенных количеств HbF. Талассемии сопровождаются анемиями, которые могут принимать очень тяжелые формы. Увеличение количества HbF наблюдается также при гомозиготной форме β-талассемии, наследственном персистировании фетального гемоглобина, σ-, β-талассемии, серповидно-клеточной анемии [1, 24].
Увеличение пропорции HbF при рождении наблюдается у недоношенных, у новорожденных, подвергавшихся хронической внутриматочной гипоксии, а также у новорожденных, родившихся у женщих с поздними гестозами (в частности – с нефропатией), гипертонической болезнью, эндокринными нарушениями, интоксикациями, сердечно-сосудистой патологией, гематологическими заболеваниями. Уменьшенные уровни HbF обнаружены у новорожденных с синдромом Дауна [25–27]. Повышение уровня плодового гемоглобина отмечается при преждевременной отслойке плаценты, угрозе прерывания беременности [18, 21]. Значительное снижение уровня этого белка регистрируется у больных с различными типами эритробластозов [2, 16]. Показано снижение концентрации HbF в крови пациентов с лимфогранулематозом, сфероцитарной гемолитической анемией, тромбоцитопенической пурпурой [20, 28].
Литературные данные последних лет, основанные именно на иммунохимических методах определения плодового и примитивного гемоглобинов, свидетельствуют, что значение селективной индикации этих протеинов как диагностических маркеров представляет значительно больший прикладной интерес, чем считалось ранее. Показан рост продукции HbF при хронических гипоксиях различного генеза [26, 29]. Сходный компенсаторно-адаптивный рост концентрации этого белка отмечается у людей, проживающих в условиях высокогорья [25]. Значительное повышение продукции плодового гемоглобина отмечено при тяжелых формах героиновой наркомании [30].
Следует отметить, что до применения иммунохимических методов индикации сведения о прикладном значении примитивного гемоглобина как клинико-диагностического маркера были крайне скудны. На наш взгляд, это объяснялось тем, что (как считалось прежде) продукция HbP полностью ингибирована как у детей, так и у взрослых, что не вызывало интереса к данному белку как диагностическому маркеру [4, 9]. Однако, как показали исследования последних лет, основанные на внедрении иммунохимических методик, статистически значимое повышение концентраций примитивного и плодового гемоглобинов в крови регистрируется при некоторых онкологических заболеваниях красной крови (эритремия, сублейкемический миелоз, острый и хронический лимфолейкоз), что свидетельствует о высоком диагностическом значении этих протеинов как канцероэмбриональных антигенов [17, 31]. Достоверный рост уровня HbF и появление в крови HbP наблюдается при тяжелых гипоксических состояниях новорожденных, сопровождающихся задержкой внутриутробного развития или гемолитической болезнью [29, 32].