Что такое гибридомы и моноклональные антитела
Моноклональные антитела: исследования и применение
Когда в организм попадает чужеродный белок или бактерия, запускается система защиты – иммунный ответ. Это В-лимфоциты, которые начинают синтезировать белки, узнающие какой-либо участок чужеродного белка. А моноклональные антитела – это антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону. Они узнают один конкретный участок патогена, известный нам, и воздействуют на него. То есть это не смесь антител, которые вырабатывает организм множеством В-клеток в ответ на патоген, а только один конкретный вид, способный узнавать один конкретный эпитоп, например участок домена определенного клеточного рецептора.
Открытие моноклональных антител
Моноклональные антитела были открыты в 1975 году Жоржем Кёлером и Сезаром Мильштейном. Они опубликовали статью, посвященную разработке гибридомного метода. Ученые смогли слить B-лимфоциты, синтезирующие антитела, с клетками миеломы (раковыми клетками) с использованием полиэтиленгликоля или вируса Сендай. Таким образом ученые получили гибридому, обладающую свойствами как раковой клетки (способность делиться большое количество раз), так и B-лимфоцитов (синтез антител). А дальше определенными многостадийными этапами селекции они отделили клетки, синтезирующие необходимое антитело.
Основой для создания терапевтических моноклональных антител являются иммуноглобулины подкласса G1 человека, поскольку этот вид антител обладает рядом преимуществ, одно из которых – наибольший период полувыведения из крови. После введения в организм иммуноглобулины подкласса G1 живут вплоть до трех недель. Это очень важно, ведь для терапии самое главное – чтобы лекарство находилось в организме пациента как можно дольше.
Соответственно, все антитела гуманизируют, чтобы организм человека их не отторгал. Несмотря на существование общих систем лечения, бывают ситуации, когда ученым необходимо искать новый подход к лечению патологии. Все индивидуально. Например, для конкретного человека полученное антитело может являться аллергическим агентом или в организме возникает устойчивость к нему. При таких проблемах на помощь могут прийти системы получения антител в растениях, поскольку за неделю-две можно получить желаемые антитела, что гораздо больше времени займет на системах с животной клеткой. Мы знаем последовательность, кодирующую определенное антитело, затем создаем конструкцию и инфильтрируем ее в растение с помощью агробактерии.
Табак и антитела
Свои исследования мы проводим на растении Nicotiana benthamiana (австралийский табак). Поскольку большое количество растительных патогенов способно заразить его, оно широко используется в вирусологии, благодаря чему хорошо изучены и разработаны различные векторные системы продукции целевых белков на основе вирусов растений.
В наших исследованиях мы используем векторы на основе вирусов растений. Один из них – это вирус табачной мозаики (ВТМ), широко известный и полностью изученный, а другой – это Х-вирус картофеля (ХВК). Мы используем их, чтобы доставлять гены, кодирующие антитела, в растительную клетку. После чего растительная клетка синтезирует с этих векторов белки, которые собираются в растении в полноразмерные антитела. Затем мы выделяем их на специальных колонках, которые используют во всех методах очистки антител.
Важно понимать, что стадия очистки антител, полученных в растениях, не отличается от тех, которые используют на животных клетках. В принципе, получение моноклональных антител в животных клетках и растениях сопоставимо по времени – разница в биобезопасности. Препараты, которые получают в животных клетках, могут заразить человека вирусами животных или прионами.
Человек не может заразиться от растений. Во-первых, для нас их вирусы не опасны. Во-вторых, растениям не нужны питательные среды, которые имеют риск внесения контаминации разными агентами, опасными для человека. Это главные тезисы, которыми мы оперируем, защищая нашу теорию о том, что растения прекрасно подходят для синтеза антител. Но даже если принимать во внимание, что использование моноклональных антител не дойдет до терапии, все же они широко применяются в различных видах диагностики. Помимо медицины, антитела используются также в молекулярной биологии как способ детекции целевого белка и в химии как способ очистки или выделения также белка или полисахарида.
Применение моноклональных антител в борьбе с раком
До недавнего времени мы работали только с аналогом трастузумаба – антитела, предназначенного для лечения HER2-позитивного рака молочной железы. Оно узнает четвертый домен этого рецептора и взаимодействует только с ним, останавливая пролиферацию клеток.
Однако хорошо известны случаи приобретения устойчивости к трастузумабу (коммерческое название – герцептин) у пациентов. Он продается в аптеках и используется в терапии рака молочной железы во всем мире. Решая эту проблему, ученые разработали еще одно антитело к этому рецептору, но взаимодействующее со вторым доменом – доменом димеризации. Его назвали пертузумаб (коммерческое название – перьета). И мы поставили перед собой задачу синтезировать это антитело. Суть терапии заключалась в том, что перьету добавляли к герцептину и их использование помогало избежать устойчивости рака только к герцептину. Только так они замедляли рост ракового образования и пролиферации клеток.
Мы озадачились темой получения пертузумаба в растениях. Для начала мы зашли в общедоступный сервис, который называется Drug Bank. В нем размещена база данных всех известных препаратов, последовательности аминокислот тех белков, которые используются в различных медицинских направлениях. В том числе в Drug Bank мы нашли последовательности пертузумаба (перьеты). Осталось лишь адаптировать ее под синтез в растении, используя интернет-ресурс для оптимизации кодонного состава. Конечно, нуклеотидная последовательность будет разной для растительной клетки и для животной, но в результате мы получаем одну и ту же аминокислотную последовательность. После того как мы получили оптимизированную нуклеотидную последовательность, мы синтезировали нуклеотидный код и вставили в вектора, которые в дальнейшем использовали для синтеза антител в растении.
Перспективы исследования моноклональных антител
Иногда возникают такие ситуации, как, например, с вирусом Эбола: патоген стремительно распространяется, заражая людей и подводя их к смерти. Что касается тестирования препаратов на людях, то известно, что во время вспышки геморрагической лихорадки Эбола в Западной Африке была острая необходимость победить болезнь как можно раньше. И в этом случае сработали антитела, которые частично получали в растениях. Это ZMapp. Его смогли использовать в качестве лекарственного средства и ввели семи больным, хотя его безопасность ранее не была проверена в тестировании на людях. У пяти пациентов состояние значительно улучшилось, и болезнь отступила. Сейчас, после удачной экстренной помощи больным, были начаты систематические исследования биобезопасности и эффективности лечения (фазы I/II) препаратом ZMapp. Хотелось бы, чтобы возможность использовать антитела, полученные в растениях, возникала не при подобных обстоятельствах. Поэтому мы будем продолжать работать над тем, чтобы полностью избавиться от сомнений в использовании антител, синтезированных в растительной клетке.
Автор – кандидат биологических наук, научный сотрудник лаборатории генетического контроля устойчивости к стрессам Института общей генетики им. Н. И. Вавилова РАН.
Моноклональные антитела
Моноклональные антитела, которые можно выработать против практически любого природного антигена, широко используются как в молекулярной биологии и биохимии, так и в медицине.
Авторы
Редакторы
Эта статья посвящена замечательному достижению современной иммунологии — методу гибридóм. Соматический гибрид нормальной антителообразующей и опухолевой клеток (гибридóма) дает потомство, обладающее бессмертием опухолевой клетки и способностью к синтезу антител, унаследованному от клетки нормальной. Гибридомы продуцируют огромное количество моноклональных антител, обладающих уникальной специфичностью.
Целое поколение лекарств, направленных на терапию и лечение тяжелых заболеваний (таких как рак), основано на моноклональных антителах. Так человек пока неловко, но все более и более уверенно пытается использовать в свое благо замечательное изобретение природы — приобретенный иммунитет. «Биомолекула» публикует статью известного российского ученого Гарри Израилевича Абелева, посвященную истокам технологии моноклональных антител, — методу гибридóм (первый вариант этой статьи был опубликован в Соросовском образовательном журнале [1]). Статья дополнена выпускницей биофака МГУ Олиферовой Жанной, которая рассказывает о современных способах получения моноклональных антител, шагнувших дальше гибридомной методики. — Ред.
При введении в организм животных и человека чужеродных макромолекулярных веществ — белков или полисахаридов (антигенов) в крови появляются защитные белки — антитела, для которых характерна необыкновенная, уникальная специфичность. Каждое антитело узнает только свой антиген, точнее, одну его детерминантную группу. Детерминантная группа состоит из нескольких остатков аминокислот или сахаров (обычно из 6–8), образующих пространственную структуру, характерную для данного белка. В одном белке, состоящем из нескольких сот аминокислот, имеется несколько (5–15) разных детерминант, поэтому к одному белку образуется целое семейство различных по своей специфичности антител. Даже к одной детерминанте образуется целый спектр антител, отличающихся по структуре, степени специфичности и прочности связывания с ней. То же относится и к полисахаридным антигенам, детерминантные группы которых образуются 3–6 остатками моносахаридов.
Таким образом, при введении антигена возникает большое семейство антител, направленных к разным его детерминантам и различающихся также внутри группы антител, направленных к одной и той же детерминанте. В крови иммунизированных животных появляется богатый и уникальный по составу спектр антител, который и обеспечивает их абсолютную специфичность в распознавании данного антигена.
Антитела давно и широко используются для нейтрализации бактериальных токсинов (дифтерийного, столбнячного), змеиных ядов (кобры, гадюки), вирусов, попавших в кровь (особенно эффективно для вируса кори), и для идентификации индивидуальных белков (и других антигенов), находящихся в клетке или сложнейших тканевых экстрактах. Однако иногда требуются не многокомпонентные смеси антител, возникающие в крови в ответ на введение антигена, а отдельные, элементарные составляющие этой смеси, направленные лишь к одной детерминанте антигена и имеющие одни и те же характеристики. Такие антитела бывают нужны как для изучения их собственной природы, так и для практического использования, например для доставки в опухоли токсических веществ.
Как получить такие антитела?
Очевидно, что путем иммунизации, то есть введением животному индивидуального антигена или только одной его детерминантной группы, это сделать, как правило, невозможно. Почему? Дело в том, что в организме в процессе созревания антителообразующих клеток (АОК) образуется большое количество (миллионы) генетически однородных семейств клеток — клонов, каждый из которых специализируется на синтезе только одного варианта антител, и в этом причина большого разнообразия антител, индуцируемых даже одним антигеном. Таких клонов много больше, чем требуется антител для распознавания любого, случайно взятого антигена. Антиген, попадая в организм, стимулирует размножение тех клонов, которые продуцируют антитела к его детерминантам.
Казалось бы, выход прост: надо вырастить отдельные клоны антителообразующих клеток in vitro — в культуре тканей — и они будут продуцировать моноклональные антитела, то есть антитела одной строго определенной специфичности, продукт одного клона. Но и это оказалось невозможным: нормальные клетки смертны, вскоре после высаживания в культуру они погибают. Дело не доходит до образования клонов АОК. Добавление в культуру факторов роста несколько продлевает их жизнь, но тоже не решает проблемы.
Дорогу указывают опухоли
Путь решения проблемы неожиданно указали злокачественные опухоли. Уже давно известны опухоли у человека — плазмоцитомы, вырабатывающие и секретирующие в кровь иммуноглобулины, по структуре своей неотличимые от антител. Причем каждое такое «антитело» слегка отличалось от другого, вырабатываемого другой плазмоцитомой. Образовывалась как бы коллекция случайных антител к неизвестным антигенам. Когда накопились сотни таких «антител», и они были испытаны с сотнями наугад взятых антигенов, оказалось, что в этой коллекции обнаружились специфически реагирующие пары «антиген—антитело».
Почему именно опухоли указали на возможность получения моноклональных антител? Есть несколько причин, и все они коренятся в самой природе опухолевой клетки. Она всегда (или почти всегда) сохраняет свойства и функции клетки, из которой произошла. Плазмоцитома происходит из «юных» плазматических клеток, то есть как раз из тех клеток, которые синтезируют антитела. Это свойство сохраняется в опухолях, возникших из соответствующих клеток. Очень важной особенностью опухолей является их возникновение из одной генетически измененной (мутантной) клетки. Поэтому опухоль возникает и развивается как клон, в нашем случае как клон иммуноглобулинобразующих клеток. Причем они образуют строго однородный по всем свойствам моноклональный иммуноглобулин.
Нормальные плазматические клетки (или их предшественники — лимфоциты) смертны, их срок жизни — несколько дней. Опухоль, и в этом ее принципиальное отличие от нормальных предшественников, бессмертна (См. также: «Бессмертные клетки Генриетты Лакс»). Ее можно культивировать в пробирке или пересаживать от одного животного другому неограниченное число раз и в течение неограниченного времени. В отличие от нормальной ткани опухоль автономна; организм «хозяина» неспособен (за очень редкими исключениями) остановить неограниченный рост злокачественного опухолевого клона. Плазмоцитомы возникают не только спонтанно, то есть непредсказуемо: их можно довольно легко индуцировать у мышей и крыс и получить бессмертный, неограниченно растущий, перевиваемый клон клеток, продуцирующих иммуноглобулины, иногда обладающие специфичностью антител, причем антител моноклональных. Вполне естественно было желание иммунологов научиться получать плазмоцитомы, продуцирующие антитела заданной специфичности. Для этого мышей вначале интенсивно иммунизировали, а затем индуцировали у них плазмоцитомы, чтобы получить опухоли и из тех клонов, которые производили антитела к антигенам, использованным для иммунизации, но это практически не удавалось.
Слишком редки были совпадения. Тогда попробовали индуцировать опухоли антителообразующих клеток опухолеродными вирусами. Результаты были лучше, однако создать простой и универсальный метод получения моноклональных антител на этом пути также не оказалось возможным.
Как это было сделано?
Успех пришел, как всегда, неожиданно, как побочный продукт исследования, имевшего иные цели. В начале 70-х годов молодой немецкий иммунолог Жорж Кёлер, получивший стипендию для работы в знаменитом Базельском институте иммунологии, заинтересовался вопросом о генетической изменчивости антител. В то время можно было ожидать, что антитела мутируют (генетически изменяются) с бóльшей частотой, чем другие белки. Для исследования надо было изолировать клон АОК, продуцирующий антитела определенной специфичности, получить из него стабильную клеточную линию, поддерживаемую в пробирке (в культуре), и проследить, с какой частотой появятся там генетически измененные варианты. Для реализации проекта Кёлер поехал в Англию, в лабораторию Сезара Мильштейна, изучавшего клоны плазмоцитом, и они вместе разработали оригинальный подход к этой проблеме: решили получить гибрид нормальной АОК и опухолевой клетки. В случае успеха такой гибрид унаследовал бы от нормальной клетки способность к синтезу антител, а от опухолевой — бессмертие и способность к неограниченному и бесконтрольному росту. Это им удалось осуществить.
Гибридóмы
Методы гибридизации соматических (то есть не половых) клеток к тому времени были хорошо известны и широко применялись для разных целей. Для этого использовали вирус, способствующий слиянию клеток. Разнородные клетки, у которых слились оболочки, образовывали двуядерные гибриды, которые сохраняли способность к клеточным делениям. В процессе клеточного деления хромосомы обоих ядер перемешивались и образовывали общее ядро. Таким образом, возникал истинный гибрид, потомок двух соматических клеток, или гибридóма. Гибридому можно получить и между нормальной АОК и опухолевой, плазмоцитомной клеткой. Плазмоцитома была взята потому, что она больше всего соответствовала АОК по типу дифференцировки: весь ее синтетический аппарат был настроен на синтез иммуноглобулинов. Проблема заключалась в том, как отделить заданную гибридому от присутствующих в системе отдельных неслившихся клеток и от гибридов иного состава или иной специфичности, чем требуемые.
Для достижения этой цели авторы разработали специальную схему, использующую отбор клеток в селектирующей среде. Прежде всего был получен особый мутант мышиной плазмоцитомы, рост которого можно было контролировать составом питательной среды. Для получения мутанта использовали особенности синтеза нуклеиновых кислот (ДНК и РНК), имеющихся во всех клетках и необходимых для их существования. Известно, что имеются два пути синтеза предшественников нуклеиновых кислот: основной и резервный. Основной — это путь новообразования нуклеотидов (звеньев, входящих в состав нуклеиновых кислот). Этот путь включает несколько этапов и блокируется противоопухолевым препаратом аминоптерином (А). Однако клетки не гибнут от этого препарата, поскольку обладают резервным путем — способностью синтезировать нуклеотиды и нуклеиновые кислоты, реутилизируя продукты распада ранее синтезированных нуклеиновых кислот: гипоксантина (Г) и тимидина (Т). Добавление Г и Т в питательную среду, содержащую А, снимает токсический эффект последнего.
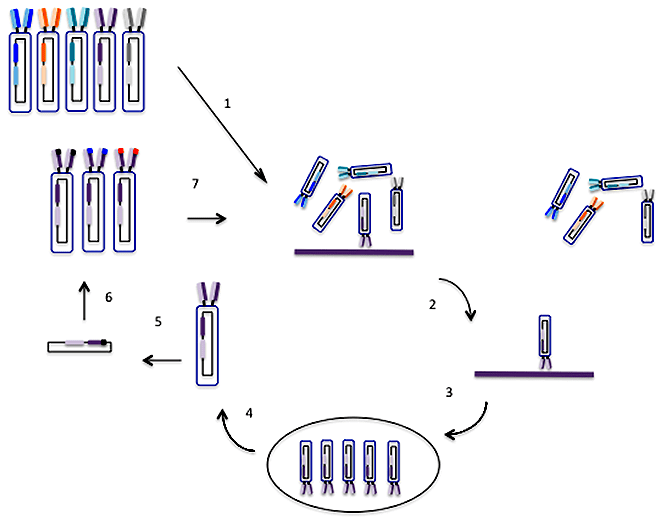
Для селекции гибридом надо было получить мутант плазмоцитомы, не способный пользоваться резервным путем и, следовательно, погибающий в среде, содержащей Г, A и T (ГАТ-среда). Такой мутант получили путем добавления в среду токсических аналогов Г и Т. Все клетки, способные усваивать Г и Т, включали их токсичные аналоги и погибали. Выживали лишь те редкие мутанты, которые были неспособны усваивать Г и Т, то есть были лишены резервного пути. Из потомства этих клеток дополнительно отбирали еще и такие мутанты, которые утратили способность к синтезу собственных иммуноглобулинов. Теперь все было готово для получения гибридом, то есть гибридов нормальных АОК и плазмоцитомных клеток (рис. 1).
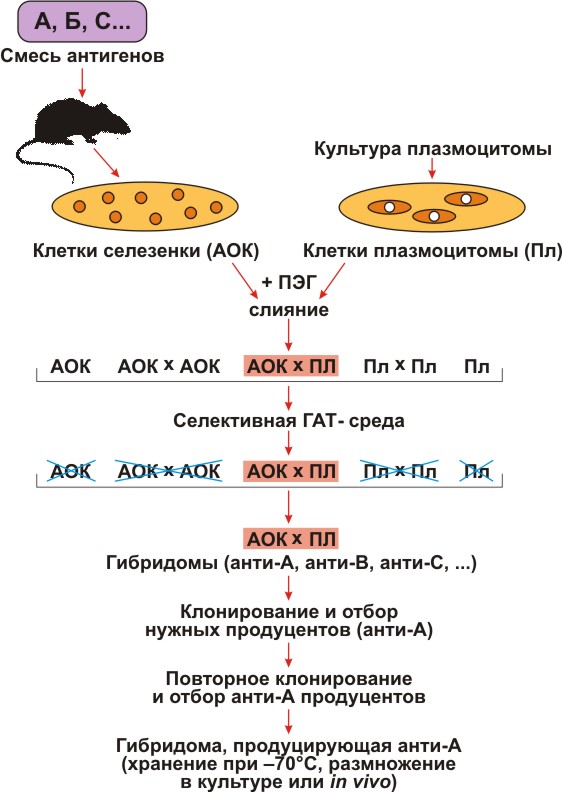
Рисунок 1. Схема получения гибридом. Условные обозначения: А, В, С — многокомпонентная смесь антигенов, использованная для иммунизации; АОК — антителообразующие клетки селезенки; Пл — клетки плазмоцитомы, не растущие в селективной ГАТ-среде; ПЭГ — полиэтиленгликоль; ГАТ — среда, содержащая гипоксантин, аминоптерин, тимидин; анти-А, анти-В, анти-С — моноклональные антитела соответственно к А-, В-, С-антигенам.
Мышей интенсивно иммунизировали определенным материалом — белком, бактериальной клеткой или клеткой животного происхождения. Когда в их крови появлялись антитела, у них брали селезенку и лимфатические узлы (места скопления АОК), и из них готовили взвесь клеток. К ней добавляли в избытке клетки мутантной плазмоцитомы и полиэтиленгликоль (ПЭГ). После короткой инкубации, требующейся для слияния клеток, их отмывали от ПЭГа и помещали в среду, содержащую Г, Т и А (ГАТ-среда). Теперь в системе находились гибриды АОК и АОК, АОК и плазмоцитомы, а также оставшиеся свободными АОК и клетки плазмоцитомы. Из них нужно было отобрать только гибриды АОК и плазмоцитомы. После недолгого (несколько дней) культивирования одиночные АОК, а также гибриды АОК и АОК погибали, так как нормальные клетки смертны и быстро погибают в культуре.
Плазмоцитомные клетки и их гибриды также погибали, так как А блокировал основной путь синтеза предшественников нуклеиновых кислот, а Г и Т их не спасали. Выживали, следовательно, только гибриды АОК и плазматических клеток, так как бессмертие они унаследовали от плазмоцитомы, а резервный путь — от нормальной клетки. Такие гибриды — гибридомы — сохраняли способность синтезировать и секретировать антитела.
Моноклональные антитела
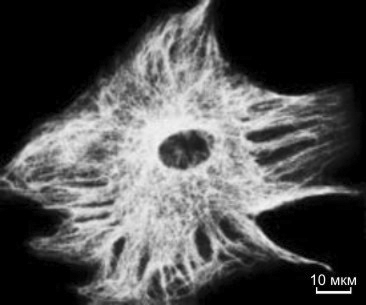
Рисунок 2. Иммунофлуоресцентное окрашивание клетки соединительной ткани (фибробласта) моноклональным антителом к тубулину — белку микротрубочек, образующих скелет клетки.
Применение
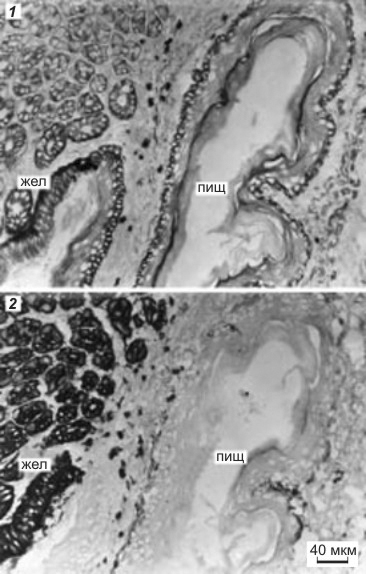
Рисунок 3. Последовательные срезы через желудок (жел) и пищевод (пищ) мыши, окрашенные двумя моноклональными антителами: 1 — первое моноклональное антитело реагирует с эпителием пищевода и слабее с эпителием желудка; 2 — второе моноклональное антитело реагирует только с эпителием желудка.
Обычные поликлональные антитела давно и широко применяются для определения биологически активных веществ — белков крови и других биологических жидкостей, гормонов, ростовых факторов, клеточных рецепторов, медиаторов воспаления и иммунитета, бактериальных и вирусных антигенов, различных ядов и т.п. Моноклональные антитела из-за высочайшей специфичности, стандартности и технологичности получения успешно вытесняют и заменяют иммунные сыворотки.
Далее гибридомы создают уникальные возможности в аналитических целях: их можно применять как «иммунологический микроскоп» с чрезвычайно высоким разрешением. Так, например, если нужно сравнить две клеточные линии, отличающиеся одним или немногими антигенами, и надо выявить такие антигены, то метод гибридом предоставляет для этого исключительные возможности. Проиммунизировав мышей одной из линий и получив сотни гибридом, продуцирующих антитела к антигенам этой линии, можно найти одну или две с антителами только к данной линии. Размножив такую гибридому в пробирке или вырастив ее на мышах, можно получить огромное количество антител к уникальному антигену (или детерминантной группе), затерянному среди других компонентов клетки подобно иголке в стоге сена. Это будет продукт одного клона. В крови иммунизированного животного среди множества других антител он никак не проявится из-за чисто количественных отношений. Благодаря же гибридомам его можно не только обнаружить, но и вывести в линию и получить любое количество соответствующих антител. С помощью гибридом можно обнаружить антигены, характерные для опухолей определенных тканей, получить к ним антитела и использовать их для диагностики и типирования опухолей. Такие моноклональные антитела нашли широкое применение в онкологической клинике. Наконец, во всем мире ведутся активные исследования по использованию моноклональных антител в качестве специфических переносчиков токсических веществ в опухолевые клетки. Пока же с помощью моноклональных антител в опухоль и ее метастазы доставляются радиоактивные вещества, позволяющие обнаружить небольшие узелки опухоли по локализации в них радиоактивности.
Гибридомы сыграли и продолжают играть огромную роль в фундаментальной и прикладной иммунологии. Они созданы на основе клонально-селекционной теории иммунитета [3] и явились самым ярким и окончательным доказательством этой теории. Гибридомы сделали реальностью предполагаемые клоны антителообразующих клеток и позволили даже обнаружить их существование в организме до введения соответствующего антигена. Гибридомы революционизировали иммунологическую промышленность и создали в ней совершенно новые области. Благодаря гибридомам возникли новые методы диагностики многих заболеваний и открылись новые пути для изучения злокачественных опухолей. И хотя гибридомы скорее относятся к гениальным изобретениям, а не к открытиям, они были отмечены в 1984 году Нобелевской премией «за открытие и разработку принципов выработки моноклональных антител с помощью гибридом». Если бы Кёлер и Мильштейн запатентовали свой метод, они вскоре бы стали миллиардерами, так как все, кто использовал бы гибридомы в коммерческих целях, должны были бы платить за право пользоваться патентом. Авторы гибридом, несомненно, понимали это, но в интересах развития науки не пошли на такой шаг. Метод гибридом беспрепятственно вошел во все сферы иммунологии, и сами авторы всемерно способствовали этому, предоставляя свою клеточную линию плазмоцитомы для исследований всем желающим. И первые гибридомы в нашей стране, полученные в 1979–1980 годах, были созданы на основе клеток, ведущих происхождение из лаборатории этих авторов и с их любезного разрешения.
Первоначально статья была опубликована в Соросовском образовательном журнале [1], позже — на сайте автора.
Синтетические моноклональные антитела
Автор дополнительной главы — Жанна Олиферова.
В 1975 году, когда Кёлер и Мильштейн опубликовали статью о методе получения гибридом [4] и предположили, что этот метод может быть использован в медицине и промышленности, мало кто верил в возможность практического применения моноклональных антител. Как ни курьёзно это сейчас звучит, в ответе, полученном Мильштейном из национальной корпорации по исследованиям и разработкам в 1976 году, была фраза: «Нам, несомненно, трудно сейчас определить непосредственные практические применения [метода гибридом], которые имели бы коммерческий потенциал. » [5]. В наши дни моноклональные антитела стали одним из необходимых реагентов в биологической лаборатории, а объёмы продаж лекарств, созданных на их основе, превышают миллиарды долларов [6]. Развитие каких технологий сделало возможным такое широкое их применение? Этот раздел статьи посвящен истории создания популярного современного метода получения моноклональных антител, который пришёл на смену технологии гибридом, и виртуозному применению синтетических моноклональных антител для решения научных проблем.
Описанный выше метод гибридом позволил получать неограниченное количество моноклональных антител, специфичных к одной детерминантной группе. Их широкое применение в медицине и иммунологии поставило новые задачи:
Появление такого метода стало возможном благодаря развитию нескольких научных направлений. Прежде всего этому способствовал прогресс в понимании структуры и функции антител. Какой механизм обусловливает высокую аффинность и специфичность антител, которые производит гибридома? Во время дифференцирования B-лимфоцитов (в процессе соматической генетической рекомбинации) нуклеотидная последовательность гена, кодирующего вариабельный домен B-клеточного рецептора, собирается из нескольких сегментов (рис. 4). Эта последовательность уникальна у каждой B-клетки, как и рецепторы на её поверхности. Когда B-клетка узнаёт свой антиген, она активируется и становится АОК, часть из которых сразу начинает производить антитела низкой аффинности. Рецепторы других АОК проходят процесс аффинного созревания, в результате которого аффинность и специфичность рецептора АОК, а, следовательно, и антител, повышается.
Аффинное созревание основано на соматической гипермутации, в процессе которой в последовательности вариабельных доменов рецепторов специальные белки вносят 1–5 мутаций на каждое деление клетки. Большинство мутаций приводит к тому, что B-клетка перестает узнавать антиген и погибает. Редкие мутации повышают аффинность рецептора к антигену (такие мутации накапливаются в CDR-участках), и B-клетки, несущие такие рецепторы, выживают, размножаются и производят антитела с высокой аффинностью и специфичностью [7], [8]. К сожалению, этот процесс ещё недостаточно хорошо изучен, чтобы его можно было контролировать в пробирке и таким образом получать антитела с нужной специфичностью.
Развитие методов генной инженерии привело к появлению новых возможностей: вариабельные и константные участки генов, кодирующих антитела, можно комбинировать в пробирке, вносить в них мутации, отбирать необходимые варианты и экспрессировать в бактериях. Так можно получать антитела с нужными свойствами, не иммунизируя мышей. Для того чтобы это стало реальностью, сначала надо было создать библиотеки вариабельных доменов антител. Начало этому было положено в 1989 году, когда соответствующие гены были выделены из пяти гибридом и из активированных клеток селезёнки иммунизированных мышей. Эти гены были клонированы, и были определены их нуклеотидные последовательности. В настоящее время для создания библиотек используют вариабельные домены наивных (неактивированных) лимфоцитов мышей или человека и даже комбинируют фрагменты природных вариабельных доменов с синтезированными человеком [9].
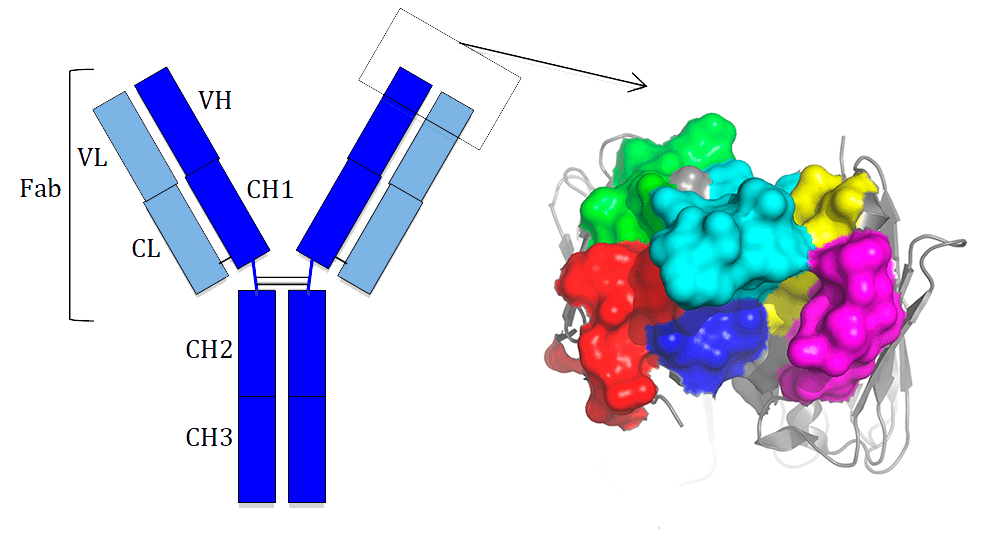
В 1988 году Fab-фрагмент антитела впервые был экспрессирован в бактерии. Чтобы создавать антитела без использования гибридом, оставалось решить последнюю задачу: физически связать между собой антитело и кодирующий его ген, тогда выбрав из библиотеки антитело, специфичное к данной молекуле, можно клонировать его ген для экспрессии в бактерии и получать нужное количество антител. В 1990 году Г. Винтер и соавторы встроили в геном бактериофага нуклеотидную последовательность Fab-фрагмента антитела, объединив его с частью гена поверхностного белка III этого фага [10]. Это позволило экспрессировать на поверхности каждой вирусной частицы несколько копий этого гибридного белка, сохраняющего специфичность к своему антигену, — а значит, можно было проводить селекцию нужного антитела из фаг-дисплейной библиотеки (рис. 5). Один раунд селекции может увеличить частоту фага, специфичного к данному антигену, в 1000 раз. За несколько раундов можно из большой популяции выделить редкие фаги, специфичные к данному антигену, извлечь из них ДНК, определить нуклеотидную последовательность и клонировать для получения антител в бактерии.
Рисунок 5. Фаг-дисплейные библиотеки. Бактериофаги, несущие миллионы различных фрагментов антител, наносят на колонку, содержащую нужный антиген (1). После отмывания ненужных фагов (2), те, которые связывают данный антиген (3), снимают с колонки и размножают в бактериях (4). Нуклеотидная последовательность отобранных фагов может быть модифицирована (5), после чего мутированные фаги размножают в бактериях (6) и повторяют процесс селекции (7).
Кристаллографические структуры комплексов антиген—антитело позволили понять принципы организации, стоящие за кажущимся бесконечным разнообразием природных антител [11], [12]. Например, за исключением CDR-участков, структура антител довольно консервативна: известно всего несколько десятков различных структур, некоторые из которых более стабильны и встречаются в природных антителах чаще. При создании современных фаг-дисплейных библиотек выбирается одна наиболее стабильная структура вариабельных доменов тяжёлой и легкой цепи, разнообразие аминокислотных остатков CDR-участков создаётся искусственно [12]. Анализ природных антиген-связывающих сайтов антител выявил, что наиболее часто непосредственно взаимодействуют с поверхностью антигена аминокислотные остатки тирозин (Tyr) и серин (Ser), поэтому первые библиотеки синтетических антител получали, варьируя именно эти остатки в ключевых позициях CDR. В последующих поколениях библиотек начали варьировать также остатки, которые не взаимодействуют с поверхностью антигена непосредственно, но влияют на конформацию CDR-участков. Современные библиотеки содержат более 10 миллиардов фрагментов антител с уникальной специфичностью [12].
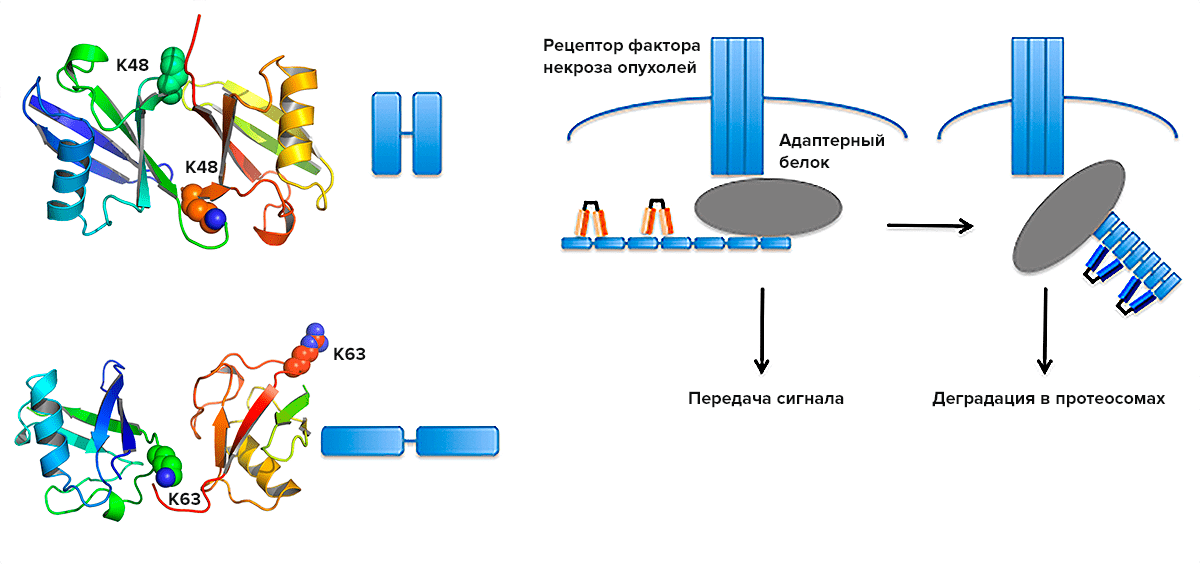
Пример успешного применения фаг-дисплейных библиотек — создание моноклональных антител, специфичных к различным конформациям белка убиквитина [13], [14]. В клетке встречаются полимеры убиквитина, связанные через боковые цепи разных остатков лизина (Lys). Lys48-связанные полимеры «помечают» белки, предназначенные для деградации в протеасомах, а Lys63-связанные цепи играют важную роль во многих клеточных процессах, — например, способствуют образованию сигнальных платформ рецепторов, включая рецептор фактора некроза опухолей 1 и рецептор интерлейкина 1 (ИЛ-1) (рис. 6). Для исследования убиквитиновых модификаций применялись дорогостоящие и трудоёмкие методы (такие как масс-спектроскопия), которые не позволяли следить за их быстрыми изменениями. Моноклональные антитела, специфично узнающие разные конформации полимеров убиквитина, стали бы незаменимым реагентом для исследования многих клеточных процессов. Долгое время попытки получить такие антитела были безуспешны.
Рисунок 6. Роль К63- и К48-связанных полимеров убиквитина в передаче сигнала от рецептора фактора некроза опухолей. Слева: К48- (вверху) и К63-связанный убиквитин (внизу) и их условные обозначения. Справа: Адаптерный белок RIP1 связывается с активированным рецептором, модификация К63-убиквитином важна для образования сигнальной платформы (5 мин). Через 10 мин деубиквитиназа А20 заменяет К63-связанные полимеры убиквитина на К48-связанные полимеры, что приводит к деградации сигнального комплекса. Антитела, узнающие две конформации убиквитина, показаны разными цветами.
Вишва Диксит и соавторы использовали фаг-дисплейные библиотеки для получения специфичных антител к Lys48- и Lys63-связанным полимерам убиквитина [15]. После четырех раундов из библиотеки были отобраны фрагменты антител, которые не связывались с моноубиквитином и были специфичны исключительно к Lys63- или Lys48-связанным полимерам, причем с наномолярной аффинностью. Выбранные антитела экспрессировали в бактериях и определили их аминокислотные последовательности. У антител к Lys48-связанным полимерам убиквитина вариабельность аминокислотных остатков была сконцентрирована в CDRH3, поэтому для повышения их аффинности в этот же участок внесли дополнительные мутации. Полученные после повторного отбора антитела к Lys48-связанным полимерам обладали очень высокой аффинностью (1,2 нМ).
Оптимизация антител к Lys63-связанным цепям потребовала, напротив, значительных усилий. Сначала, перед повторным отбором, мутации были внесены в CDRH1 и CDRH2, но аффинность полученных антител была на порядок ниже, чем у антител к Lys48-связанным цепям убиквитина. Для дальнейшей оптимизации была получена пространственная структура К63-связанных димеров убиквитина в комплексе с антителами, которая показала, что значительная часть паратопа составлена аминокислотными остатками CDRH2 и CDRL2, в которые и были внесены дополнительные мутации. Отобранные антитела имели высокое сродство к Lys63-связанному полимеру (6–7 нМ) и не связывались с другими конформациями убиквитина. Кристаллическая структура нового комплекса показала, что мутированные аминокислотные остатки не контактируют с поверхностью убиквитина, а повышение специфичности объясняется улучшением электростатической совместимости между поверхностями антигена и антитела.
Полученные антитела могут быть использованы для иммунопреципитации белков, модифицированных различными полимерами убиквитина, из клеточных лизатов, или для иммуннофлуоресцентного окрашивания клеток, что позволяет получить информация о пространственной организации модифицированных белков. С их помощью исследователям удалось проследить за быстрыми изменениями модификаций адаптерных белков в сигнальном каскаде, инициированном рецептором фактора некроза опухолей (ФНО) на поверхности клетки. Через пять минут после связывания ФНО со своим рецептором, киназа RIP1, модифицировнная К63-связанными полимерами убиквитина, связывается с рецептором. К63-полимеры убиквитина необходимы для взаимодействия с другими белками и передачи сигнала. Уже через 10 минут деубиквитиназа А20 начинает заменять К63- на К48-полимеры убиквитина, что приводит к деградации сигнального комплекса и прекращению сигнала (рис. 6). Такая же замена Lys63- на Lys48-связанные полимеры убиквитина происходит и во время передачи сигнала от других рецепторов, таких как рецептор ИЛ-1 и некоторых Толл-рецепторов. Время передачи сигнала варьирует в зависимости от рецептора: в случае рецептора ИЛ-1 замена K63→K48 происходит только через 30–60 минут после связывания лиганда [15].
Приведённый пример показывает, что развитие современных методов производства моноклональных антител превратило их в чрезвычайно точный научный инструмент, с помощью которого будет сделано ещё немало интересных открытий.