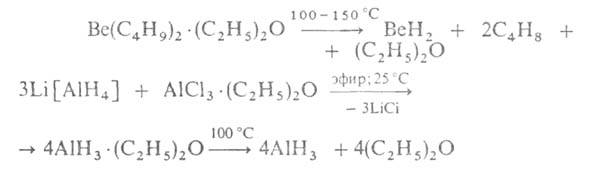Что такое гидриды металлов
Металлические гидриды
Содержание
Системы водород — металл
Системы водород — металл часто являются прототипами при изучении ряда фундаментальных физических свойств. Предельная простота электронных свойств и малая массы атомов водорода позволяют анализировать явления на микроскопическом уровне. Рассматриваются следующие задачи:
Сплавы водород — металл
Водород, локализованный в междоузлиях металлической матрицы слабо искажает кристаллическую решётку. С точки зрения статистической физики реализуется модель взаимодействующего «решёточного газа». Особый интерес представляет исследование термодинамических и кинетических свойств вблизи точек фазового перехода. При низкихтемпературах образуется квантовая подсистема с большой энергией нулевых колебаний и с большой амплитудой смещения. Это позволяет изучать квантовые эффекты при фазовых превращениях. Большая подвижность атомов водорода в металле делает возможным изучение процессов диффузии. Другим направлением исследований являются физика и физхимия поверхностных явлений взаимодействия водорода с металлами: распад молекулы водорода и адсорбция на поверхности атомарного водорода. Особый интерес представляет случай, когда начальное состояние водорода является атомарным, а конечное — молекулярным. Это важно при создании метастабильных металл-водородных систем.
Применение систем водород — металл
Интерметаллические металлогидриды
Гидриды интерметаллических соединений нашли широкое применение в промышленности. Основная часть перезаряжаемых батарей и аккумуляторов, например, для сотовых телефонов, переносных компьютеров (ноутбуков), фото- и видеокамер содержит электрод из металлогидрида. Такие аккумуляторы являются экологически чистыми, так как не содержат кадмия.
Полезное
Смотреть что такое «Металлические гидриды» в других словарях:
Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом[1],[2]. Классификация В зависимости от характера связи водорода различают… … Википедия
ГИДРИДЫ — соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Иногда к Г. относят соед. всех хим. элементов с водородом. Различают простые, или бинарные, Г., комплексные (см., напр., Алюмогидриды, Борогидриды металлов … Химическая энциклопедия
Гидриды — соединения водорода с другими элементами. В зависимости от характера связи водорода различают три типа Г.: ионные, металлические и ковалентные. К ионным (солеобразным) Г. относятся Г. щелочных и щёлочноземельных металлов. Это… … Большая советская энциклопедия
МЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ — (металлиды), обладают металлич. св вами, в частности электрич. проводимостью, что обусловлено металлич. характером хим. связи. К М. с. относятся соед. металлов друг с другом интер металлиды и мн. соед. металлов (в осн. переходных) с неметаллами.… … Химическая энциклопедия
Бороводороды — гидриды бора, бораны, соединения бора с водородом. Известны Б., содержащие от 2 до 20 атомов бора в молекуле. Простейший Б., BH3, в свободном состоянии не существует, он известен лишь в виде комплексов с аминами, эфирами и т.п. Характер… … Большая советская энциклопедия
Металлы — простые вещества, обладающие в обычных условиях характерными свойствами: высокой электропроводностью и теплопроводностью, отрицательным температурным коэффициентом электропроводности, способностью хорошо отражать электромагнитные волны… … Большая советская энциклопедия
АЗОТА ФОСФОРА СЕМЕЙСТВО — ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у… … Энциклопедия Кольера
ИНТЕРМЕТАЛЛИДЫ — (от лат. inter между и металл) (интерметаллич. соединения), хим. соед. двух или неск. металлов между собой. Относятся к металлическим соединениям, или металлидам. И. образуются в результате взаимод. компонентов при сплавлении, конденсации из пара … Химическая энциклопедия
МЕТАЛЛЫ — (от греч. metallon первоначально, шахта, копи), в ва, обладающие в обычных условиях характерными, металлическими, свойствами высокими электрич. проводимостью и теплопроводностью, отрицат. температурным коэф. электрич. проводимости, способностью… … Химическая энциклопедия
Металл — (Metal) Определение металла, физические и химические свойства металлов Определение металла, физические и химические свойства металлов, применение металлов Содержание Содержание Определение Нахождение в природе Свойства Характерные свойства… … Энциклопедия инвестора
ГИДРИДЫ
ГИДРИДЫ, соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Иногда к гидридам относят соед. всех хим. элементов с водородом. Различают простые, или бинарные, гидриды, комплексные (см., напр., Алюмогидриды, Борогидриды металлов)и гидриды интерметаллич. соединений. Для большинства переходных металлов известны также комплексные соед., содержащие атом Н наряду с др. лигандами в координац. сфере металла-комплексообразователя.
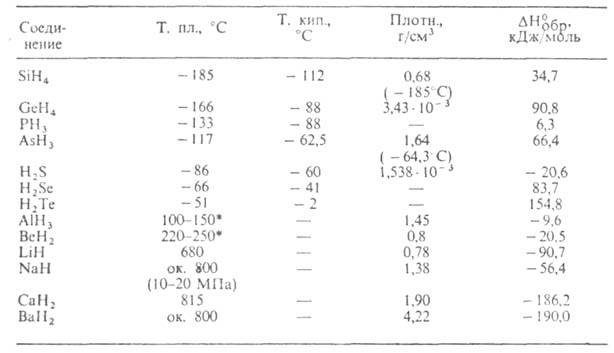
К ковалентным относят гидриды неметаллов, Al, Be, Sn, Sb. Гидриды SiH4, GeH4, SnH4, PH3, AsH3, SbH3, H2S, H2Se, H2Te (см. табл. 1) и низшие бороводороды-газы. Ковалентные гидриды обладают высокой реакц. способностью. Эффективный положит. заряд атома Э в молекуле возрастает в пределах одной группы периодич. системы с увеличением его порядкового номера. Элементы Si и Ge образуют высшие гидриды общей ф-лы ЭnН2n + 2 (п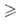
Табл. 1.-СВОЙСТВА ПРОСТЫХ КОВАЛЕНТНЫХ И ИОННЫХ ГИДРИДОВ
Гидриды подгруппы фосфора получают р-цией ЭС13 с Li[AlH4] в эфире при 25 °С; SiH4 и GeH4-взаимод. Мg2Э с водой или с В2Н6 в жидком NH3; H2S, H2Se и Н2Те-кислотным гидролизом сульфидов, селенидов или теллуридов металлов (H2S-также взаимод. Н, и S). Все упомянутые гидриды, особенно AsH3 и РН3, высокотоксичны. Гидриды Ge, Si, As используют для получения полупроводниковых материалов. См. также Мышьяка гидрид, Сероводород, Силаны, Фосфины.
Гидриды ВеН2 и А1Н3, существующие в полимерном состоянии, а также крайне нестойкий термически Ga2H6 по природе хим. связи Э—Н близки к бороводородам: для них характерен дефицит электронов, в связи с чем образование молекул или кристаллов происходит с участием двухэлектронных трехцентровых мостиковых (Э—Н—Э) и многоцентровых связей. Для этих гидридов характерны очень высокие энтальпии сгорания. Они взаимод. с водой, выделяя Н2. С донорами электронов, напр. с NR3, PR3, образуют аддукты, с В2Н6 в среде апротонных орг. р-рителей-соотв. Аl[ВН4]3 и Ве[ВН4]2. Получают гидриды Аl и Be по р-циям:
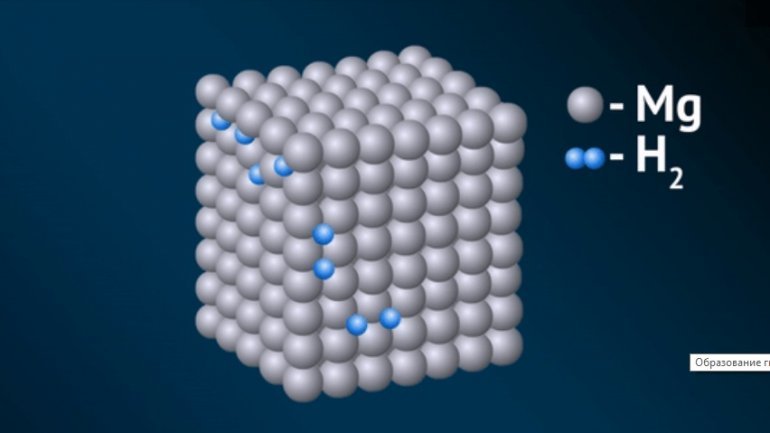
Гидрид Mg по св-вам и природе хим. связи занимает промежут. положение между ковалентными и ионными гидридами; кристаллы с решеткой типа ТiO2; при высоких давлениях (
7 МПа) претерпевает полиморфные превращения. С водой и водными р-рами к-т и щелочей MgH2 взаимод. с выделением Н2, однако менее энергично, чем гидриды щелочных и др. щел.-зем. металлов. М. б. получен взаимод. Mg с Н2 при 200-250 °С и давлении 10 МПа (скорость р-ции мала) либо обменной р-цией MgHal2 с МН или М [А1Н4], где М—Li, Na, в среде орг. р-рителя. Легко образуется при гидрировании сплавов Mg, содержащих небольшие добавки РЗЭ и переходных металлов, при 150-180°С и 1-5 МПа, причем р-ция обратима. В связи с этим такие сплавы-перспективные хим. аккумуляторы Н2 для нужд малой энергетики, металлургии и хим. технологии.
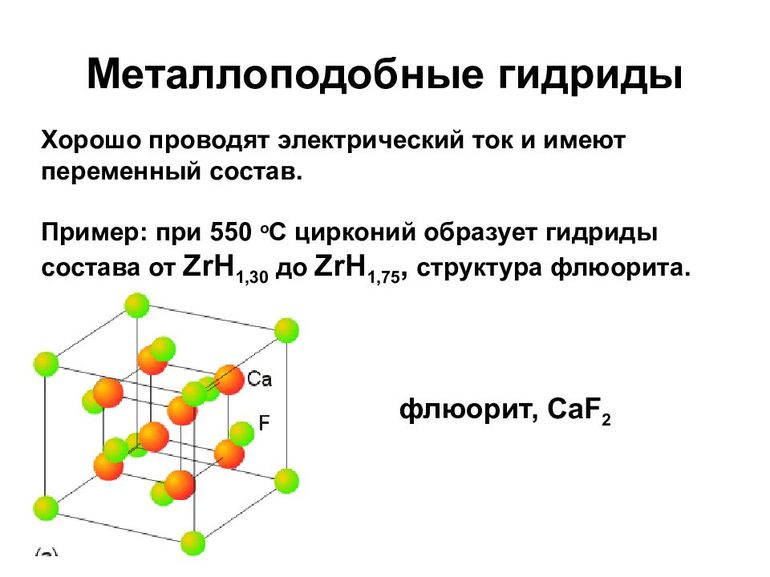
К металлоподобным относят гидриды переходных металлов и РЗЭ. Формально такие соед. могут рассматриваться как фазы внедрения водорода в металл. Их образованию всегда предшествует адсорбция Н2 на пов-сти металла.
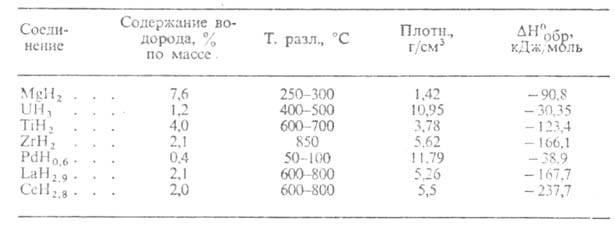
Металлоподобные гидриды (см. табл. 2)-светло- и темно-серые кристаллы с металлич. блеском, устойчивые на воздухе при комнатной т-ре. С О2, водой и водяным паром реагируют медленно. М.б. получены взаимод. металла с Н2 при обычной т-ре или при нагр.; напр., TiH2 и LaH3 синтезируют при 150-200 °С. Получение гидридов стехиометрич. состава в большинстве случаев сопряжено со значит. трудностями из-за высокой чувствительности гидрироваиия к наличию примесей в металле и особенно О2 и водяных паров в Н2. Металлоподобные гидриды ограниченно применяют в кач-ве источников Н2 высокой чистоты (используемых, напр., в топливных элементах) и для поглощения Н2 из газовых смесей. Гидриды Pd-катализаторы гидрирования, изомеризации, орто- и парапревращения Н2.
Табл. 2.-СВОЙСТВА МЕТАЛЛОПОДОБНЫХ ГИДРИДОВ
Гидриды интерметаллических соединений. Содержат обычно атомы РЗЭ, Mg, Ca, Ti, Al, Fe, Co, Ni, Си. Легко образуются при взаимод. интерметаллидов даже с техн. Н2 (содержащим до 1-2% примесей О2 и водяного пара) при 25-200°С и давлениях Н2 0,1-1 МПа; скорость поглощения Н2 очень велика. Р-ции характеризуются малыми тепловыми эффектами (20-30 кДж на 1 моль Н2, для индивидуальных металлов-100-120 кДж) и не приводят к значит. изменениям в структуре исходной металлич. матрицы; в большинстве случаев происходит лишь увеличение ее объема на 10-30%. Для гидридов этого типа характерна высокая подвижность водорода и большая хим. активность (о св-вах см. также табл. 3).
Данная р-ция характерна для соед., образованных РЗЭ и Mg, а также РЗЭ и Fe, Ni или Со. Так, гидрид РЗЭ, образующийся при гидрогенолизе интерметаллида, содержащего Mg, катализирует как гидрирование Mg, так и дегидрирование MgH2 при 150-180°С: МН2 + nMg + (n + 0,5) Н2
Благодаря высокому содержанию Н2, возможности значит. смещения равновесия в ту или др. сторону посредством небольших изменений т-ры и давления Н2, способности поглощать Н2 при низких т-рах и устойчивости к действию О2 и влаги воздуха, гидриды интерметаллич. соединений м.б. использованы как хим. аккумуляторы слабосвязанного водорода. Перспективно их применение как источников топлива для автономных энергосистем, напр. автомобильного транспорта (см. Водородная энергетика), а также для получения высокодисперсных металлич. порошков и катализаторов гетерог. гидрирования.
Табл. 3.-СВОЙСТВА ГИДРИДОВ ИНТЕРМЕТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
===
Исп. литература для статьи «ГИДРИДЫ» : Гидриды металлов, пер. с англ., М., 1973; Девятых ГГ., Зорин А. Д., Летучие неорганические гидриды особой чистоты, М., 1974; Антонова А. М., Морозова Р. А., Препаративная химия гидридов. К., 1976; Водород в металлах, пер. с англ., т. 2, М., 1981. К.Н. Семененко.
Страница «ГИДРИДЫ» подготовлена по материалам химической энциклопедии.
Гидриды
Классификация
В зависимости от характера связи водорода различают три типа гидридов:
Примеры
Примечания
Полезное
Смотреть что такое «Гидриды» в других словарях:
гидриды — Соединения водорода с металлами и менее электроотрицательными элементами (неметаллами). Различают простые (бинарные) г.; комплексные, напр. алюминогидриды У(АlН4), Са(АlH4)2 и т.п., борогидриды Аl(ВН4), Zr(BH4), Са(ВН4) и др. и г. интерметаллидов … Справочник технического переводчика
ГИДРИДЫ — химические соединения водорода с другими элементами. Восстановители. Некоторые гидриды промежуточные продукты при получении особо чистых элементов (кремния, германия). См., напр., Алюмогидриды, Борогидриды металлов … Большой Энциклопедический словарь
Гидриды — [hydrides] соединения водорода с металлами и менее электроотрицательными элементами (неметаллами). Различают простые (бинарные) гидриды; комплексные, например, алюминогидриды Li(АlH4), Са(АlH4)2 и т. п., борогидриды Al(ВH4), Zr(ВH4), Са(ВH4) и др … Энциклопедический словарь по металлургии
ГИДРИДЫ — соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Иногда к Г. относят соед. всех хим. элементов с водородом. Различают простые, или бинарные, Г., комплексные (см., напр., Алюмогидриды, Борогидриды металлов … Химическая энциклопедия
гидриды — химические соединения водорода с другими элементами. Восстановители. Некоторые гидриды промежуточные продукты при получении особо чистых элементов (кремния, германия). См., например, Алюмогидриды, Борогидриды металлов. * * * ГИДРИДЫ ГИДРИДЫ,… … Энциклопедический словарь
Гидриды — соединения водорода с другими элементами. В зависимости от характера связи водорода различают три типа Г.: ионные, металлические и ковалентные. К ионным (солеобразным) Г. относятся Г. щелочных и щёлочноземельных металлов. Это… … Большая советская энциклопедия
гидриды — мн. Химические соединения водорода с каким либо другим элементом. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
ГИДРИДЫ — соединение водорода с металлами и нек рыми неметаллами. Г. применяют для получения особо чистых элементов (напр., кремния, германия), как восстановители и катализаторы в органич. синтезе (Г. лития и натрия), для хранения и транспортирования… … Большой энциклопедический политехнический словарь
ГИДРИДЫ — хим. соединения водорода с др. элементами. Восстановители. Нек рые Г. промежуточные продукты при получении особо чистых элементов (кремния, германия). См., напр., Алюмогидриды, Борогидриды металлов … Естествознание. Энциклопедический словарь
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
Металлические гидриды
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
Соединения с ионным типом связи
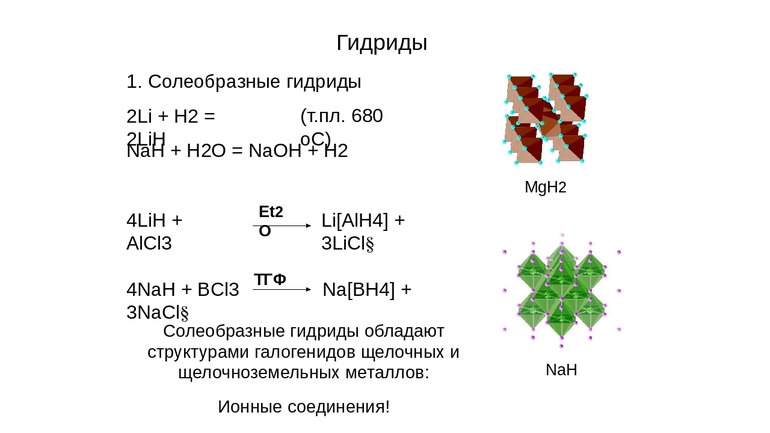
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Интерметаллические соединения
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.
У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
Гидриды
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водородные соединения разделяют на солеобразные гидриды и летучие водородные соединения.
Летучие водородные соединения НЭ – это соединения неметаллов с водородом. Степень окисления водорода равна +1.
| Летучие водородные соединения НЭ – это соединения неметаллов с водородом | Солеобразные гидриды ЭН – это соединения металлов IA, IIA групп и алюминия с водородом |
| Степень окисления водорода равна +1. Для солеобразных гидридов характерны некоторые свойства солей: гидролиз, обменные реакции и т.д. | |
| Элементы IVА гр.: ЭН4 (SiH4 – силан, CH4 – метан) Элементы VА гр.: ЭН3 (NH3 — аммиак, PH3 — фосфин, AsH3 – арсин, SbH3 – стибин) Элементы VIА гр.: Н2Э (Н2S – сероводород, H2Se – селеноводород, Н2Те – теллуроводород и т.д.) Элементы VIIА гр.: НЭ (НF – фтороводород, хлороводород и т.д.) | NaH – гидрид натрия, CaH2 – гидрид кальция и т.д. |
Стибин SbH3 (сурьмянистый водород) — неорганическое бинарное химическое соединение сурьмы с водородом, имеющее чесночный запах.
Арсин AsH3 (мышьяковистый водород, гидрид мышьяка) — гидрид мышьяка, химическое соединение мышьяка и водорода. При нормальных условиях — ядовитый бесцветный газ. Абсолютно чистый химически арсин запаха не имеет, но ввиду неустойчивости продукты его окисления придают арсину чесночный запах. Сильный восстановитель.