Что такое гиперфиксация рфп при пэт кт
Что показывает ПЭТ КТ
В этой статье коротко коснемся нормы и патологий, которые показывает метод ПЭТ КТ. Пройдемся по распространенным формулировкам, которые радиологи употребляют в заключениях по снимкам, и дадим трактовку.
Об информативности метода в общих чертах
В общих чертах, кроме нормы исследование ПЭТ КТ показывает качество клеток, очаг распространения “плохих” клеток, реакцию “плохих” клеток на лечение, замедление обменных процессов на клеточном уровне.
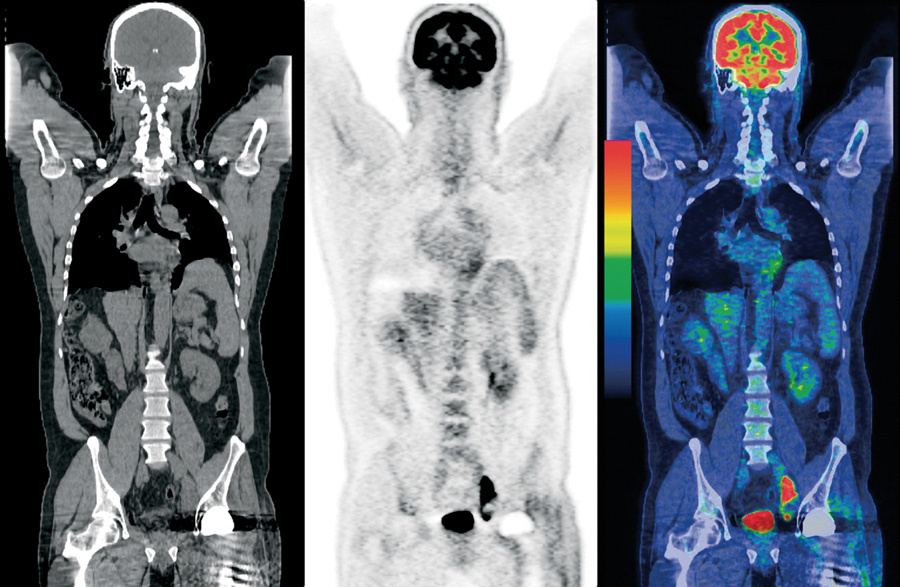
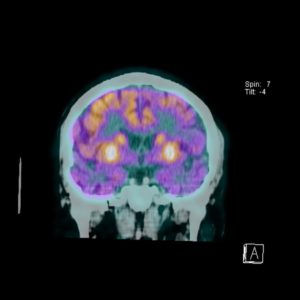
Рис. 1: Пример снимка ПЭТ КТ
Что и как выявляет ПЭТ КТ, и какие заболевания диагностируют этим методом исследования, разбираем далее.
Метаболизм клеток как индикатор
Что означает физиологическое накопление РФП
Некоторые ткани нашего организма в норме поглощают больше глюкозы. К таким относится головной мозг, скелетная мускулатура, миокард, желудочно-кишечный тракт, почки. Кроме этого, так называемая гиперфиксация наблюдается в местах скопления жировой ткани, в особенности, бурого жира.
То есть, под физиологической гиперфиксацией РФП понимают норму.
Естественное накопление препарата несколько отличается от патологического. Распределение РФП в этом случае мягкое диффузное. В норме снимки не содержат ярких вкраплений и угасаний. Препарат распределяется равномерно.
Что показывает метод
Рис 3: Гибернация миокарда на ПЭТ КТ (участки выделены синим)
Опухоли нервной системы визуализируются на ПЭТ КТ по принципу других опухолей, то есть, в форме повышенного накопления препарата.
Кроме гибернации миокарда посредством ПЭТ КТ диагностируют формы ишемической болезни сердца, не требующие неотложного вмешательства. То есть, выявляют заболевание на ранней стадии развития, неопасной для жизни пациента.
Что показывает ПЭТ КТ всего тела при онкологии
Опухолевые клетки характеризуются склонностью к бесконтрольному быстрому делению и росту. Эти процессы требуют постоянного поступления питательных веществ, в том числе, глюкозы, что позволяет увидеть на ПЭТ КТ малейшие очаги патологии. Если другие визуализационные методы малоэффективно отражают морфологические изменения и степень активности процесса, особенно при малых размерах опухолей; то ПЭТ КТ позволяет диагностировать рак на сверхранних стадиях, когда никак иначе болезнь обнаружить нельзя.
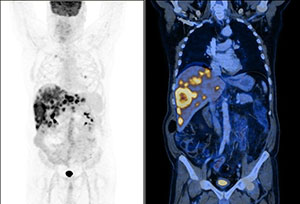
Рис. 4: Метастазы в печени на ПЭТ КТ
На снимке Рис. 4 видны метастазы опухоли в печень. Обратите внимание, что на изображении визуализируются даже небольшие по размерам узлы, расположенные на периферии.
Еще одно специфическое свойство ПЭТ КТ в онкологии – это дифференцировка между лучевым некрозом окружающей опухоль ткани и прогрессированием опухоли. На КТ разница заметна не всегда. На ПЭТ КТ некроз выглядит, как снижение накопления РФП, тогда как ткани прогрессирующей опухоли выражаются в виде увеличенной площади накопления. Эта разница в отображении помогает доктору сделать правильный вывод.
Распространенные формулировки в заключении
ПЭТ КТ, как другие виды исследования, описывают по протоколу. То есть, по установленному порядку описания отделов и органов. Заключение в зависимости от области исследования содержит разные формулировки, но существуют устоявшиеся определения и показатели, которые встречаются чаще остальных и применяются ко всем отделам тела.
Разберем основные формулировки из заключений ПЭТ КТ, которые часто вызывают вопросы на практике у наших пациентов.
Что такое suv max при ПЭТ КТ
Suv расшифровывается, как Standardized Uptake Value, что в переводе на русский язык означает “стандартизированный уровень захвата”. Показатель отражает интенсивность накопления РФП и рассчитывается для каждого конкретного участка автоматически программой аппарата ПЭТ. Единица измерения Suv зависит от модели томографа.
Показатель характерен только для метода ПЭТ КТ, Suv max не имеет строго установленной нормы. Его величина важна, главным образом, в исследовании динамики.
Значение Suv max при ПЭТ КТ в онкологии обозначает метаболический ответ опухоли на проведенное лечение. Что это значит? Показатель отражает то, как реагируют злокачественные клетки на лучевую или химиотерапию. Поэтому в заключении ПЭТ КТ степень накопления РФП в виде значения Suv max несет важнейшее значение для лечащего врача.
Различают несколько вариантов метаболического ответа патологического очага.
При положительной динамике наблюдается (уменьшение накопления препарата на 25% и более) или (повышенное накопление отсутствует).
В отрицательной динамике различают (РФП накапливается на 25% больше, или диагностированы новые очаги патологии) и (изменения показателя менее 25%, расцениваются как недостоверные данные).
Метаболическая активность на ПЭТ КТ: что это такое
Еще одна формулировка, которая часто употребляется в заключении радиологов при диагнозе “онкология” и вызывает вопросы пациентов.
Диагностика рака легких ПЭТ-КТ
Рак легкого является ведущей причиной смерти от рака во всем мире и обусловливает 1,59 миллионов смертей в год. Несмотря на прогресс, достигнутый в лечении пациентов, страдающих этой болезнью, пятилетняя выживаемость все еще остается невысокой, составляя приблизительно 15–16%. Основным фактором риска развития рака является табакокурение, повышающим вероятность его возникновения более чем в десять раз по сравнению с некурящими людьми. Другими состояниями, при которых повышен развития новообразования, являются идиопатический легочный фиброз и воздействие канцерогенов, например, асбеста.
Правильное определение стадии является крайне важным и необходимым моментом, позволяющим правильно спланировать лечение и оценить выживаемость. У больных раком легких является методом выбора при определении стадии опухоли, более эффективным, чем другие лучевые методы, такие как КТ или рентгенография. Благодаря возможности одновременной оценки анатомических и функциональных изменений, ПЭТ-КТ позволяет добиться большей точности по сравнению с ПЭТ и КТ в отдельности.
Этот метод диагностики позволяет более четко определить первичную опухоль, отличить опухолевую ткань от участков ателектаза и фиброзных изменений, расположенных рядом. Доказана высокая эффективность в оценке состояния лимфоузлов, а также обнаружения отдаленных метастазов. Также была подтверждена ценность этого метода как инструмента прогнозирования выживаемости путем оценки метаболизма в опухоли при первичном исследовании и в определении раннего (промежуточного) и завершающего ответа на химиотерапию. В последних литературных источниках этот метод был упомянут как рекомендуемый с экономической точки зрения.
Что такое ПЭТ-КТ?
ПЭТ-КТ является комбинированным методом визуализации, позволяющим совместить информацию об анатомических изменениях, полученную с помощью КТ, и данные об изменениях метаболизма, полученные при использовании ПЭТ; при этом исследовании существует возможность просмотра данных методов по отдельности, либо при наложении друг на друга на трехмерных реконструкциях или плоских (двухмерных) срезах. Чаще всего применяется радиофармпрепарат F18-фтордезоксиглюкова (ФДГ), использование которого позволяет обнаружить как первичную опухоль, так и метастазы. Это происходит потому, что большинство патологических очагов злокачественной природы в легких захватывают глюкозу, и видны на сканах в виде ярких участков. При ПЭТ-КТ обычно не используются йодсодержащие контрастные средства, в то же время возможно дополнительное КТ-сканирование с применением контрастных веществ. Использование йодсодержащего контрастного вещества улучшает визуализацию сосудов средостения и позволяет лучше определить их отношение к опухоли, помогает также оценить средостение и плевру, дает возможность исключить сопутствующую тромбоэмболию легочной артерии (если была выполнена КТ-ангиопульмонография).
Стадии рака легкого
В первичном обследовании пациента, страдающего раком легкого, должны принимать участие несколько специалистов: опытный рентгенолог, специалист по ядерной медицине (радионуклидным методам — сцинтиграфии и ПЭТ), рентгенохирург (специалист в области интервенционной радиологии), пульмонолог, торакальный хирург; необходимо также использовать точные и экономически эффективные методы диагностики. Существующие на данный момент руководства содержат рекомендации, что методы нужно выполнять любому пациенту, у которого имеется высокий риск рака, предпочтительно с выполнением гистологического исследования и взятием образцов ткани. Это позволяет не только установить точный гистологический вариант опухоли, но и правильно стадировать заболевание. Во многих случаях предпочтительнее выполнить биопсию подозрительных лимфоузлов средостения, а не первичной опухоли, что позволяет лучше оценить стадию (например, при биопсии лимофузла с выполнением ПЭТ ставится стадия T2N2, в то время как без ее использования – T2Nx). Кроме того, для опухолей, осложненных обструктивной пневмонией, и образований с выраженными некротическими изменениями, данные играют важную роль для определения области биопсии.
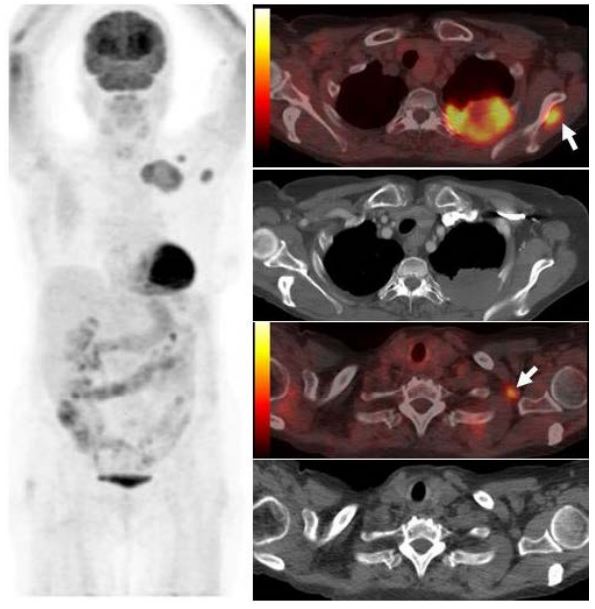
Опухоль левого легкого с частичным некрозом и деструкцией ребер. Визуализируются два метастаза в подключичных лимфоузлах и в мышцах (стрелки), которые на КТ не видны. Необходимо выполнить трансторакальную биопсию той части опухоли, которая расположена в периферических отделах, чтобы получить образец жизнеспособных тканей.
Варианты рака легкого
В 85–95% случаев рак легкого является немелкоклеточным и представляет собой аденокарциному, плоскоклеточный рак или крупноклеточный рак. Аденокарцинома может возникать как у курящих, так и некурящих пациентов; обычно представляет собой периферическую опухоль; рано дает отдаленные метастазы. Степень захвата аденокарциномой F18-ФДГ имеет тенденцию быть ниже по сравнению с опухолями иного гистологического строения; некоторые опухоли, характеризующиеся низким уровнем метаболизма глюкозы, могут обуславливать ложноотрицательный результат.
Плоскоклеточный рак тесно связан с курением, в большинстве случаев является центральным. Крупноклеточный рак обычно представляет собой периферическое объемное образование в легочной ткани большого размера с наличием метастазов на момент установления диагноза. Крупноклеточный и плоскоклеточный рак характеризуются повышенным накоплением F18-ФДГ. Стадирование немелкоклеточного рака легкого осуществляется в соответствии со шкалой TNM; таким образом, информация о стадии заболевания дает возможность планирования лечения и прогнозирования выживаемости.
Остальные 10–15% случаев обусловлены мелкоклеточным раком, биологически более агрессивным, при котором стадирование, лечение и прогноз отличаются от таковых при немелкоклеточном раке. Этот тип рака очень тесно связан с курением. Выделяют две стадии заболевания: ограниченную, при которой опухоль располагается в половине грудной клетки на стороне поражения, в том числе в средостении и ипсилатеральной надключичной области; и распространенную, когда опухоль распространяется за пределы одной половины грудной клетки. Поскольку мелкоклеточный рак легочной ткани в корне отличается от немелкоклеточного, его диагностика при помощи будет обсуждаться в специально отведенной главе в конце этой статьи.
Визуализация первичной опухоли: Т-стадия
С помощью КТ можно достоверно оценить размер опухоли практически во всех случаях. Тем не менее, при наличии обусловленных опухолью осложнений, например, ателектаза легкого или обструктивной пневмонии, истинный размер первичной опухоли оценить сложнее. Позволяет отличить паренхиму спавшегося участка легочной ткани от злокачественной опухоли, т. к. опухоль характеризуется интенсивным захватом ФДГ, а спавшееся легкое — нет. Также он помогает оценить опухолевую инвазию (прорастание) в плевру и средостение. Накопление плеврой ФДГ всегда является патологическим, и при наличии новообразования органов дыхания крайне подозрительно на метастатическое поражение. При прорастании опухоли в средостение необходимо выполнять КТ с внутривенным введением йодсодержащего контрастного вещества с целью определения взаимоотношения опухоли, крупных кровеносных сосудов и перикарда.
Интенсивный захват ФДГ первичной опухолью обусловлен ее биологическим типом и степенью «агрессивности» опухолевых клеток; повышенный захват ФДГ может становиться прогностическим фактором рецидива. В исследовании Kim et al. была продемонстрирована группа пациентов, подвергшихся оперативному вмешательству по поводу новообразований легких, у которых при патологическом исследовании была установлена стадия N0. У пациентов, у которых возник рецидив опухоли, максимальный стандартизированный уровень накопления (SUV max) первичной опухолью легкого был выше, чем у пациентов, у которых рецидива не было. Пороговое значение SUV max, отделяющее пациентов с высоким уровнем рецидива, было определено равным 6,9. Было также сделано заключение, что для пациентов высокой группы риска по развитию рецидива предпочтительна изначально более «агрессивная» терапия. Таким образом, помогает точно спрогнозировать, как будет вести себя опухоль после лечения.
ПЭТ-КТ лимфоузлов: N-стадия
С помощью ПЭТ можно обнаружить метастатическое поражение лимфоузлов корней легких и средостения лучше, чем с помощью любого другого метода, так как метаболически активные лимфоузлы при ПЭТ-КТ, даже малого размера, характеризуются повышенным захватом ФДГ. Это справедливо и для тех случаев, когда морфологические признаки злокачественного поражения узлов могут не обнаруживаться на КТ-изображениях. Также метод позволяет оценить увеличенные лимфоузлы, не накапливающие или минимально накапливающие радиофармпрепарат, которые часто носят реактивный характер или отражают остаточные изменения в отсутствие опухолевого поражения. При определении стадии N чувствительность составляет 81% против 61% у КТ, и специфичность 90%, в то время как КТ характеризуется специфичностью 79%.
Наибольшее преимущество в оценке средостения — это возможность исключить злокачественное поражение любого лимфоузла с высокой степенью точности. То есть, отсутствие интенсивного захвата ФДГ лимфоузлом достоверно говорит об истинном отсутствии метастазов (прогностическое значение отрицательного результата равно 99%). В то же время не все лимфоузлы средостения, характеризующиеся повышенным метаболизмом, обязательно являются злокачественными; ложноположительный результат может быть обусловлен воспалительными изменениями. Это объясняет, почему изменения со стороны средостения должны оцениваться количественно с использованием SUV (стандартизированного уровня накопления). Пороговое значение SUV max в пределах 4,0–5,3 позволяет рассматривать изменения со стороны лимфоузлов средостения как положительные (то есть, метастатическое поражение есть).
Лучшее картирование лимфоузлов средостения позволяет избежать медиастиноскопии, ограничившись трансбронхиальной игольной аспирацией под контролем УЗИ, особенно в труднодоступных областях, таких как аортопульмональное окно или область, находящаяся позади бифуркации трахеи.
Особенное значение в стадировании поражения лимфатических узлов имеет на ранних стадиях заболевания (I и II), что позволяет избежать ненужной торакотомии.
Оценка метастазов: M-стадия
У 40–50% пациентов, страдающих раком органов дыхания, в момент установления диагноза присутствуют метастазы. Наличие отдаленных метастазов в корне меняет план лечения этих пациентов, делая оперативное вмешательство намного более сложным, что приводит к гораздо более неблагоприятному прогнозу. ПЭТ-КТ имеет неоспоримые преимущества в диагностике метастазов по сравнению с традиционными методами исследования, особенно в случаях одновременного метастатического поражения множества органов, часто без какой-то определенной локализации вследствие диссеминации процесса. Повышенное накопление ФДГ в метастазах рака легкого и возможность исследования всего тела делают методом выбора при выявлении метастазов (вне головного мозга). Также метод позволяет выявить отдаленные метастазы, о которых до проведения исследования ничего не было известно, вплоть до 30% всех случаев.
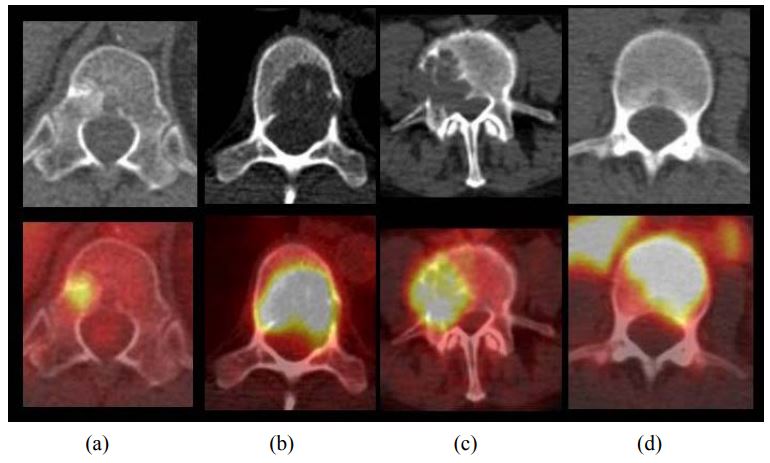
Самые частые вторичные изменения при раке легкого – метастазы в кости, которые имеют место у 8–27% пациентов на момент установления диагноза. Вторичные изменения костей лучше обнаруживаются при помощи ПЭТ, чем при использовании других методов диагностики. Так, больше чем в половине случаев костных метастазов поражается только костный мозг и не происходит существенного нарушения костной структуры, из-за чего при помощи рентгенографии и КТ их не удается обнаружить, и даже сцинтиграфия скелета с использованием метилендифосфоната Tc-99m оказывается малоспецифичной при обнаружении этого типа поражений. Метастазы в кости могут иметь исключительно литический характер и интенсивно накапливать ФДГ, но в то же время гиперфиксация препарата в очагах поражения может и не определяться.
Типы метастазов в кости при раке легкого. (a) Остеобластический. (b) Остеолитический. (c) Смешанный. (d) Поражение костного мозга.
У пациентов, страдающих раком легкого, часто возникают метастазы в органы брюшной полости. Чаще всего поражаются печень и надпочечники. Поскольку также могут встречаться доброкачественные изменения печени и надпочечников, необходимо использовать диагностические методы, позволяющие распознать их и отличить от метастазов. В случаях изменений со стороны надпочечников, умеренное или выраженное накопление ФДГ обладает высокой прогностической ценностью положительного результата для метастазов. Чувствительность и специфичность ПЭТ с использованием SUV (стандартизированного уровня накопления) в целом в популяции составляет 87% и 87%, в то время как у пациентов с раком легкого 94% и 82% соответственно. Лучшим пороговым значением SUV max, позволяющим дифференцировать злокачественные и доброкачественные поражения, по-видимому, является 2,5.
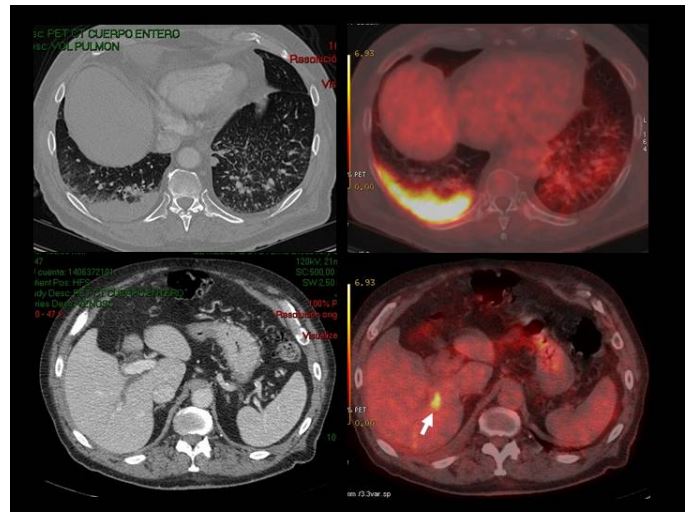
В случаях метастазов в печень, практически все доброкачественные поражения (кисты, гемангиомы, фокальная нодулярная гиперплазия) характеризуются меньшим или идентичным по сравнению с паренхимой печени уровнем накопления ФДГ. Любой узел, любые объемные образования, накапливающие ФДГ интенсивнее, чем нормальная паренхима печени, крайне подозрительны на злокачественные изменения.
Метастазы в печени при аденокарциноме правого легкого. Определяется один метастаз в печени, который не виден на КТ с контрастным усилением.
Для обнаружения метастазов в надпочечники, почки и кости, в случаях, когда невозможно проведение, приемлемой альтернативой является МРТ всего тела с выполнением программы DWI. Позволяет оценить метастазы в областях, изменения в которых не стадируются при традиционных методах диагностики, например, в коже, скелетных мышцах, мягких тканях, поджелудочной железе, почках.
Второе мнение по ПЭТ-КТ
Необходимым условием достоверного определения стадии злокачественного новообразования является правильная оценка результатов ПЭТ-исследования. При неоднозначных или противоречивых результатах рекомендуется получить второе мнение специализированного радиолога. Повторный экспертный анализ исследования в профильном центре позволяет избежать ошибки интерпретации снимков, сделать более обоснованные выводы о стадии процесса, наличии или отсутствии метастазов, вторичных очагов в лимфатических узлов. Это исключительно важно и планировании тактики операции, химио- и лучевого лечения.
Стадирование метастазов в головной мозг
Даже несмотря на то, что вторичные изменения головного мозга не так часто встречаются у пациентов с раковыми опухолями легких, они имеют большое значение, поскольку их наличие приводит к высокому уровню заболеваемости и смертности, чего в некоторых случаях можно избежать или минимизировать путем подбора соответствующего лечения. Поскольку головной мозг характеризуется высоким базовым метаболизмом глюкозы, вторичные очаги в нем могут быть замаскированы, а чувствительность ПЭТ-исследования в обнаружении метастазов – ограничена. В связи с этим, в соответствии с существующими на данный момент протоколами рекомендуется дополнительное использование МРТ. В случаях, когда провести МРТ невозможно, можно сделать КТ с внутривенным контрастным усилением. Это дает схожие результаты с МРТ головного мозга.
Одновременное присутствие легочной и внелегочной опухоли
У 1–8% пациентов, страдающих раком легкого, на момент установления диагноза обнаруживается рак иной локализации. Большинство этих новообразований также тесно связаны с табакокурением. И, действительно, у 6,5% хронических курильщиков, которым была выставлена та или иная стадия рака любого типа, на момент установления диагноза обнаруживался одновременно существующий рак других органов и систем.
В случаях множественного рака используемые диагностические критерии являются следующими:
На основании этих критериев, частота синхронного множественного рака легкого, описанная в литературе, составляет 0,5–3,3%. Наиболее часто одновременно существующие раковые опухоли, обнаруживаемые у пациентов, страдающих раком легкого, располагается в молочных железах, в голове и шее, пищеводе и щитовидной железе. Более чем 80% этих синхронных поражений обнаруживаются на ранней стадии, что предполагает возможность лечения, устраняющего причину заболевания. Тем не менее, возможность лечения в значительной степени зависит от того, насколько далеко зашла раковая опухоль на момент установления диагноза.
ПЭТ-КТ: планирование лучевой терапии
Возможность ПЭТ различить метаболически активную ткань опухоли от ателектаза, обструктивной пневмонии или фиброзных изменений имеет решающее значение в определении объема опухоли. Это очень полезно при планировании лучевой терапии, так как позволяет скорректировать форму и размер облучаемого объема тканей и уменьшить степень облучения непораженных опухолью органов (например, пищевода, сердца, спинного мозга), находящихся вблизи опухоли. Кроме того, использование ПЭТ значительно изменяет поле облучения по сравнению с КТ. Так, использование ПЭТ в дополнение к традиционным методам диагностики приводило к изменению объема облучаемых тканей более чем у 20% пациентов, и изменение стадии происходило в 20–50% случаев. В различных источниках описывается, что изменения планируемого целевого объема достигают 50% у пациентов с немелкоклеточным раком.
Контроль лечения и прогноз рака легкого
Василий Вишняков, врач-радиолог
При подготовке текста использованы материалы:
ТЕОРЕТИЧЕСКИЕ И КЛИНИКОМЕТОДИЧЕСКИЕ АСПЕКТЫ ПОЗИТРОННОЙ ЭМИССИОННОЙ ТОМОГРАФИИ
Резюме. Рассмотрены теоретические аспекты и роль современного метода лучевой диагностики – позитронной эмиссионной томографии. Описаны преимущества комбинированных диагностических аппаратов ПЭТ-КТ. Приведены протокол исследования и показания для проведения позитронной эмиссионной томографии с 18F-фтордезоксиглюкозой в онкологической практике. Проанализирована интерпретация результатов исследований.
В мире интенсивно развиваются и широко внедряются в клиническую практику томографические методы клинической диагностики. Среди них важное место занимают методы эмиссионной компьютерной томографии – однофотонная эмиссионная компьютерная томография (ОФЭКТ) и позитронная эмиссионная томография (ПЭТ) [1, 2].
ПЭТ основана на метке молекул, ответственных за специфические метаболические процессы, ультракороткоживущими радионуклидами (позитронными излучателями), позволяющими получить количественное изображение метаболических изменений. ПЭТ предоставляет общую и регионарную информацию о метаболизме клеток. Это очень чувствительный неинвазивный метод для изучения биохимических и молекулярных процессов в живом организме, не меняющий его физических свойств. При различных заболеваниях в большинстве случаев нарушения метаболизма предшествуют морфологическим, отображаемым такими структурными методами визуализации, как ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ).
Наиболее часто используют радиофармпрепарат (РФП) 18 F-фтордезоксиглюкозу ( 18 F-ФДГ). Он удобен как с точки зрения задач, которые решает ПЭТ с помощью этого препарата, так ис точки зрения удобного периода полураспада (110 мин). Данный РФП можно синтезировать в центре, где есть медицинский циклотрон, а затем транспортировать в близлежащие клиники, где он отсутствует, но есть позитронные эмиссионные томографы. Это так называемая сателлитная схема работы ПЭТ-центров. Благодаря ей ПЭТ становится более доступной и экономичной. Метод имеет огромное значение в онкологии (свыше 80% всех исследований), кардиологии, неврологии [3–5].
Принцип метода. Метод ПЭТ основан на использовании свойства ядерной нестабильности изотопов с избытком протонов. При переходе ядра в стабильное состояние оно излучает позитрон, пробег которого заканчивается столкновением с орбитальным электроном и аннигиляцией, в результате чего воз-
никают 2 гамма-кванта, движущиеся в диаметрально противоположных направлениях и имеющие энергию 511 кэВ. Гамма-кванты можно зафиксировать с помощью системы детекторов. Если 2 диаметрально противоположные детектора одновременно зарегистрируют сигнал, то есть основания утверждать, что точка аннигиляции находится на линии, соединяющей детекторы. Подключив детекторы к электронной схеме совпадений, срабатывающей только при появлении сигналов от обоих детекторов, можно зафиксировать положение этой линии. Для определения координат позитронизлучающего источника коллиматоры не нужны. Данное свойство ПЭТ получило название «электронной коллимации». Благодаря этому чувствительность ПЭТ на 1–2 порядка выше по сравнению с ОФЭКТ. Такой выигрыш в чувствительности позволяет добиться большей статистической достоверности при реконструкции изображений.
Подготовка пациента и протокол исследования. При проведении ПЭТ очень важен анамнез, который собирает перед процедурой врач, проводящий и интерпретирующий исследование, желательно с заполнением формы. При этом указывается:
первичный диагноз, дата;
первичное лечение – операция, химиотерапия, лучевая терапия, даты проведения;
стадия заболевания, степень злокачественности опухоли;
доили послеоперационная химиотерапия (да, нет), даты проведения;
доили послеоперационная лучевая терапия (да, нет), даты проведения;
при наличии рецидива указывают, выполнялась ли операция или другое лечение;
жалобы, симптомы в настоящее время;
результаты предыдущих лучевых и других инструментальных исследований (рентгенография, УЗИ, сцинтиграфия, КТ, МРТ), даты проведения;
уровень опухолевых маркеров;
сопутствующие и перенесенные заболевания;
семейный анамнез (онкологический);
лечение в настоящее время;
клиническая информация, которую требуется получить при проведении ПЭТ.
Исследование выполняется натощак (минимум через 6 ч после приема пищи, лучше – через 12 ч). Внутривенное введение глюкозы осуществляется не позже чем за 6 ч до начала процедуры. Пациентам запрещено пить напитки с сахаром (только вода). Необходимо проверить уровень глюкозы в крови перед инъекцией 18 F-ФДГ. Исследование можно проводить, если уровень глюкозы в крови менее 10 ммоль/л. В противном случае выполнение процедуры откладывают до снижения уровня глюкозы до вышеуказанных цифр. Если снижения уровня глюкозы не достигнуто, исследование должно быть перенесено. Больным сахарным диабетом не назначать пероральные гипогликемические препараты или инсулин перед введением 18 F-ФДГ (инсулин вводится не позже чем за 2 ч до введения РФП). Инъекция 18 F-ФДГ производится в расслабленном положении на удобном кресле. После этого пациенту можно читать, но нельзя разговаривать, ходить, жевать. Следует избегать любой мышечной активности. 18 F-ФДГ вводят внутривенно из расчета 3,5–7 МБк/кг массы тела больного. Исследование выполняют через 60–90 мин после введения РФП. Рекомендуется прием фуросемида (20 мг одновременно с введением РФП). Обязательна гидратация организма: 750 мл воды (до и после введения РФП). Необходимо частое опорожнение мочевого пузыря, особенно непосредственно перед укладкой на пози-
тронный эмиссионный томограф.
Интеграция ПЭТ и КТ в один аппарат (ПЭТ-КТ). Целесообразно использование комбинированных (гибридных) аппаратов, обеспечивающих анатомическую привязку, качественную и быструю трансмиссионную корректировку изображений [4]. Клинические данные свидетельствуют, что ПЭТ-КТ имеет преимущества перед ПЭТ и КТ, проведенными отдельно.
Исследование производится натощак.
Прием пациентом растворимого йодированного контраста (1000 мл) за 1 ч до процедуры. Дополнительно – 200 мл контраста непосредственно перед исследованием для контрастирования желудка и двенадцатиперстной кишки.
Пациент находится в лежачем расслабленном положении минимум 20 мин.
Опорожнение мочевого пузыря непосредственно перед исследованием.
Низкодозная КТ (от головы до дна таза). Данные трансмиссионных измерений используются для коррекции ослабления.
КТ с контрастным усилением. КТ-протоколы должны быть приспособлены к конкретным задачам.
Совмещение изображений аппаратными методами и интерпретация результатов.
18 F-ФДГ и его поведение в организме. Повышенный захват 18 F-ФДГ используется для диагностики, стадирования и выявления остаточной опухоли, а также рецидивов. Накопление РФП тесно связано с количеством клеток опухоли. Снижение захвата 18 F-ФДГ в процессе терапии отражает степень гибели опухолевых клеток. Количественное отражение захвата 18 F-ФДГ служит ранним и чувствительным маркером тумороцидного эффекта химиотерапии. Как не все злокачественные опухоли активно накапливают 18 F-ФДГ (например, низкий захват или отсутствие захвата почечноклеточным раком, некоторыми гистологическими формами рака желудка, муцинозной карциномой, низкозлокачественными саркомами и др.), так и не все анатомические зоны легко исследовать с помощью данного РФП (например, поиск метастазов в головном мозгу). Отмечается повышенный захват 18 F-ФДГ в доброкачественных очагах и при воспалении (с участием макрофагов). Распределение 18 F-ФДГ в организме соответствует его энергорежимам. Захват и накопле-
ние в норме – в мышцах, печени, жировой ткани. Различают фоновый метаболизм 18 F-ФДГ (соот-
ношение опухоль/здоровая ткань); физиологический гиперметаболизм (например, физические упражнения); патофизиологический метаболизм (воспаление). Стандартизированный показатель накопления (СПН) характеризует захват РФП в опухоли, нор-
мализованный по дозе и массе тела пациента.
СПН = (активность с поправкой на распад/см 3 опухоли)/(введенная активность/масса тела пациента (г)).
Для определения СПН производят построение зон интереса на нескольких кадрах и вычисляют показатель с помощью специального программного обеспечения.
Как указывалось выше, ПЭТ чаще всего применяют в онкологии.
Показания для проведения ПЭТ с 18 F-ФДГ.
В онкологии ПЭТ применяют для: определения распространенности процесса; оценки степени злокачественности; оценки эффективности лечения; своевременная диагностика рецидивов; прогностический тест.
Показания к проведению исследований отдельных органов и систем в онкологической практике:
Опухоли головы и шеи: дифференциальная диагностика злокачественного и доброкачественного процесса; выявление метастазов в регионарные лимфоузлы; выявление отдаленных метастазов; определение рецидива опухоли.
Опухоли щитовидной железы: дифференцированная карцинома — определение стадии опухоли; медуллярная карцинома — определение стадии опухоли. Опухоли неясной локализации (при выявленных отдаленных метастазах): локализация первичной
Рак легкого: немелкоклеточный рак – выявление метастазов в регионарные лимфоузлы, выявление отдаленных метастазов, определение рецидива опухоли; дифференциальная диагностика злокачественного и доброкачественного процесса при одиночном узле в легком.
Рак молочной железы: выявление метастазов в регионарные лимфоузлы; выявление отдаленных метастазов; оценка эффективности терапии.
Рак пищевода и желудка: выявление метастазов в регионарные лимфоузлы; выявление отдаленных метастазов.
Рак толстой кишки: выявление метастазов в регионарные лимфоузлы; выявление отдаленных метастазов; определение рецидива опухоли.
Рак поджелудочной железы: выявление отдаленных метастазов.
Лимфома (болезнь Ходжкина и неходжкинская лимфома): определение стадии заболевания; оценка эффективности терапии; определение рецидива. Меланома: выявление метастазов в регионарные лимфоузлы при индексе Бреслоу более 1,5 мм; выявление отдаленных метастазов при индексе Брес-
лоу более 1,5 мм; определение рецидива.
Опухоли костей и мягких тканей: дифференциальная диагностика доброкачественных и злокачественных опухолей; выявление отдаленных метастазов.
Опухоли мочеполовой системы: выявление отдаленных метастазов.
Опухоли головного мозга: уточнение опухолевого генеза очагового образования головного мозга; определение точных границ и размеров опухоли при неясных КТили МРТ-данных; определение степени злокачественности опухолей; выбор мишени для стереотаксической биопсии; оценка радикальности удаления опухоли; дифференциальная диагностика между продолженным ростом опухоли и лучевым поражением; мониторинг эффективности лучевого и химиолечения.
Анализ изображений. Большинство сложностей и ошибок ПЭТ-диагностики объясняются анатомической бедностью ПЭТ-изображений. Многие проблемы не возникают при применении ПЭТКТ, где имеет место надежное анатомическое сопоставление. Поэтому при интерпретации результатов ПЭТ-исследований необходимо иметь КТили МРТ-снимки для визуального сопоставления морфологической и функциональной информации. При визуальной оценке изображений полезно использовать простую 4-уровневую шкалу интенсивности накопления 18 F-ФДГ. Для этого отсечка цветовой шкалы устанавливается таким образом, чтобы изображение мозга выглядело черным, а фон – белым. Далее все очаги по степени выраженности гиперметаболизма подразделяются на 4 уровня: 1 – как в мягких тканях и неработающих мышцах; 2 – как в печени или чуть выше; 3 – между уровнем печени и мозга; 4 – как в мозге или выше. Очаги с уровнем 4 – первичная опухоль или мета-
стаз, 3 – скорее всего, первичная опухоль или метастаз (хотя возможен и очаг воспаления), 2 – скорее всего, очаг воспаления.
Для полуколичественного анализа используется стандартизированный показатель накопления, его позволяет рассчитывать программное обеспечение всех современных томографов. Также необходимо помнить и о локализациях физиологического накопления 18 F-ФДГ.
Физиологическое накопление 18 F-ФДГ.
Сердечно-сосудистая система. Даже при исследовании натощак у многих больных отмечается гомогенный или фрагментарный гиперметаболизм в миокарде, а иногда – малоинтенсивное накопление препарата в грудной аорте, что необходимо дифференцировать с воспалительными изменениями. Однако при наличии аортита степень накопления РФП все же должна быть выше. Время от времени отмечается физиологическое накопление препарата в артериях нижних конечностей. При начале сканирования ранее 30–40 мин после инъекции РФП существует вероятность определения накопления 18 F-ФДГ во многих крупных сосудах, обусловленного присутствием все еще большого количества радиоактивности в крови. Этой ошибки можно избежать, соблюдая протокол исследования.
Дыхательная система. Малоинтенсивные и часто двусторонние фокусы накопления препарата в корнях легких часто не означают метастазы в лимфоузлы, а являются результатом хронического бронхита, обычно у курильщиков. Однако именно подобные находки и представляют наибольшие диагностические трудности.
Мочеполовая система. Интенсивное накопление препарата отмечается в чашечно-лоханочной системе почек, мочеточниках, мочевом пузыре. По этой причине рекомендуется опорожнить мочевой пузырь перед исследованием, а сканирование начинать с области таза. Кроме того, необходимо помнить о возможности загрязнения паха радиоактивной мочой. Не всегда просто отдифференцировать точечную активность в мочеточнике от ретроперитонеального лимфоузла, а при анализе горячего пятна, прилежащего к мочевому пузырю, не следует забывать о возможности дивертикула мочевого пузыря.
Желудочно-кишечный тракт. Иногда отмечается накопление препарата в пищеводе, чаще в его дистальном отделе, что может быть обусловлено рефлюкс-эзофагитом, а также последствиями лучевой терапии. Часто возможны накопление в желудке, по-видимому, как результат перистальтической и мышечной активности. Однако наибольшие диагностические сложности представляет накопление препарата в кишечнике, особенно в толстом. Степень накопления может быть очень высокой, сравнимой с накоплением в злокачественной опухоли. Природа пока не ясна: перистальтика, высокая концентрация лейкоцитов в стенках кишечника, повы-
шенная секреция 18 F-ФДГ в стенку и просвет кишечника, различные воспалительные процессы. К сожалению, известные фармакологические или физиологические меры предотвращения такого накопления пока не эффективны, а отмечается это явление довольно часто. Требуется достаточный опыт, чтобы отдифференцировать физиологическое накопление в кишечнике от патологического очага. В некоторых случаях помогают отсроченные сканы, когда участки физиологического накопления через какой-то промежуток времени могут поменять локализацию.
Лимфатическая, кроветворная, эндокринная системы. Часто отмечается достаточно выраженное диффузное накопление препарата в пролиферирующем, активированном красном костном мозге у больных после химиотерапии. У детей и молодых пациентов можно видеть изображение тимуса, находящегося за грудиной и имеющего на аксиальных изображениях характерную V-образную форму. Неизмененные лимфоузлы не накапливают 18 F-ФДГ — накопление в них всегда соответствует патологическому очагу, но оно может быть вызвано как опухолевым процессом, так и воспалительным. Область, часто демонстрирующая высокий уровень метаболизма, обусловленный воспалением, – лимфатическое кольцо Вальдейера. Накопление в этой области расценивается как физиологическое, при необходимости дифференциации с опухолью принимается во внимание его симметричный характер.
Накопление 18 F-ФДГ в эндокринных органах
встречается редко. Щитовидная железа может иногда демонстрировать в норме умеренный гиперметаболизм. Если он не симметричный, то должен расцениваться как патологический очаг. Умеренно выраженное накопление РФП около гортани — достаточно частое явление, связанное с мышцами фонации. Анализ формы очагов накопления на аксиальных изображениях помогает отличить их от щитовидной железы. Яичники демонстрируют очень низкий уровень физиологического накопления (1-я степень), в отличие от яичек (2-я степень), где метаболизм в норме может быть выше. В молочных железах во время лактации уровень метаболизма бывает достаточ-
Околоушные слюнные железы могут характеризоваться очень высоким уровнем гиперметаболизма (3-я степень) без патологических изменений. Дифференциальная диагностика с опухолью основывается на однородном и равномерном характере накопления во всей железе, что редко бывает при опухоли.
Мышцы и суставы. Диффузное высокое накопление препарата в мышцах характерно для больных диабетом, поэтому важен контроль уровня сахара в крови перед исследованием. Очаговое накопление в работавшей незадолго до процедуры мышце может быть высоким (3-я степень) и послужить причиной диагностических ошибок. Именно поэтому важен отдых пациента перед исследованием и его правильная подго-
товка. Физиологический гиперметаболизм часто можно видеть в следующих мышцах: глазодвигательные; дна ротовой полости, в первую очередь подбородочноязычная, предохраняющая язык от западения у лежащего на спине человека; грудинно-ключично-сосцевидная; гортанные, участвующие в фонации.
Когда накопление РФП симметрично в обеих мышцах, их характерная анатомическая форма в сочетании с локализацией не создает трудностей в распознавании, но такое накопление отнюдь не правило: встречается и односторонний гиперметаболизм только в части мышцы.
Довольно часто отмечается накопление препарата в суставах. Оно может быть достаточно интенсивным (2-я степень), часто коррелирует с пожилым возрастом больных и, скорее всего, обусловлено воспалительными процессами.
Жировая и соединительная ткань. В настоящее время описано более 500 случаев интенсивного симметричного гиперметаболизма характерной формы и локализации в области шеи, плеч и вдоль позвоночника. До появления ПЭТ-КТ считалось, что это некая мышечная активность. И только точное сопоставление со структурными данными показало, что накопление РФП происходит в небольших островках жировой ткани, которую назвали «коричневый жир», или «американский жир». Этиология этого явления пока не известна. Такое накопление ни в коем случае нельзя путать с лимфоузлами, поскольку очень часто коричневый жир встречается у пациентов с лимфомами после нескольких курсов химиотерапии.
Головной мозг. В норме накопление 18 F-ФДГ в сером веществе головного мозга высокое, что делает крайне затруднительным верификацию горячих очагов на повышенном фоне. Кроме того, захват препарата метастазами при множественном поражении может варьировать у одного и того же больного, а также быть повышенным, сниженным или равным нормальной мозговой ткани. Многие исследователи отмечают сложности выявления метастазов в мозг и нередкие случаи диагностических ошибок. Лимитирующим фактором для чувствительности метода является разрешающая способность. Наиболее существенный недостаток ПЭТ с 18 F-ФДГ — недостаточная специфичность в результате близких значений скорости утилизации глюкозы в опухолях и некоторых незлокачественных образованиях
(воспалительных очагах и др.).
В клинической практике при использовании комбинированных аппаратов ПЭТ-КТ улучшается точность диагностики, особенно при применении высокоспецифических РФП (например, изотопов йода для поиска метастазов рака щитовидной железы и др.), когда отсутствует визуализация окружающих анатомических структур. При использовании комбинированных аппаратов можно с большей достоверностью провести контроль эффективности лечения, поскольку врач получает как морфологическую, так и функциональную информацию о состоянии регрессии опу-
холи и метастазов. При помощи ПЭТ-КТ выполняют минимальные интервенционные вмешательства, например биопсию гиперактивных лимфатических узлов, селективную биопсию жизнеспособных участков частично некротизированных опухолей и др. В этих условиях ПЭТ-КТ имеет особенную ценность при наличии большого количества морфологически видимых лимфатических узлов. Реконструированные данные ПЭТ-КТ могут использоваться при планировании лучевой терапии (топометричная подготовка пациентов, составление дозных анатомо-топографических карт). Анализируя изображения, врач получает комплексную информацию, благодаря чему повышается точность диагностики. Необходимо внедрять эти исследования в медицинскую практику для повышения эффективности диагностики злокачественных новообразований.
Коваль ГЮ, Мечев ДС, Сиваченко ТП та ін. Променева діагностика. / За заг ред: ГЮ Коваль / Київ: Медицина України, 2009; 1. 831 с.; 2. 679 с.
Радионуклидная диагностика. / Под ред: ЮБ Лишманова, ВИ Чернова / Томск: STT, 2004. 394 с.
Солодянникова ОИ, Сукач ГГ, Северин ЮП, Войт НЮ. Позитронная эмиссионная томография. Возможности клинического использования. В: Променева діагностика, променева терапія. Наук-практ конф «Актуальні питання використання сучасного рентгенологічного обладнання». Наукові статті та тези доповідей. Київ, 2007: 59–65.
Труфанов ГЕ, Рязанов ВВ, Дергунова НИ и др. Совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) в онкологии. Санкт-Петербург: ЭЛБИСПб, 2005. 105 с.
Clinical Nuclear Medicine. / Eds: G Cook, M Maisey, K Britton, V Chengazy / London: Hodder Arnold, 2006. 915 p.