Что такое гиперваскуляризация века
Многоликий АИТ (часть 1)
В структуре эндокринной патологии значительный удельный вес принадлежит аутоиммунной тиреопатологии, одним из основных представителей которой является аутоиммунный тиреоидит (АИТ).
Эта заметка скорее попытка для врачей описать варианты течения такого остающегося до сих пор загадочным заболеванием как АИТ. Это не руководство к действию для пациентов.
Сколько я не пыталась найти, ни в одном учебнике или монографии нет полного, подробного описания вариантов течения АИТ. Поэтому не все ещё понятно и раскрыто в этом процессе. Нет единой, общепринятой классификации АИТ. Патогенетическая терапия не разработана, а симптоматическая не имеет доказательной базы.
Проведу анализ вариантов течения АИТ, на основе наиболее известных классификаций и клинических наблюдений.
1. АИТ «классическая», критерии который были приняты ВОЗ в 2000 году, ранее была единственным определением АИТ: критерием диагноза АИТ могла быть только совокупность данных симптомов (отсутствие же одного из них делала диагноз АИТ предположительным.
УЗИ картина АИТ предполагает:
Косвенным признаком АИТ является увеличение лимфатических узлов у нижних полюсов обеих долей щитовидной железы.
Но, как показали годы наблюдений, в «чёткие» рамки только этой характеристики АИТ не укладывается, картина его течения оказалась более разнообразной.
2. По классификации национального руководства по эндокринологии под редакцией Дедова И.И.
Наиболее часто встречающиеся формы тиреоидита:
Сроки наступления/чередования фаз тоже могут быть разными. Например, начало послеродового тиреоидита может быть через полгода или даже через год после родов. а не через 3 месяца.
3. Более редкие формы АИТ:
Есть ещё классификация Davies T. 1993 года, по которой были попытки «состыковать» структурные аномалии и функцию щитовидной железы, которая более подробно отражает варианты течения АИТ.
Есть ещё УЗ- классификация АИТ по В.П. Харченко (1999 года) при которой АИТ бывает 4-х УЗИ – типов:
АИТ часто сопровождает «обычный» коллоидный узловой зоб, суть в том, что если при «изолированном» коллоидном зобе после оперативного удаления одной доли щитовидной железы функция оставшейся доли сохраняется и лечение гормонами не требуется, то сочетании с АИТ – вторая доля «не тянет» функцию удалённой доли и требуется, как правило, пожизненное лечение гормонами.
Реже встречается, гипотиреоз после таких операций транзиторный (преходящий), с последующим восстановлением в эутиреоз функции оставшейся доли без гормонозаместительной терапии (ГЗТ).
Не исключено сочетание АИТ с раком щитовидной железы, поэтому проведение пункции узлов (ТАБ = аспирационной тонкоигольной биопсии), так же необходимо при узлах более 1 см, как и при коллоидном зобе.
Причины появления АИТ до сих пор до конца не ясны, есть предположения о наследственной предрасположенности, особенно по женской линии, вирусной теории, теории переизбытка йода в окружающей среде, сочетании с другими иммунными заболеваниями, проблемами с экологией и т.д.
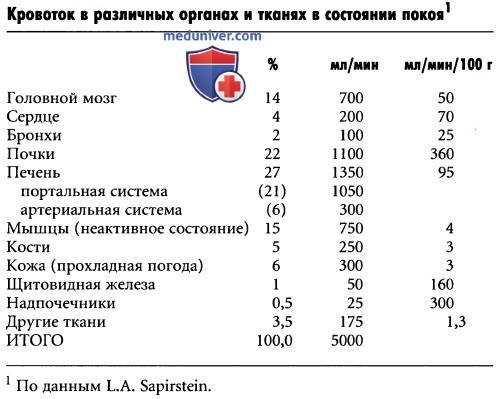
Что такое гиперваскуляризация века
Основным механизмом долговременной регуляции местного кровотока является изменение количества кровеносных сосудов в тканях. Так, длительная активизация метаболических процессов в данной ткани вызывает усиленную васкуляризацию ткани; если же уровень метаболизма снижается, количество кровеносных сосудов в ткани уменьшается.
Так происходит изменение васкуляризации тканей в зависимости от их метаболических потребностей. Эта реконструкция сосудистой системы развивается быстро (через несколько дней) у очень молодых животных, а также в быстрорастущих тканях зрелого организма (например, в рубцовой ткани или в растущей опухоли). И наоборот, в зрелых, высокодифференцированных тканях подобный процесс протекает медленно. Таким образом, на долговременную регуляцию кровотока требуется всего несколько дней у новорожденных, и более месяца — у лиц старшего возраста. Кроме того, результат перестройки сосудистого русла оказывается гораздо лучшим в молодых тканях. Так, у новорожденных сосудистая сеть способна практически полностью удовлетворять возросшие потребности тканей, в то время как в зрелых тканях васкуляризация зачастую намного отстает от потребностей ткани.
Роль кислорода в долговременной регуляции. Кислород имеет большое значение не только в быстрой краткосрочной регуляции местного кровотока, но и в долговременной регуляции. Одним из примеров является усиленная васкуляризация тканей у животных, обитающих на больших высотах, где содержание кислорода в атмосфере низкое. Другим примером может быть наблюдение за куриными зародышами, развивающимися в условиях гипоксии, у которых число кровеносных сосудов в 2 раза превышает нормальную плотность сосудов в тканях. Подобный эффект может иметь самые неблагоприятные последствия у недоношенных детей, помещенных в кислородную палатку с лечебными целями. Избыток кислорода немедленно прекращает рост сосудов сетчатки глаза у недоношенного ребенка и даже вызывает дегенерацию уже имеющихся сосудов. Затем, когда ребенка извлекают из кислородной палатки, начинается бурный рост сосудов в тканях глазного яблока, и кровеносные сосуды прорастают в стекловидное тело глаза, что приводит к слепоте. Такое явление называют ретроленталъной фиброплазией.
Формирование и рост новых кровеносных сосудов
Обнаружены более 10 факторов, которые усиливают рост новых кровеносных сосудов. Почти все они являются короткими пептидами, из них 3 фактора изучены лучше других: сосудистый эндотелиальный фактор роста, фактор роста фибробластов и ангиогенин. Каждый из них был выделен из тканей с неадекватно низким кровоснабжением. По-видимому, дефицит кислорода или питательных веществ (или и того, и другого) приводит к образованию сосудистых факторов роста (так называемых ангиогенных факторов).
В сущности, все ангиогенные факторы вызывают рост новых сосудов одинаковым способом: они способствуют появлению новых сосудов путем разрастания и ветвления старых сосудов. Первым этапом этого процесса является растворение базальной мембраны эндотелия в точке ветвления. Затем начинается быстрое образование новых эндотелиальных клеток, которые мигрируют через сосудистую стенку, образуя сосудистый росток, направленный к источнику ангиогенных факторов. Клетки продолжают быстро делиться и свертываются в трубку. Трубка соединяется с другой такой же, формирующейся от другого сосуда (артериолы или венулы), — и появляется капиллярная петля, в которой начинается кровоток. Если кровоток достаточно велик, в стенку нового сосуда переселяются гладкомышечные клетки, сосуд становится артериолой или венулой, а иногда и более крупным сосудом. Так, ангиогенез объясняет механизм, с помощью которого метаболические факторы тканей способствуют росту новых сосудов.
Ряд других веществ, таких как некоторые стероидные гормоны, оказывают на мелкие кровеносные сосуды противоположное действие. При этом происходит разрушение сосудистых клеток и исчезновение сосудов. Следовательно, количество кровеносных сосудов может уменьшаться, когда необходимость в них отпадает.
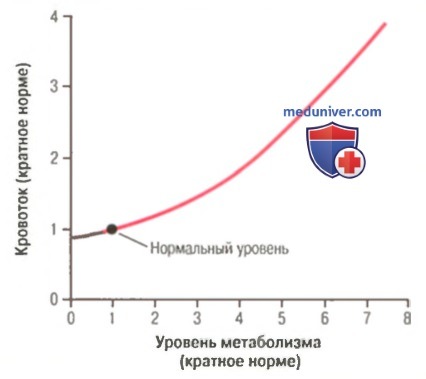
Васкуляризация зависит от максимальной потребности тканей в кровоснабжении, а не от среднего уровня кровоснабжения. Исключительно важной характеристикой долговременной регуляции кровоснабжения является то, что васкуляризация тканей обусловлена главным образом максимальным уровнем кровотока, необходимого тканям, а не средним уровнем их потребностей. Необходимость в таком максимальном кровотоке может возникать не более чем на несколько минут в день. Тем не менее, даже такой кратковременной предельной нагрузки достаточно для выделения эндотелиальных факторов роста в мышечной ткани, чтобы усилить ее васкуляризацию. Если этого не происходит, каждый раз, когда человеку приходится выполнять тяжелую физическую нагрузку, его мышцы не могут развить необходимую силу сокращения, т.к. они не получают достаточного количества кислорода и питательных веществ.
Однако если избыточная васкуляризация произошла, большая часть кровеносных сосудов обычно пребывает в состоянии сужения. Они открываются только под действием местных факторов, таких как недостаток кислорода, влияние сосудорасширяющих нервов и других факторов, свидетельствующих о необходимости резко увеличить кровоток.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Заворот века (энтропион)
Греческим термином «энтропион» в офтальмологии называют такое состояние века, при котором оно подворачивается складкой в направлении к глазному яблоку, – так, что ресничный край становится невидимым и оказывается в непосредственном контакте с роговицей и склерой. Как и обратное состояние «выворота века» (эктропиона), заворот обычно наблюдается на нижнем веке. Отчасти это объясняется разницей в анатомическом расположении верхнего и нижнего век, отчасти тем, что плотное «ребро жесткости» из хрящевидной ткани в верхнем веке крупнее и мощнее. Причины заворота могут быть различными, но в любом случае энтропион – состояние патологическое; это не только косметический дефект, но и специфическая симптоматика, обусловливающая необходимость консультации, диагностики и лечения.
Симптомы заворота века
Клиническая картина энтропиона определяется самим фактом контакта конъюнктивы (тонкой слизистой оболочки глаза) и роговицы (прозрачного «окошка» в склере, прикрывающего зрачок) с кожей и ресницами века. Очевидно, что такая ситуация абсолютно не предусмотрена нормальной анатомией глаза и означает, фактически, постоянную травматизацию нежных слизистых оболочек значительно более плотным «инородным» телом. При любом моргании, прикосновении или просто случайном усилении контакта – автоматически обостряются и связанные с энтропионом болезненные ощущения. Вообще, такая ситуация для органа зрения крайне дискомфортна и небезопасна.
Верхний слой любого волоса (в том числе и ресницы) состоит, как известно, из плотно пригнанных по типу кровельной черепицы кератиновых чешуек. При трении о тонкую слизистую оболочку ресничный «гребень», таким образом, всякий раз оставляет множество микротравм, словно пропахивая конъюнктиву. Ситуация быстро усугубляется, – по сути, с каждым морганием, – поверхность слизистой все больше изъязвляется, развивается воспаление. Субъективная симптоматика, посредством которой глаз «сообщает» мозгу о неблагополучии, практически одинакова при любых офтальмологических заболеваниях такого рода: усиленное слезотечение, невыносимый зуд, собственно боль, покраснение, светобоязнь – и мучительное ощущение инородного тела, причем достаточно большого и жесткого (это при том, что даже мельчайшая соринка в глазу воспринимается, как известно любому человеку, очень болезненно).
Кроме того, при завороте века грубо нарушается нормальный тракт циркуляции слезной жидкости: затрудняется ее дренирование через расположенные на конъюнктиве века «слезные точки» – отводные канальцы, сообщающиеся с назальной полостью. Слезная жидкость скапливается, нарушается баланс увлажнения и гидрофобного смазывания глазных оболочек (в норме состав слезной жидкости обеспечивает оптимальный водный режим, предотвращая как пересыхание, так и замокание).
Одной из серьезных опасностей, связанных с длительно существующем заворотом, является неоваскуляризация – реактивный процесс образования новых сосудистых сеток, которые могут прорастать в роговичную ткань, вызывать ее помутнение, лопаться, нарушать естественную глазную гемодинамику и т.п.; любая подобная интервенция в роговичную ткань, конечно, снижает ее прозрачность и, как следствие, общее качество зрения.
Наконец, наибольшую угрозу составляет то, что обширный участок изъязвленной, рыхлой, воспаленной, залитой слезной жидкостью поверхности глазного яблока является идеальным плацдармом для инфекции.
Занести ее можно каким угодно способом: при непроизвольном трении глаза пальцами, при пользовании полотенцем, при умывании, макияже и просто при контакте с воздухом. Это могут быть патогенные микроорганизмы любой природы, – вирусы, бактерии, грибковые культуры, внутриклеточные паразиты, – но в любом случае такая инфекция чрезвычайно опасна. При такой площади и условиях поражения инфекционная инвазия развивается остро, бурно и подчас стремительно, приобретая характер тотального деструктивного процесса и распространяясь, в частности, на глубинные структуры глазного дна. Следует отчетливо понимать, что исходом такой катастрофической динамики энтропиона может стать гнойное расплавление роговицы, воспаление сетчатки и диска зрительного нерва, панофтальмит (общее воспаление глазного яблока).
В свою очередь, это угрожает необратимой слепотой, а в наиболее тяжелых случаях – вынужденной энуклеацией (хирургическим удалением разрушающегося глаза). Выводы представляются слишком очевидными для того, чтобы подробно их аргументировать: при появлении первых же признаков или даже тенденции к «подвороту» века вовнутрь необходимо незамедлительно проконсультироваться с офтальмологом.
Виды заворота века
В офтальмологической практике клинические варианты энтропиона удобней всего классифицировать по этиологическому критерию. Как отмечалось выше, причины заворота века могут быть различными:
Диагностика
Энтропион достаточно легко обнаруживается при самостоятельном осмотре в зеркале – когда пациент пытается выяснить причину дискомфорта и увидеть раздражающее глаз инородное тело. Убедившись, что причина не в назойливой внешней соринке, а в завороте собственного века (и, как правило, встревожившись весьма необычным зрелищем в зеркале), большинство пациентов обращаются к офтальмологу. Первоочередной задачей врача в этом случае является установление этиопатогенетического механизма, приведшего к завороту, поскольку именно причиной энтропиона определяется дальнейшая терапевтическая стратегия.
Хирургическое лечение (операция блефаропластики)
При любых вариантах энтропиона консервативное лечение, к сожалению, эффекта не дает; физиотерапевтические или лазерные, – очень популярные на сегодняшний день, – процедуры также неэффективны. Естественная анатомия, динамика и кинематика века могут быть реконструированы только офтальмохирургическим вмешательством, – конкретные методики которого, впрочем, достаточно хорошо отработаны и не слишком сложны.
Так, при сенильном (старческом) энтропионе восстанавливают природную диспозицию века, плотное прилегание его внутренней конъюнктивы к поверхности глазного яблока, точное смыкание края с краем оппозиционного века при моргании и сне. Для этого приходится, в частности, сокращать объем растянувшейся и ослабевшей с возрастом кожи («подтягивать» ее, как принято говорить в эстетической хирургии).
Аналогичные задачи ставятся при рубцовом энтропионе, однако здесь необходимо, прежде всего, удалить разросшуюся соединительную (рубцовую) ткань.
Механический энтропион, поскольку он обусловлен опухолевым процессом, требует, в первую очередь, привлечения онколога, и косметические проблемы в этом случае отходят далеко на второй план. Лишь после специализированного онкологического лечения (будь то операция, химио- и/или радиотерапия) ставится вопрос о восстановлении нормальной статики и механики века.
Наконец, при врожденном завороте необходимо во всех деталях диагностировать ситуацию и в точности установить непосредственные причины энтропиона (аномальный размер глазного яблока, неправильная форма или гипертрофия самого века, патологическое развитие двигательных мышц, дефицит хрящевой ткани и мн.др.), после чего уже принимается решение и планируется реставрационная операция.
Цены на хирургическое лечение заворота века
Стоимость операции по исправлению заворота верхнего или нижнего века (блефаропластики) в нашем офтальмологическом центре составляет 21 000 рублей за 1 глаз.
Перед операцией необходима первичная консультация хирурга, на которой будет выбрана наиболее оптимальная тактика и назначена дата проведения, до которой пациент должен собрать все необходимые анализы (общий анализ крови и мочи, ВИЧ, RW, Гепатиты и т.д.).
Само хирургическое вмешательство проводится одним днем, без госпитализации и общего наркоза (под местной анестезией).
Другие варианты лечения энтропиона
При энтропионе любого типа симптоматически могут назначаться кератопротекторы – в дословном переводе это означает «защитники роговицы», что полностью соответствует задачам и действию таких лекарств: в первую очередь, необходимо в максимально возможной степени сохранить целостность, толщину и прозрачность роговичного слоя, не допустив его воспаления или изъязвления.
Для стимуляции естественных регенеративных (самовосстановительных) процессов применяются также эпителизирующие препараты. Лекарства обеих групп назначаются, как правило, в фармацевтической форме глазной мази или геля. В некоторых случаях в период подготовки к радикальному вмешательству рекомендуется носить специальную контактную линзу мягкого типа, которая служит роговой оболочке надежным механическим щитом от травмирующего контакта с ресницами.
В некоторых случаях при завороте нижнего века может применяться оттягивание с помощью пластыря, однако, это мера направлена на уменьшение травматизации роговицы и облегчение состояния пациента до момента блефаропластики.
Что такое гиперваскуляризация века
Учреждение Российской академии медицинских наук «НИИ глазных болезней РАМН», Москва
Учреждение Российской академии медицинских наук «НИИ глазных болезней» РАМН, Москва
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
Механизмы роговичной неоваскуляризации и современные возможности ее подавления
Журнал: Вестник офтальмологии. 2016;132(4): 81-87
Мамиконян В. Р., Пивин Е. А., Крахмалева Д. А. Механизмы роговичной неоваскуляризации и современные возможности ее подавления. Вестник офтальмологии. 2016;132(4):81-87.
Mamikonian V R, Pivin E A, Krakhmaleva D A. Mechanisms of corneal neovascularization and modern options for its suppression. Vestnik Oftalmologii. 2016;132(4):81-87.
https://doi.org/10.17116/oftalma2016132481-87
Учреждение Российской академии медицинских наук «НИИ глазных болезней РАМН», Москва
Под воздействием патологических факторов баланс антиангиогенных и проангиогенных факторов может нарушаться, что может приводить к патологическому врастанию сосудов в роговицу. Эти новообразованные незрелые сосуды имеют недостаточную структурную организацию, повышенную проницаемость и могут приводить к отеку, отложению липидов и помутнению роговицы. Кроме того, известно, что как предсуществующая, так и послеоперационная роговичная неоваскуляризация (РНВ) может способствовать развитию иммунной реакции. Подавление неоваскуляризации роговицы может снизить риск отторжения кератотрансплантата. Для определения новых стратегических направлений в борьбе с РНВ необходимо понимание этиологии патологического ангиогенеза, его роли в реакции трансплантационного иммунитета, а также механизмов действия существующих методов лечения.
Учреждение Российской академии медицинских наук «НИИ глазных болезней РАМН», Москва
Учреждение Российской академии медицинских наук «НИИ глазных болезней» РАМН, Москва
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
Экстрацеллюлярный матрикс, расположенный между коллагеновыми волокнами и кератоцитами, состоит преимущественно из воды, протеогликанов, гликопротеидов и неорганических солей. При взаимодействии с коллагеновыми волокнами протеогликаны за счет своей структуры, представленной белковым ядром и боковыми цепями сульфатированных гликозаминогликанов, обеспечивают архитектонику роговичного матрикса. Гидрофильные свойства гликозаминогликанов обусловливают способность стромы удерживать воду [6].
Эпителий и эндотелий также играют чрезвычайно важную роль в поддержании прозрачности роговицы. Благодаря барьерным функциям и наличию активных насосных механизмов, эндотелий поддерживает роговицу в относительно дегидратированном состоянии, предотвращая развитие ее отека и помутнения [4, 7].
При врастании новообразованных сосудов нарушается нормальная ультрастуктура роговицы, что может привести к нарушению ее прозрачности [8, 9]. Оптические свойства роговицы могут быть снижены посредством 5 возможных механизмов: 1) нарушение прозрачности, обусловленное непосредственно наличием циркулирующих клеток крови в сосудах; 2) нерегулярная архитектура стенок сосудов, индуцирующая аберрации высших порядков; 3) нарушение расположения архитектоники стромальных коллагеновых волокон, расположенных между кровеносными сосудами; 4) ликедж жидкости, отек и отложение липидов в ткани, окружающие проницаемые кровеносные сосуды; 5) иррегулярность глазной поверхности [10].
Иммунопривилегированность
Особое взаимодействие глаза с иммунной системой известно под термином «иммунопривилегированность». Впервые этот феномен был описан в 1940 г. Sir Peter Medawar, который отметил, что помещенный в переднюю камеру глаза кожный аллотрансплантат не провоцировал возникновение иммунного конфликта [11, 12]. Позже J. Streilein предположил, что это происходит не только из-за «иммунологического невежества», обусловленного наличием анатомических клеточных и молекулярных барьеров, но и благодаря наличию механизмов активного иммунного подавления [13].
Механизмы активного иммунного подавления играют важную роль и осуществляются посредством экспрессии на тканях глаза таких иммуносупрессивных факторов, как Fas-лиганд, TGF-β и др. [14, 16, 17].
Угнетение механизмов ACAID может провоцировать реакцию отторжения роговичного аллотрансплантата. Более того, индукция ACAID путем введения аллоантигенных клеток перед операцией трансплантации роговицы улучшала результаты последней в эксперименте на животных [12].
Механизмы ангиогенеза
Несмотря на то что роговица является иммунопривилегированной тканью, неоваскуляризация, воспаление, или травма могут привести к срыву этого защитного механизма [17].
Проангиогенные факторы
Изначально VEGF был идентифицирован как фактор проницаемости сосудов, однако позже было обнаружено его влияние на митоз эндотелиальных клеток и ангиогенез, что открыло новые горизонты в понимании патогенеза различных патологических процессов [2].
Взаимодействие VEGF со специфичным рецептором приводит к стимуляции миграции и пролиферации сосудистых эндотелиальных клеток, а также дилатации сосудов и увеличению их проницаемости [1, 17, 22].
В то время как VEGF-А признается ключевым медиатором гемангиогенеза, VEGF-С и VEGF-D считаются главными стимуляторами лимфангиогенеза [21] (однако последние исследования указывают на активное участие в регуляции лимфангиогенеза и VEGF-А) [1, 23].
Воспаление и гипоксия индуцируют продукцию VEGF-А различными клетками, в том числе перицитами и гладкомышечными клетками стенки кровеносных сосудов, макрофагами и Т-клетками. Кроме того, VEGF служит хемоаттрактантом для клеток воспаления (например, макрофагов), которые продуцируют дополнительные проангиогенные факторы [23].
Провоспалительные цитокины, такие как IL-1, IL-6, TNF, TGF-β, способствуют активации воспалительных клеток, которые являются богатыми источниками VEGF [3].
Ингибиторы ангиогенеза
Фактор пигментного эпителия (PEDF) осуществляет антиангиогенный, иммуномодуляторный и нейротрофический эффекты [24]. Его антиангиогенная активность осуществляется посредством подавляющего влияния на миграцию и пролиферацию клеток, также он индуцирует апоптоз эндотелиальных сосудистых клеток [3, 8]. PEDF был выделен в эпителии и эндотелии роговицы, а также в составе слезной жидкости. Его экспрессия считается важным компонентом ангиогенной привилегированности [24].
Помимо «ангиогенного переключателя» и активации проангиогенных молекул, главными ступенями так называемого «ангиогенного каскада» являются: дилатация существующих сосудов, активация сосудистых эндотелиальных клеток, гиперпроницаемость посткапиллярных венул и дестабилизация сосудов, локальная протеолитическая деградация базальной мембраны, ремоделирование экстрацеллюлярного матрикса в ответ на активацию матриксных металлопротеиназ, миграция эндотелиальных клеток и их пролиферация, образование сосудистых трубок и их слияние с образованием сосудистых петель, рекрутирование перицитов и гладкомышечных клеток и созревание сосудов [8, 10, 26].
Заболевания роговицы, сопровождаемые патологическим ангиогенезом
Неоваскуляризация роговицы является потенциальным осложнением многочисленных патологических состояний, включающих инфекции, травмы, хирургические вмешательства, аутоиммунные заболевания [2, 25, 27], лимбальную недостаточность, неоплазии, дистрофии роговицы, а также гипоксию, ассоциированную с ношением контактных линз [25, 27].
Несмотря на прогресс современной медицины, трахома остается ведущей причиной слепоты. По данным ВОЗ, в мире зарегистрировано 146 млн случаев заболевания Chlamydia trachomatis, из них 5,9 млн угрожает слепота [3]. Рецидивирующие эпизоды трахомы поражают конъюнктиву и веки, приводя к рубцовым осложнениям (трихиаз, энтропион). Постоянное травмирование эпителия ресницами может приводить к абразии роговицы, ее изъязвлению, неоваскуляризации и рубцеванию [28].
Бактериальные и грибковые кератиты могут стать причиной развития неоваскуляризации роговицы. Также РНВ развивается при дегенеративных процессах, таких как краевая дегенерация Терьена, птеригиум и др. [1].
Птеригиум представляет собой конъюнктивально-роговичную дегенерацию, сопровождаемую ростом фиброваскулярной ткани поверх роговицы. Распространение птеригиума в оптическую зону может угрожать зрению и требует хирургического лечения. Рецидивирующий характер течения заболевания и повторные операции могут приводить к истончению роговицы, астигматизму [29, 30].
Травмы органа зрения также способны спровоцировать рост новообразованных сосудов. Особенно опасны ожоги роговицы, которые зачастую сопровождаются лимбальной недостаточностью. Нарушение барьерной функции лимба приводит к конъюнктивизации поверхности роговицы с развитием массивной неоваскуляризации [31].
Классификация роговичной неоваскуляризации
По классификации Azar 2006 г., учитывающей глубину залегания врастающих сосудов, роговичную неоваскуляризацию (РНВ) можно разделить на 3 клинические группы:
Отечественными офтальмологами используется сходная классификация, учитывающая 4 степени тяжести неоваскулярного процесса:
Согласно клиническим наблюдениям, при РНВ I-II степени эффективна аргоновая лазерная коагуляция. При этом необходимо прижигать все вросшие сосуды, так как, по данным флюоресцентной ангиографии, в случае коагуляции только артерий, в венах обнаруживается обратный ток крови [33].
Трансплантация роговицы
Пересадка роговицы является одной из самых успешных операций в трансплантологии. Ежегодно в мире выполняется более 65 000 кератопластик [16, 17]. Даже без применения HLA-типирования и системной иммуносупрессии прозрачное приживление трансплантата достигается в 90% случаев в группе кератопластики низкого риска [23].
Главной причиной неудачного исхода трансплантации роговицы является иммунное отторжение [35], риск развития которого может возрастать более чем в 2 раза и достигать 32% при врастании в роговицу кровеносных и лимфатических сосудов [16, 24]. Другими факторами риска являются наличие реакции отторжения трансплантата в анамнезе, ослабление швов, большой размер трансплантата и его близкое к лимбу расположение [36].
Имеются данные, что селективная замена пораженных слоев роговицы уменьшает частоту отторжения трансплантата [8, 37-40]. Однако послойная кератопластика является технически более сложной и выполнение ее невозможно при поражении всех слоев роговицы, поэтому сквозная кератопластика на данный момент занимает центральное место в хирургии роговицы.
Редукция неоваскуляризации может минимизировать иммуновоспалительный ответ после кератотрансплантации и повысить частоту прозрачного приживления трансплантата [27, 41].
При типичном иммунном ответе лимфатические сосуды играют роль афферентного звена (сенсибилизация) иммунорефлекторной дуги, позволяя антиген-презентирующим клеткам попасть в регионарные лимфатические узлы, где происходит созревание аллореактивных эффекторных Т-клеток [16, 17]. Кровеносные сосуды служат эфферентным звеном (отторжение), предоставляя эффекторным клеткам доступ к органу-мишени [1].
Лечение РНВ
Традиционными методами профилактики и лечения РНВ является применение нестероидных противовоспалительных средств (НПВС) и кортикостероидов (КС), механизмы действия которых осуществляются посредством подавления воспаления. НПВС ингибируют синтез простагландинов, стимулирующих ангиогенез. КС подавляют ангиогенез, угнетая процессы рекрутирования воспалительных клеток, провоспалительных цитокинов (например, ИЛ-1, ИЛ-6), а также блокируя высвобождение арахидоновой кислоты [1, 26, 42].
КС могут быть эффективны в подавлении индуцированной воспалением неоваскуляризации. Однако зачастую эффективность этих средств ограничена. Также к минусам применения КС можно отнести серьезные побочные эффекты: катаракту, вторичную глаукому, истончение роговицы и присоединение оппортунистических инфекций [27].
На сегодняшний день одним из эффективных и доступных методов воздействия на неоваскуляризацию роговицы является аргоновая лазерная коагуляция (ЛК) новообразованных сосудов [41, 42], эффективность которой, по данным разных авторов, может достигать 80% [42]. Для этих целей с определенным успехом использовались лазеры с различной длиной волны. Однако в ответ на лазерное воздействие могут высвобождаться проангиогенные факторы, что приводит к реканализации коагулированных новообразованных сосудов и формированию коллатералей. Комбинированное использование с ингибиторами ангиогенеза (например, анти-VEGF) может помочь избежать этих осложнений [43].
Ингибиторы VEGF
Являясь ключевым медиатором ангиогенеза, VEGF служит основной терапевтической мишенью в современных исследованиях медикаментозного лечения патологического ангиогенеза [47].
Интравитреальное применение моноклональных антител к VEGF получило широкое применение в терапии ретинальной патологии [5, 10, 48]. На данный момент роговичная васкуляризация не является официально зарегистрированным показанием для применения анти-VEGF-препаратов, однако их применение «off label», т. е. вне зарегистрированных показаний, при данной патологии является патогенетически обоснованным.
На данный момент основными коммерчески доступными представителями группы ингибиторов VEGF являются бевацизумаб и ранибизумаб [3].
Бевацизумаб является полноразмерным гуманизированным рекомбинантным моноклональным гиперхимерным антителом с мол. массой 149 kD, которое селективно связывается с биологически активным VEGF и нейтрализует его [44]. Препарат препятствует связыванию VEGF с его рецепторами на поверхности эндотелиальных клеток, что приводит к предотвращению и редукции васкуляризации [44, 49].
Ранибизумаб является антигенсвязывающим Fab-фрагментом гуманизированного моноклонального химерного антитела, имеет мол. массу 48 kD. Связывает и ингибирует все изоформы VEGF [1].
Экспериментальная и клиническая апробация анти-VEGF-препаратов в лечении неоваскуляризации роговицы подтвердила их относительную безопасность и высокую эффективность, что проявлялось в снижении калибра и количества сосудов, уменьшении зоны инвазии новообразованных сосудов в роговицу [35, 46, 50, 51]. Препараты применялись в виде инстилляций [35, 41, 46, 50], субконъюнктивальных [41, 51, 52], интрастромальных, интракамеральных и интравитреальных инъекций [1, 3]. При сравнительном анализе эффективности применения местной и субконъюнктивальной форм введения оба способа показали антиангиогенную эффективность, однако местное применение требовало более высоких концентраций препарата [1]. Также в экспериментальной модели применения бевацизумаба при СКП высокого риска с сопутствующей васкуляризацией М. Dastjerdi и соавт. [53] выявили, что только субконъюнктивальное введение способствовало приживлению трансплантата в 33% случаев, в то время как инстилляции препарата и отсутствие терапии в контрольной группе приводили к отторжению трансплантата в 100% случаев.
Клиническая апробация использования инъекций ингибиторов VEGF в профилактике отторжения трансплантата показала многообещающие результаты: 85-100% кератотрансплантатов оставались прозрачными и аваскулярными, несмотря на высокий риск развития иммунной реакции [1, 52, 54-56].
Неоваскуляризация характерна для прогрессирования птеригиума. По сравнению с нормальной конъюнктивой уровни VEGF при птеригиуме повышены, что может указывать на его роль в патогенезе заболевания. Применение анти-VEGF-препаратов может способствовать снижению уровня рецидивирования [30].
Побочные эффекты анти-VEGF-препаратов
Применение бевацизумаба ассоциировано с повышенным риском развития эпителиопатии и эпителиальных дефектов [1, 2, 41, 47]. Предположительно, возникновение их связано с нарушением адгезии между эпителием и базальной мембраной [1]. Факторами, повышающими вероятность возникновения данных осложнений, являются: 1) применение бевацизумаба в концентрации, превышающей 1%; 2) продолжительность лечения более 1 мес; 3) назначение пациентам с предсуществующими эпителиальными дефектами или нейротрофической кератопатией [3, 57].
Применение комбинации бевацизумаба с доксициклином, который помимо антибактериальной активности является ингибитором ММР [15], показало увеличение антиангиогенного эффекта [31, 58-60]. Кроме того, доксициклин предотвращал возникновение такого известного побочного эффекта местного применения бевацизумаба, как возникновение эрозий роговицы и их замедленное заживление 59. Это указывает на возможную роль ММР в возникновении побочных эффектов.
Имеются сообщения о единичных случаях развития истончения роговицы [2, 3] и ее расплавления [47]. Расплавление трансплантата или его ложа в нескольких случаях было ассоциировано с применением препарата у пациентов с щелочным ожогом и лимбальной недостаточностью в анамнезе [47, 61]. В связи с этим следует проявлять особую осторожность при назначении анти-VEGF-препаратов пациентам с дефектами эпителия, лимбальной недостаточностью и нейротрофической кератопатией [57].
Комбинированная терапия
Некоторые случаи демонстрируют резистентность к анти-VEGF-терапии. Причинами рефрактерности к лечению может быть применение анти-VEGF препаратов в поздних фазах ангиогенеза, когда просвет сосуда уже сформирован и перициты создают плотные контакты, в результате потребность в VEGF для функционирования сосудов снижается [62, 63]. Другим механизмом рефрактерности может быть регуляция ангиогенеза через альтернативные пути посредством активации других стимуляторов ангиогенеза [64]. В связи с этим предпринимаются попытки комбинированного применения анти-VEGF-препаратов с методами, направленными на облитерацию просвета новообразованных сосудов (ЛК, ФДТ) [42, 44, 64], а также с цитостатиками [65]. Наиболее часто применяемым в офтальмологии цитостатиком является циклоспорин, который избирательно блокирует пролиферативную активность Т-лимфоцитов [66].
Заключение
Роговичная неоваскуляризация является потенциальным осложнением различных воспалительных и дистрофических заболеваний роговицы. Главными медиаторами ангиогенеза и основной мишенью в лечении РНВ на настоящий момент признаны факторы из семейства VEGF, принимающие участие как в гемангиогенезе, так и в лимфангиогенезе. Резистентные к анти-VEGF-терапии формы неоваскуляризации роговицы требуют применения сочетанных методик борьбы с неоваскуляризацией.
При наличии сформированных сосудов крупного калибра представляется перспективным применение лазеркоагуляции новообразованных сосудов роговицы в комбинации с субконъюнктивальным введением анти-VEGF-препарата. Сочетание антиангиогенного и вазообструктивного подходов может обеспечить синергидное антиангиогенное воздействие. Применение данной методики перед выполнением кератопластики высокого риска может снизить риск возникновения реакции отторжения трансплантата.
Для оценки эффективности и целесообразности клинического применения комбинированной методики с целью профилактики реакции отторжения трансплантата требуются рандомизированные клинические исследования на достаточном клиническом материале.