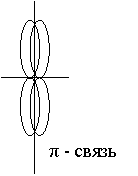
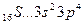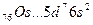Что такое насыщаемость связи в химии
Лекции по химии
вторник, 20 марта 2012 г.
Насыщаемость и направленность
Насыщаемость
Максимальная ковалентность у элементов 2 го периода равна 4, т.к. на внешнем энергетическом уровне у них находятся 4 орбитали (s и p) и может разместиться максимум 8 электронов 2s 2 2p 6 (2+6=8) 8:2=4.
Атомы элементов 3 го периода и т.д. имеют и d-орбитали и ковалентность может = 9; 3s 2 3p 6 3d 10 (2+6+10=18); 18:2=9.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей называется насыщаемостью.
Направленность
Свойства молекулы, её способность вступать в химическое взаимодействие с другими молекулами (реакционная способность) зависят не только от прочности химических связей в молекуле, но в значительной мере и от её пространственного строения. Этот раздел химии называется стереохимией.
Образование ковалентной связи осуществляется за счет перекрывания электронных облаков взаимодействующих атомов. При этом область перекрывания располагается в определенном направлении к атомам. Иначе говоря обладает направленностью.
Например, молекула водорода.
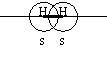
В образовании σ связи могут принимать участие и р-электроны. Например: HF


Пи связь и сигма неравноценны, т.к. энергия из разрыва различна.
Насыщаемость ковалентной связи



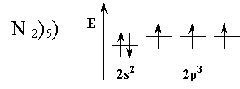
Насыщаемость ковалентной связи (валентные возможности атома, максимальная валентность) характеризует способность атомов участвовать в образовании определенного ограниченного числа ковалентных связей и определяет стехиометрический состав молекул. Насыщаемость – особенность образования ковалентных связей прежде всего по обменному механизму. Это означает, что если атом имеет некоторое количество неспаренных электронов в нормальном или возбужденном состоянии, то все они участвуют в образовании химических связей. Например, атом азота имеет 3 неспаренных электрона, а водород – 1. Принцип насыщаемости указывает на то, что устойчивым соединением должно быть NH3, а не NH2, NH или NH4.
Согласно обменному механизму метода ВС каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода ВС считают число неспаренных электронов у атома в основном или возбужденном состоянии атома. Это неспаренные электроны внешних оболочек у s- и р – элементов, внешних и предвнешних оболочек у d – элементов, предвнешних и предпредвнешних оболочек у f – элементов.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары (или пар) электронов и переходе одного электрона (или нескольких электронов, равных числу разъединенных пар) в свободную орбиталь (орбитали) того же энергетического уровня. Перевод электрона с одного подуровня на другой осуществляется за счет энергии, получаемой извне. Эти затраты компенсируются энергией, выделяемой при образовании связей. В результате этого число неспаренных электронов в атоме и его валентность увеличиваются.
Например, валентность элементов главной подгруппы I группы равна единице, так как на внешнем уровне атомы этих элементов имеют один электрон:
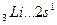

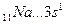

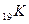
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем уровне нет неспаренных электронов:
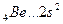


Однако в соединениях он проявляет валентность, равную 2. Это объясняется тем, что, вступая в химическое соединение, атом бериллия переходит в возбужденное состояние 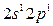
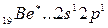


Энергия возбуждения бериллия из состояния 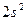
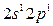
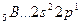


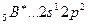


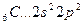


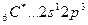


Возбуждение азота, кислорода и фтора в пределах второго квантового уровня не может привести к увеличению числа неспаренных электронов из-за отсутствия свободных атомных орбиталей во втором уровне:
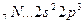



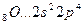


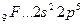


Возбуждение электронов в этих атомах, связанное с их перемещением на следующий квантовый уровень, требует значительно большей энергии, чем та, которая выделится при образовании дополнительных связей.
В то же время элементы третьего периода – фосфор, сера и хлор могут проявлять переменную валентность, в т. ч. и соответствующую номеру группы периодической системы. Рассмотрим серу – аналог кислорода:

За счет внешних s – и р – орбиталей атомы не могут иметь валентность, превышающую 4, поскольку при образовании четырёх связей атом окружён восемью электронами. Валентность выше четырёх может проявляться только при участии d – или f – орбиталей. Следовательно, возникновение устойчивого валентного состояния атома выше четырёх можно ожидать только для элементов, начиная с IV периода периодической системы.
Следует отметить, что у атомов большинства d- и f – элементов на внешних оболочках в основном состоянии нет неспаренных электронов, поэтому их валентность в основном состоянии равна нулю, несмотря на то, что на предвнешних d – и f – подоболочках имеются неспаренные электроны. Последние не могут образовывать электронные пары с электронами других атомов, так как закрыты электронами внешней оболочки. При возбуждении атома распаренные электроны внешней оболочки вступают в химическую связь и открывают внутренние электронные оболочки. Например, валентность железа в основном состоянии равна нулю:
26Fe 
В возбужденном состоянии происходит разъединение 4s – пары электронов:
26Fe * 
У осмия при возбуждении могут разъединяться не только внешние 6s – электроны, но и предвнешние 5d – электроны, поскольку в пятой оболочке имеется еще 5f – подоболочка со свободными орбиталями, поэтому максимальная валентность осмия равна восьми:

76Os * 
Таким образом, одни атомы проявляют постоянную валентность, тогда как другие – переменную. Постоянную валентность проявляют s – элементы, а переменную – р- и d- элементы(исключение составляют N, O, F; они в пределах 2-го энергетического уровня не имеют свободных атомных орбиталей). Низшая валентность проявляется в невозбужденном состоянии, высшая – в наиболее возбужденном. Для большинства атомов высшая валентность равна номеру группы.
За счет донорно – акцепторного механизма увеличиваются валентные возможности атомов (за счет наличия вакантных орбиталей и неподеленных электронных пар). Так, в рассмотренном в разделе 3.3 примере атом азота в ионе NH4 + (аммония) имеет валентность, равную четырем.
Таким образом, суммарная валентность элемента равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных по донорно-акцепторному механизму
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.