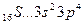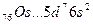Что такое насыщаемость в химии
Лекции по химии
вторник, 20 марта 2012 г.
Насыщаемость и направленность
Насыщаемость
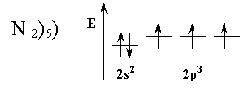
Максимальная ковалентность у элементов 2 го периода равна 4, т.к. на внешнем энергетическом уровне у них находятся 4 орбитали (s и p) и может разместиться максимум 8 электронов 2s 2 2p 6 (2+6=8) 8:2=4.
Атомы элементов 3 го периода и т.д. имеют и d-орбитали и ковалентность может = 9; 3s 2 3p 6 3d 10 (2+6+10=18); 18:2=9.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей называется насыщаемостью.
Направленность
Свойства молекулы, её способность вступать в химическое взаимодействие с другими молекулами (реакционная способность) зависят не только от прочности химических связей в молекуле, но в значительной мере и от её пространственного строения. Этот раздел химии называется стереохимией.
Образование ковалентной связи осуществляется за счет перекрывания электронных облаков взаимодействующих атомов. При этом область перекрывания располагается в определенном направлении к атомам. Иначе говоря обладает направленностью.
Например, молекула водорода.
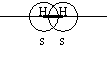
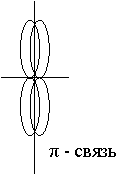
В образовании σ связи могут принимать участие и р-электроны. Например: HF


Пи связь и сигма неравноценны, т.к. энергия из разрыва различна.
Насыщаемость ковалентной связи



Насыщаемость ковалентной связи (валентные возможности атома, максимальная валентность) характеризует способность атомов участвовать в образовании определенного ограниченного числа ковалентных связей и определяет стехиометрический состав молекул. Насыщаемость – особенность образования ковалентных связей прежде всего по обменному механизму. Это означает, что если атом имеет некоторое количество неспаренных электронов в нормальном или возбужденном состоянии, то все они участвуют в образовании химических связей. Например, атом азота имеет 3 неспаренных электрона, а водород – 1. Принцип насыщаемости указывает на то, что устойчивым соединением должно быть NH3, а не NH2, NH или NH4.
Согласно обменному механизму метода ВС каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода ВС считают число неспаренных электронов у атома в основном или возбужденном состоянии атома. Это неспаренные электроны внешних оболочек у s- и р – элементов, внешних и предвнешних оболочек у d – элементов, предвнешних и предпредвнешних оболочек у f – элементов.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары (или пар) электронов и переходе одного электрона (или нескольких электронов, равных числу разъединенных пар) в свободную орбиталь (орбитали) того же энергетического уровня. Перевод электрона с одного подуровня на другой осуществляется за счет энергии, получаемой извне. Эти затраты компенсируются энергией, выделяемой при образовании связей. В результате этого число неспаренных электронов в атоме и его валентность увеличиваются.
Например, валентность элементов главной подгруппы I группы равна единице, так как на внешнем уровне атомы этих элементов имеют один электрон:
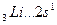

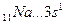

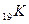
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем уровне нет неспаренных электронов:
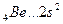


Однако в соединениях он проявляет валентность, равную 2. Это объясняется тем, что, вступая в химическое соединение, атом бериллия переходит в возбужденное состояние 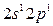
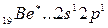


Энергия возбуждения бериллия из состояния 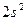
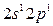
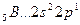


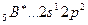


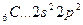


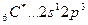


Возбуждение азота, кислорода и фтора в пределах второго квантового уровня не может привести к увеличению числа неспаренных электронов из-за отсутствия свободных атомных орбиталей во втором уровне:
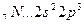



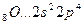


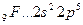


Возбуждение электронов в этих атомах, связанное с их перемещением на следующий квантовый уровень, требует значительно большей энергии, чем та, которая выделится при образовании дополнительных связей.
В то же время элементы третьего периода – фосфор, сера и хлор могут проявлять переменную валентность, в т. ч. и соответствующую номеру группы периодической системы. Рассмотрим серу – аналог кислорода:

За счет внешних s – и р – орбиталей атомы не могут иметь валентность, превышающую 4, поскольку при образовании четырёх связей атом окружён восемью электронами. Валентность выше четырёх может проявляться только при участии d – или f – орбиталей. Следовательно, возникновение устойчивого валентного состояния атома выше четырёх можно ожидать только для элементов, начиная с IV периода периодической системы.
Следует отметить, что у атомов большинства d- и f – элементов на внешних оболочках в основном состоянии нет неспаренных электронов, поэтому их валентность в основном состоянии равна нулю, несмотря на то, что на предвнешних d – и f – подоболочках имеются неспаренные электроны. Последние не могут образовывать электронные пары с электронами других атомов, так как закрыты электронами внешней оболочки. При возбуждении атома распаренные электроны внешней оболочки вступают в химическую связь и открывают внутренние электронные оболочки. Например, валентность железа в основном состоянии равна нулю:
26Fe 
В возбужденном состоянии происходит разъединение 4s – пары электронов:
26Fe * 
У осмия при возбуждении могут разъединяться не только внешние 6s – электроны, но и предвнешние 5d – электроны, поскольку в пятой оболочке имеется еще 5f – подоболочка со свободными орбиталями, поэтому максимальная валентность осмия равна восьми:

76Os * 
Таким образом, одни атомы проявляют постоянную валентность, тогда как другие – переменную. Постоянную валентность проявляют s – элементы, а переменную – р- и d- элементы(исключение составляют N, O, F; они в пределах 2-го энергетического уровня не имеют свободных атомных орбиталей). Низшая валентность проявляется в невозбужденном состоянии, высшая – в наиболее возбужденном. Для большинства атомов высшая валентность равна номеру группы.
За счет донорно – акцепторного механизма увеличиваются валентные возможности атомов (за счет наличия вакантных орбиталей и неподеленных электронных пар). Так, в рассмотренном в разделе 3.3 примере атом азота в ионе NH4 + (аммония) имеет валентность, равную четырем.
Таким образом, суммарная валентность элемента равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных по донорно-акцепторному механизму
Насыщение (химия)
В химии, насыщение имеет пять различных значений:
Полезное
Смотреть что такое «Насыщение (химия)» в других словарях:
Насыщенность — в теории цвета интенсивность определённого цветового оттенка. Насыщенность цвета преобразование цвета при операциях преобразования цветовых схем Насыщенность арифметическая, в арифметике, разновидность арифметики, при которой все… … Википедия
ЛАЗЕР — (оптический квантовый генератор), устройство, генерирующее когерентные эл. магн. волны за счёт вынужденного испускания или вынужденного рассеяния света активной средой, находящейся в оптич. резонаторе. Слово «Л.» аббревиатура слов англ. выражения … Физическая энциклопедия
КРОВЬ — КРОВЬ, жидкость, заполняющая артерии, вены и капиляры организма и состоящая из прозрачной бледножелтоват. цвета плаз мы и взвешенных в ней форменных элементов: красных кровяных телец, или эритроцитов, белых, или лейкоцитов, и кровяных бляшек, или … Большая медицинская энциклопедия
Угленатровая соль* — или сода, Na2CO3, содержит 58,49% Na 2O и 41,51% CO 2. Она представляет белого цвета и неприятного щелочного (мыльного) вкуса порошковатое вещество уд. в. 2,4 (при 20°), плавится при темп. от 810° до 1098° (по различным данным) и при более… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Угленатровая соль — или сода, Na2CO3, содержит 58,49% Na2O и 41,51% CO2. Она представляет белого цвета и неприятного щелочного (мыльного) вкуса порошковатое вещество уд. в. 2,4 (при 20°), плавится при темп. от 810° до 1098° (по различным данным) и при более сильном… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Гидросульфит аммония — Общие Систематическое наименование Гидросульфит аммония Традиционные названия Сернистокислый аммоний кислый; бисульфит аммония Химическая формула NH4HSO3 Физические свойства … Википедия
СПЕКТРОСКОПИЯ — раздел физики, посвященный изучению спектров электромагнитного излучения. Здесь мы рассмотрим оптическую спектроскопию часто называют просто спектроскопией. Свет это электромагнитное излучение с длиной волны l от 10 3 до 10 8 м. Этот диапазон… … Энциклопедия Кольера