Что такое нативная структура
Что такое нативная структура
• Молекулярные шапероны связываются с белками в люмене и обеспечивают образование их нативной структуры.
После того как новообразующиеся полипептиды подверглись переносу и модификации, у них начинает образовываться нативная структура. Образование нативных структур белков представляет собой один из наиболее активных процессов, происходящих в люмене ЭПР, куда постоянно поступают транслоцированные белки.
Поскольку белки, обладающие дефектной нативной структурой, представляют большую опасность для клетки, одна из главных функций ЭПР заключается в контроле за нативной структурой белков, вступающих на секреторный путь. Для этого в ЭПР существует активная система контроля качества, которая распознает нескрученные или неправильно скрученные белки и либо обеспечивает им возможность принять правильную нативную конфигурацию, либо вызывает их деградацию.
Для образования нативной структуры в эндоплазматическом ретикулуме (ЭПР) характерны те же проблемы, что и для ее образовании в цитозоле. Движущей силой при формировании нативной структуры белка являются гидрофобные взаимодействия: гидрофобные домены проявляют тенденцию связываться друг с другом, а не оставаться в водном окружении.
Однако гидрофобные домены могут связываться неправильным образом, что приводит к дефектной нативной структуре белка или к его агрегации при взаимодействии с другими белками. In vivo молекулярные шапероны способствуют образованию нативной структуры белка, обеспечивая надлежащее окружение для протекания этого процесса и контроль за его результатами. Структурные перестройки могут повторяться до тех пор, пока белок не приобретет правильную нативную конформацию.
Шапероны в в эндоплазматическом ретикулуме (ЭПР) очень активны и составляют основу системы контроля структуры белка. Пока белок связан с шаперонами, он не может выйти из ЭПР и транспортироваться в аппарат Гольджи.
Многие распространенные шапероны ЭПР родственны шаперонам цитозоля. В люмене к числу наиболее полно охарактеризованных шаперонов относится белок BiP, из группы hsp70. Этот белок — самый часто встречающийся в ЭПР и взаимодействует со многими белками на ранних этапах образования их нативной структуры.
Поскольку обычно гидрофобные области скрыты в сердцевине глобулярных белков, присутствие на поверхности молекулы гидрофобных участков свидетельствует о том, что белок полностью не приобрел нативную структуру. Эти участки служат местами связывания BiP с нативной цепью. За счет последовательных циклов гидролиза АТФ BiP неоднократно связывается с новообразующимся белком и высвобождается. Тем самым предупреждается агрегация образующегося белка и облегчается образование им правильной нативной структуры.
На активность BiP в качестве шаперона влияют дополнительные белки, стимулирующие гидролиз АТФ, а также белки, способствующие обмену АДФ на АТФ. Возможно, что таким образом, в зависимости от потребностей клетки, может регулироваться скорость образования нативной структуры белка. После того как белок образовал компактную структуру, гидрофобные участки которой находятся внутри, связывание BiP прекращается. Очень высокое содержание BiP в люмене ЭПР позволяет предполагать, что он является одним из первых шаперонов, с которыми встречается большинство новообразующихся белков, и что при попытке формирования нативной структуры поблизости всегда оказываются молекулы BiP.
Данный белок с самого начала участвует в этом процессе и играет основную роль в облегчении скручивания белковой цепи.
К другим шаперонам, содержащимся в люмене и цитозоле, относится белок Grp94, принадлежащий к семейству hsp90. Хотя этот белок, так же как и BiP, находится в люмене в больших количествах, в отличие от последнего он связывается с белками, которые уже частично приобрели нативную структуру, а не с теми, которые только что вышли в люмен и таковой не обладают. Grp94 взаимодействует с меньшим количеством субстратов, чем BiP, и неизвестно, какое свойство белка он узнает.
Вероятно, функция его в основном заключается в том, чтобы способствовать эффекту BiP и других шаперонов, участвующих в формировании нативной структуры. Существование белка Grp94 служит показателем того, что контроль качества образования нативной структуры белковой цепи носит многоуровневый характер.
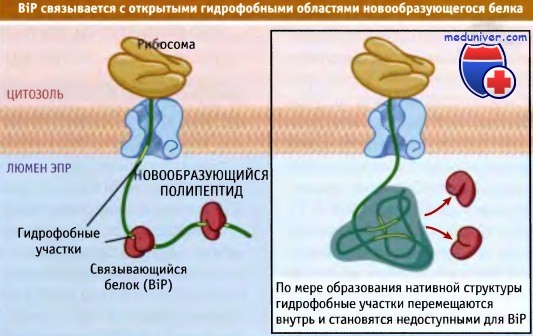
После приобретения белком нативной структуры его гидрофобные участки оказываются в глубине и более недоступны для BiP.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Понятие нативный белок. Понятие об аллостерических белках
Специфичность первичной структуры белка. Особенности образования пептидной связи. Определяющая роль первичной структуры в формировании более высоких уровней организации белковой молекулы.
Первичная структура белка.
Если в образовании пептидной связи участвует иминогруппа пролина или гидроксипролина, то она имеет другой вид.
При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов.
Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи:
• способность существовать в двух резонансных формах (кето- или енольной форме);
• транс-положение заместителей по отношению к С-N-связи;
• способность к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
• Исключение составляют пептидные группы с участием аминогруппы пролина или гидроксипролина. Они способны образовывать только одну водородную связь (см. выше). Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
4.Вторичная структура белка. Связи, стабилизирующие вторичную структуру, α-спираль. Факторы, нарушающие спирализацию. β-складчатая структура, особенности конформационного строения.
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ укладки полипептидной цепи в определенную конформацию.
Процесс этот протекает не беспорядочно, а в соответствии с первичной структурой белка.
Вторичная структура поддерживается в основном водородными связями, хотя для некоторых белков определенный вклад вносят пептидные и дисульфидные ковалентные связи.
Тип конфигурации полипептидных цепей, когда сегменты пептидной цепи располагаются в один слой, образуя структуру, подобную листу, сложенному в гармошку, называется -структурой. Такой тип вторичной структуры обнаружен в белках мышц, волос, шелка. -Слой может быть внутримолекулярным, а также образованным двумя или более полипептидными цепями.
Способность к образованию водородных связей, являющихся движущей силой при возникновении α- и β-структур в белковой молекуле, выражена у разных аминокислот в неодинаковой степени. Выделяют группу спиралеобразующих аминокислот: ала, глн, глу, лей, мет, лиз, гис. Вал, иле, тир, тре, фен способствуют образованию -структур полипептидной цепи. Наличие сер, гли, про, асн, асп приводит к преимущественному образованию неупорядоченных фрагментов в белковой молекуле.
В природе существуют белки, строение которых не соответствует ни
β-, ни -структуре (коллаген).
5.Третичная структура белка. Связи, стабилизирующие третичную структуру (ковалентные, ионные, гидрофобные, водородные, Ван-дер-Ваальса).
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, Третичная структура белка (миоглобин кашалота) впервые была установлена методом рентгеноструктурного анализа (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основная роль принадлежит нековалентным связям (межмолекулярные ван-дер-ваальсовы силы, водородные связи, электростатические взаимодействия ионизированных групп, гидрофобные взаимодействия и т.д.).
6.Четвертичная структура белка. Понятие о мономерах и олигомерах. Зависимость свойств белка от его конформации. Взаимосвязь структуры и функции.
Четвертичную структуру имеют около 5% белков, такие как ферритин, иммуноглобулины. Субъединичное строение свойственно многим ферментам, в первую очередь тем, которые выполняют сложные функции. Почти все ДНК- и РНК-полимеразы имеют четвертичную структуру. Полипептидные цепи, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности. Только после завершения синтеза происходит их объединение в надмолекулярную структуру. Биологическую активность белок приобретает на уровне четвертичной структуры. Стабилизация четвертичной структуры происходит при участии тех же связей, что и при формировании третичной структуры, за исключением ковалентных связей.
Ряд исследователей признают наличие пятого уровня структурной организации белков. Полифункциональные макромолекулярные комплексы разных ферментов, катализирующие весь путь превращений субстрата, получили назвение метаболонов (пируватдегидрогеназный комплекс, синтетазы ВЖК, дыхательная цепь).
Понятие нативный белок. Понятие об аллостерических белках.
8.Основные функции простых и сложных белков в организме: структурная, каталитическая, рецепторная, регуляторная, транспортная, защитная, сократительная и другие.
Структурная функция. В комплексе с липидами белки участвуют в образовании биомембран клеток. Структурные белки цитоскелета придают форму клеткам и многим органоидам. Примерами структурных белков являются коллаген в соединительной ткани, кератин в волосах, коже, ногтях.
Сократительная (двигательная) функция. Сократительную функцию выполняют мышечные белки (актин и миозин). Белки цитоскелета необходимы для расхождения хромосом в процессе митоза.
Каталитическая функция. Большинство известных в настоящее время ферментов (биологических катализаторов) является белками.
Транспортная функция. Белок эритроцитов гемоглобин участвует в переносе кислорода и углекислого газа, выполняя дыхательную функцию. Альбумины сыворотки крови участвуют в транспорте липидов.
Рецепторная функция. Клеточные белки образуют специфические рецепторы и участвуют в передаче гормонального сигнала.
Гормональная функция. Группа гормонов являются белками или полипептидами, например, гормон гипофиза вазопрессин.
Содержание белков в тканях и органах. Размеры белковой молекулы. Методы определения молекулярной массы белка (гель-фильтрация, ультрацентрифугирование, диск-электрофорез).
Размер белковых молекул лежит в пределах 1 мкм до 1 нм
Гель-фильтрация, или метод молекулярных сит
Для разделения белков часто используют хроматографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического сродства.
Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с «порами», через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной «пор».
Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул (рис. 1-55).
Так как гелевая структура сефадекса легко деформируется под давлением, гели стали заменять более жёсткими матрицами (сефактил, той-оперл), представляющими сферические гранулы с разными размерами пор. Выбор размеров пор в гранулах зависит от целей хроматографии (о других хроматографических методах будет сказано ниже).
Метод разделения также основан на различии в молекулярных массах белков. Скорость седиментации веществ в процессе вращения в ультрацентрифуге, где центробежное ускорение достигает 100 000-500 000 g, пропорционально их молекулярной массе. На поверхность буферного раствора, помещённого в кювету, наносят тонкий слой смеси белков. Кювету помещают в ротор ультрацентрифуги. При вращении ротора в течение 10-12 ч более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью. В результате в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой (рис. 1-56). После расслоения белковых фракций дно кюветы прокаливают иглой и по каплям собирают содержимое небольшими порциями в пробирки.
Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакриламидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду, в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам.
Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге. Так, при электрофорезе белков сыворотки крови человека на бумаге обнаруживают только 5 главных фракций: альбумины, α1 глобулины, α2-глобулины, β-глобулины и γ-глобулины (рис. 1-57). Электрофорез тех же белков в полиакриламидном геле позволяет получить до 18 различных фракций. Для обнаружения белковых фракций полоски бумаги или столбики геля обрабатывают красителем (чаще всего бромфеноловым синим или амидовым чёрным). Окрашенный комплекс белков с красителем выявляет расположение различных фракций на носителе.
Молочные и сывороточные белки (протеины). Преимущества и обзор биологической ценности.
Что значит нативный белок
Белок – это высокомолекулярный полимер, построенный из остатков аминокислот. Почти все белки формируются двадцатью протеиногенными аминокислотами, соединенными между собой пептидными связями.
Нативный белок – это белок в исходном виде. Нативная структура белка определяется составом окружающего водного раствора и такими показателями окружения как pH, температура, ионная сила и тд. Незначительные изменения в этих показателях не ведут к радикальным метаморфозам в архитектуре белка, то есть не меняются его функциональные свойства и питательная ценность.
Процесс денатурации белка
В противовес процессам, не ведущим к структурным изменениям белков, процессы, значительно изменяющие эту структуру, но без разрушения пептидных связей, называются денатурирующими. Проблема денатурации белка в том, что денатурированный белок теряет часть своих функциональных возможностей и его питательная ценность снижается.
На производстве денатурация обусловлена необходимостью изменения физических свойств белка. Например, при частичной термической денатурации повышаются эмульгирующие свойства соевого белка. В случае со всеми белками бобовых культур термическая денатурация значительно улучшает их усвоение, так как при высокотемпературной обработке инактивируется ингибитор трипсина.
Часто полная денатурация требуется при производстве белковых напитков, потому что даже частично денатурированный белок вызывает флокуляцию (хлопьеобразование), в результате в процессе хранения образуется осадок, что недопустимо.
Температура как денатурирующий фактор
Наиболее распространенный способ денатурации белков, применяемый при переработке пищевых продуктов и их консервации, это тепловая обработка. В зависимости от температуры, длительности воздействия и типа белка такая обработка может менять свойства белка в разной степени. Поэтому не всегда белок, прошедший термообработку, становится денатурированным и теряет ряд биологических свойств.
Например, глицинин из соевого белка при 2 °С агрегируется и осаждается, но при нагреве до комнатной температуры снова становится растворимым. Сывороточные глобулярные белки альфа-лактальбумин и бета-лактоглобулин из коровьего молока денатурируются при нагреве до 83 °С. А обезжиренное молоко при 4 °С диссоциирует казеин из казеиновых мицелл (то есть мицеллы распадаются на отдельные молекулы), что меняет их свойства относительно сычужной свертываемости.
Нутритивные свойства и качество белка
Белки различаются по биологической ценности. Эти различия определяются двумя факторами – содержание незаменимых (эссенциальных) аминокислот и степень усвояемости. Сочетание этих двух факторов создает понятие «качество белка».
По современным стандартам высококачественным может считаться только белок, объем эссенциальных аминокислот в котором превышает эталонный уровень, установленный ФАО (Организация ООН по вопросам продовольствия и сельского хозяйства), УООН (Университет ООН) и ВОЗ (Всемирная организация здравоохранения). Также высококачественный белок по степени усвоения должен быть сопоставим или превосходить усвоение яичного или молочного белка. С этой точки зрения качество белков животного происхождения выше, чем качество растительных белков.
У большинства бобовых и зерновых культур белки лимитированы как минимум одной из незаменимых аминокислот. Например, рис, пшеница, ячмень и кукуруза богаты метионином, зато в них очень мало лизина. У бобовых и масличных наоборот – в их составе много лизина и недостаток метионина. А в арахисе мало и метионина и лизина. Такие аминокислоты, которых в конкретном белке меньше, чем в эталонном, называются лимитирующими. Важно, чтобы рацион содержал достаточное количество всех эссенциальных (незаменимых) аминокислот. В противном случае у взрослых людей могут развиваться патологии, а у детей до 12 лет замедляется рост.
Лейцин, изолейцин, валин, гистидин и фенилаланин – это незаменимые кислоты, которые почти не бывают лимитирующими, то есть во всех видах белка, вне зависимости от происхождения, содержание этих аминокислот достаточное или даже избыточное. Лизин, треонин, триптофан и все серосодержащие аминокислоты становятся лимитирующими чаще всего. Сегодня достаточно легко исправить проблему лимитированных белков посредством их соединения с другими белками, богатыми аминокислотами, которые для исходного белка выступают лимитирующими. Например, эффективно комбинируются бобовые и зерновые белки. То есть рацион, в котором присутствуют белки обоих типов, будет содержать все незаменимые аминокислоты в объеме достаточном для обеспечения нормального роста и жизнедеятельности организма.
Эту проблему можно решить не только правильным составлением рациона, но также на производстве посредством сапплементации – обогащения белка аминокислотой, которая для него является лимитирующей. Таким образом можно повысить биологическую ценность низкокачественного белка. Например, нутритивное качество бобовых повышается обогащением метионином, а злаковые соответственно обогащают лизином.
Оптимальная биологическая ценность белка
Оптимальной биологическая ценность белка считается в том случае, если в нем содержатся все незаменимые аминокислоты и их объем достаточен для обеспечения всех процессов роста в организме и прочих метаболических процессов на нормальном уровне.
Сложность в том, что для каждого человека из любой категории населения оптимален свой суточный объем аминокислот, который определяется, исходя из физиологических показателей, режима дня, рациона, условий жизни и множества других факторов. ВОЗ и ФАО рекомендуют использовать универсальную норму, которая применяется для определения оптимальной биологической ценности белковой составляющей рациона у детей дошкольного возраста 2-5 лет.
Слишком большое потребление аминокислот опасно тем, что приводит к «аминокислотному антагонизму», сопровождающемуся пищевым отравлением. Если в рационе чрезмерный объем одной аминокислоты, это приводит к дефициту других аминокислот, так как начинается конкурирование между ними за приоритет всасывания в кишечнике (то есть какие-то аминокислоты просто не будут успевать усваиваться).
Например, если в рационе избыточный объем лейцина, он усваивается в кишечнике приоритетнее изолейцина, валина и тирозина. И даже если три эти аминокислоты присутствуют в рационе в достаточном объеме, возникает их дефицит, что также может приводить к задержке роста у детей и развитию патологических состояний у взрослых.
Усвояемость и конформация белка
Хотя объем эссенциальных аминокислот является превалирующим фактором, также для качества белка важна усвояемость – этот показатель отображает процент белка, который всасывается стенками кишечника. Например, для молока это 95%, а для риса 75%. Соответственно, для покрытия суточной нормы одних и тех же аминокислот нужен существенно больший объем рисового белка в сравнении с молочным (то есть «наесть» дневную норму потребление рисковым белком действительно сложно). В целом, белки животного происхождения усваиваются лучше, чем растительные белки.
На производстве часто выполняется гидролиз белков протеазами (ферменты, расщепляющие пептидную связь между аминокислотами), степень этого воздействия зависит от структурного состояния белка. Нативные (неденатурированные) белки гидролизованы значительно меньше, чем денатурированные. Гидролизации практически не подвержены нерастворимые фибриллярные белки и глобулярные белки, которые уже полностью денатурированы.
В качестве примера можно привести фазеолин (белок фасоли), который может быть подвергнут гидролизу протеазами и в этом случае будет расщеплен лишь частично с высвобождением полипептидов молекулярной массы до 22,000 Да. Но если фазеолин подвергнуть гидролизу протеазами при тепловой обработке, он полностью распадется до аминокислот и дипептидов.
Факторы, снижающие биологическую ценность белка
Большинство растительных белков в форме концентратов и изолятов содержат ингибиторы трипсина и химотрипсина. Эти вещества значительно замедляют процесс гидролиза белков из бобовых и масличных культур, а также препятствуют их полному гидролизу панкреатическими ферментами протеазами. Также эти растительные белки имеют в составе лектины (гликопротеины, «склеивающие» углеводы). Лектины связываются с клетками слизистой оболочки кишечника, что мешает проникновению аминокислот через кишечную стенку.
Некоторые ингибиторы трипсина и химотрипсина (тип Баумана-Бирка) термостабильны, а другие (тип Кунитца) термолабильны (то есть неустойчивы к тепловому воздействию). Также термолабильны лектины. Это значит, что после прохождения тепловой обработки белки бобовых и масличных культур лучше усваиваются (даже лучше, чем изоляты нативных белков).
В растительных белках содержатся таннины и фитаты, которые также снижают их биологическую ценность. Например, таннины препятствуют расщеплению полипептидов – процесс, который катализируется трипсином. Также скорость и полнота гидролиза белков снижается в процессе их взаимодействия с полисахаридами и пищевыми волокнами.
Оценка биологической ценности белков
Оценка биологической ценности белка для производителей необходима потому, что она позволяет выявить наиболее щадящие методы воздействия, при которых максимально сохраняется питательная ценность и функциональные свойства нативной формы (например – способность лакто-глобулина транспортировать Витамин D3 в кишечнике и свойство лактоферрина стимулировать развитие полезной микробиоты).
Для конечного потребителя оценка биологической ценности белка тоже важна, она позволяет точно определить оптимальный объем того или иного белка (или их комбинации) в рационе, не допустив недостатка и «аминокислотного антагонизма» при избытке. Для проведения такой оценки используют рацион с содержанием белка 10% (по сухой массе) с обеспечением его энергетической ценности. В течение 9 дней показатели изменения массы тела замеряются и по итогу выводится коэффициент эффективности белка (PER) – это прибавка веса в граммах на 1 грамм потребленного белка.
Другой показатель – коэффициент чистой эффективности белка (NPR), для его вычисления из показателя увеличения массы тела вычитается потеря массы из безбелковой группы и полученный результат делится на количество усвоенного белка. Показатель NPR отражает способность тестируемого белка эффективно поддерживать процессы роста и функционирования организма.
Существуют и другие методы оценки биологической ценности белка, включая ферментативные и микробиологические. Например, белок можно лабораторно расщеплять пепсином, трипсином поджелудочной железы или панкреатином. Это позволяет оценить скорость и полноту усвояемости белка, а также выявить – произошли ли с ним какие-либо изменения в процессе промышленной переработки.
Как пищевая ценность белков может меняться при промышленной переработке
Существует несколько основных видов промышленной переработки белка – нагревание, замораживание, сушка, воздействие химическими реагентами, ферментация. Самый часто применяемый метод – теплообработка, которая нужна для инактивации микроорганизмов и эндогенных ферментов, вызывающих различные изменения в белках в процессе хранения (например, их окисление). Также термообработка необходима для улучшения органолептических свойств белка (вкуса и запаха).
Еще один важный эффект от термической обработки – устранение аллергической реакции. Некоторые белки являются аллергенными, например – альфа-лактальбумин, бета-лактоглобулин и соевый белок. Но если они прошли обработку высокими температурами, возможные аллергические реакции и реакции гиперчувствительности устраняются. Проблема в том, что очень часто термообработка и другие методы денатурации негативно сказываются на пищевой ценности белка.
Умеренная тепловая обработка
Большинство пищевых белков частично денатурируются при умеренной тепловой обработке 60-90°С (длительность обработки – не более 60 минут). Этот процесс снижает растворимость белков и соответственно ухудшает зависящие от растворимости функциональные свойства. Однако с точки зрения качества белка частичная денатурация улучшает его усвояемость и биодоступность незаменимых аминокислот. Например, яичный белок и некоторые очищенные растительные белки отличаются недостаточной усвояемостью даже когда из них удаляются ингибиторы протеаз. Однако умеренная температурная обработка повышает этот показатель и при этом не образуются токсичные производные.
Также при умеренной тепловой обработке помимо протеаз инактивируются липазы, липоксигеназы, амилазы, полифенолоксидазы и некоторые другие ферменты, активность которых при хранении может приводить к изменениям вкуса и цвета белка. Например, в белках масличных и бобовых культур содержится много липоксигеназы. Этот фермент опасен тем, что в присутствии кислорода он катализирует окисление полиненасыщенных жирных кислот до гидропероксидов. В результате, образуются альдегиды и кетоны, которые приводят к появлению постороннего вкуса у соевой муки и изолятов соевого белка. Но если перед измельчением семян или бобов липоксигеназа была инактивирована тепловой обработкой, изменение вкуса не происходит.
Для растительных белков тепловая обработка полезнее, чем для белков животного происхождения, потому что в растительных белках много так называемых антиалиментарных веществ. Например, это уже упомянутые ингибиторы трипсина и химотрипсина, которые значительно снижают усвояемость белка и соответственно – его биодоступность. Опасность этих ингибиторов в том, что их деятельность проводит к повышенной выработке трипсина и химотрипсина, что может привести к гипертрофии и аденоме поджелудочной железы. Лектины, характеризующиеся высоким сродством с углеводами, не только ухудшают усвоение белка, с которым поступают, и снижают усвоение других нутриентов, но также являются фитогемагглютининами. Так называются вещества, которые приводят к агглютинации («слипанию») красных кровяных телец – эритроцитов.
Так как все эти вещества, содержащиеся в растительных белках, термолабильны, температурная обработка решает указанные проблемы. Например, пропаривание соевой муки, обжарка бобов и семян масличных растений предупреждает гипертрофию поджелудочной железы и повышает коэффициент эффективности белка. Такие же вещества-ингибиторы содержатся в яичном и молочном белке. В яичном это овомукоид и овоингибитор, в молочном – ингибитор плазменогенового активатора (PAI) и ингибитор плазмина (PI). В присутствии воды при умеренной тепловой обработке эти ингибиторы инактивируются. Также инактивируются некоторые токсины, например – энтеротоксин, который продуцируется Золотистым стафилококком. При этом степень денатурации недостаточная, чтобы снизить функциональные свойства молочных белков.
Специфика производства концентратов и изолятов белков
Изоляты белка получают из исходно сырья различными методами – экстракция, изоэлектрическое осаждение, термокоагуляция, ультрафильтрация и дифильтрация. Часть белков может теряться при некоторых методах, например – богатые серой альбуминопободные белки при изоэлектрическом осаждении могут оставаться в супернатанте (то есть в надосданой жидкости). Это значит, что часть нативных белков не войдет в конечный продукт, соответственно – изменяется аминокислотный состав и снижается биологическая ценность изолята по сравнению с исходным сырьем.
Однако, например, в сывороточных концентратах, которые производятся методом ультрафильтрации и диафильтрации, аминокислотный состав не меняется. В таком случае не меняются физические и функциональные свойства белков (в частности – глобулярных белков концентратов молочной сыворотки). Однако меняется их протеозопептонный состав, как результат – меняются пенообразующие свойства.
Химические изменения аминокислот
В отличие от низкотемпературной обработки, которая может только изменять свойства белка, высокотемпературная обработка запускает ряд процессов, происходящих непосредственно с аминокислотами. Это процессы рацемизации, гидролиза, десульфурации (потеря серы) и дезамидирования. Почти все они необратимы, но опасность заключается в том, что при некоторых из них могут образовываться структурно-модифицированные типы аминокислот, проявляющие токсичность.
Потенциальная опасность некоторых процессов денатурации
При высокотемпературной обработке белков в условиях щелочных значений pH происходит частичная рацемизация, в процессе которой остатки L-аминокислот превращаются в остатки D-аминокислот. Также рацемизация возможна при реакции гидролиза и при нагреве белка до 200 °С. Негативная сторона этого процесса в том, что пептидные связи между D-аминокислотами меньше подвержены ферментативному гидролизу, чем пептидные связи L-аминокислот. То есть такой белок усваивается хуже. Кроме того, в процессе рацемизации частично теряются незаменимые аминокислоты и снижается биологическая ценность белка.
Также тепловая обработка в щелочной среде помимо рацемизации приводит к разрушению аргинина, серина, треонина, лизина (например, аргинин разлагается до орнитина). При нагреве до 200 °С разлагается большинство аминокислотных остатков. Такой нагрев возможен не только на производстве, но и в быту, пример – готовка мяса на гриле. Опасность обработки белка такими температурами в том, что пиролиз (разложение) аминокислотных остатков приводит к образованию ряда продуктов, для которых тест Эймса показал высокую мутагенность. Наиболее мутагенные и канцерогенные аминокислотные остатки образуются при пиролизе триптофана и глутаминовой кислоты.
Мутагенные соединения, образующиеся в мясе при высоких температурах, называются имидазохинолинами. Это продукты общей конденсации углеводов, креатина и одной или нескольких аминокислот – глицина, треонина, аланина, лизина.
Также в процессе обработки белков в щелочной среде могут образовываться так называемые «сшивки» между молекулами и внутри молекул. Опасность процесса в том, что, например, лизиноаланиновая сшивка не может быть расщеплена трипсином, соответственно эти аминокислоты не усвояется. Поэтому образование сшивок снижает усвояемость и биологическую ценность белка. Однако проблема шире, потому что лизиноаланиновая сшивка не дает усваиваться рядом находящимся молекулам. При этом сам лизиноаланин всасывается стенками кишечника, но не усваивается организмом и выводится с мочой. Таким образом, при обработке белка в щелочной среде важно минимизировать количество лизиноаланина, хотя для человека появление таких сшивок не дает нефротоксического эффекта (такой эффект отмечен у мышей).
При переработке молока даже при нейтральной среде pH высокие температуры приводят к образованию лизиноаланина. Для подавления этого процесса вводят цистеин, аммиак или сульфиты. Наиболее безопасный вариант – вообще не обрабатывать молочный белок при высоких температурах, оставляя его нативным. В этом случае лизиноаланина либо нет вообще, либо его количество незначительно. Также в этом случае белок сохраняет высокую усвояемость и биологическую ценность (соответственно – имеет высокое качество).
В каких условиях меняются функциональные свойства белков
Небольшая денатурация (например – обработка при умеренных температурах) обычно желательна для белков, потому что таким образом обеспечивается необходимый уровень растворимости, благодаря которому белок можно использовать по назначению. Более того – в некоторых случаях частичная денатурация может улучшить функциональные свойства конечного продукта. Но некоторые способы и технологии изоляции (выделения) белка ухудшают его свойства.
Например, если белок изолируется методом изоэлектрического осаждения, структуры большинства глобулярных белков остаются стабильны, но если в белках есть пустоты (типа казеиновых мицелл), то они необратимо дестабилизируются. В результате коллапса (сжатия) мицеллярной структуры меняются ее свойства, что обусловлено в том числе изменением состава изолята по сравнению с исходным белком. Это объясняется тем, что часть фракций белка выпадает в осадок и не попадает в конечный изолят.
В производстве концентратов сывороточных белков и изолятов сывороточных белков чаще всего применяется метод ультрафильтрации, в ходе которой удаляются мелкие растворенные примеси, что влияет в большей степени на изменение небелкового состава конечного продукта. Удаление лактозы и золы меняет функциональные свойства белка, а при выдерживании ультрафильтрованного концентрата при температура 50-55 °С усиливается взаимодействие «белок-белок», в результате чего меняется влагосвязывающая способность, гелеобразование, пенообразование и эмульгирующие свойства. При этом у изолятов, полученных методом ионного обмена, ниже зольность (содержание кальция и фосфатов), поэтому его функциональные свойства лучше, чем у изолятов, полученных методами фильтрации.
Выдерживание белков при щелочной pH сильно меняет их аминокислотный состав, зато они лучше растворяются. Также для экстрагирования могут применяться химические реагенты, например – для экстрагирования соевого и хлопкового масла применяют гексан (насыщенный углеводород). Такая обработка приводит к денатурации, как и высокотемпературная обработка.
Почему для повышения питательной ценности рациона предпочтительнее нативный белок
На производстве белки часто полностью или частично денатурируются, что может существенно менять их качество, влияя на аминокислотный состав и усвояемость. Зачастую это необходимо для решения технических задач – улучшения растворимости, пенообразования, эмульгирования конечного продукта. Однако в контексте употребление белков в форме добавок для повышения питательной ценности рациона предпочтительнее неденатурированные (нативные белки), то есть белки, которые не были подвергнуты денатурации.
В качестве примера можно привести концентраты и изоляты сывороточных белков, которые получают методом ультрафильтрации и диафильтрации, то есть речь идет о чисто механической обработке без применения химических реагентов, высоких температур и иных технологий, которые могут существенно изменить структуру нативного белка и его свойства. В таком случае обеспечивается максимальная питательная ценность получаемого продукта, а глобулярные белки сохраняют свои свойства. Глобулярные белки – это группа белков, которые представляют собой полипептидные цепи, свернутые в шары (глобулы).
В нативных молочных белках содержатся следующие глобулярные белки – бета-лактоглобулин, альфа-лактальбумин, иммуноглобулины, альбумин сыворотки крови, гликомакропептиды, лактоферрин. Если эти глобулярные белки сохраняют нативную форму (не подвергаются денатурации), они выступают естественным источником всех незаменимых аминокислот без лимитирующих аминокислот, причем на аминокислоты с разветвленной боковой цепочкой приходится около 21% аминокислотного состава белка. Глобулярные белки необходимы для обеспечения транспорта нутриентов в кишечнике (например, транспорт Витамина D3 невозможен без бета-лактальбумина).
Глобулярные белки оказывают антиоксидантное действие, подавляя активность свободных радикалов кислорода, разрушающих здоровые клетки. Эти белки необходимы для работы иммунной системы, для нейтрализации патогенов, токсинов, ядов и чужеродных белков. Они обеспечивают защиту кишечной стенки, подавляют развитие патогенной кишечной микрофлоры и стимулируют полезную микробиоту, включая лактобактерии и бифидобактерии. Гликомакропептиды активируют выработку холецистокинина (нейропептидный гормон, обеспечивающий чувство насыщения), альбумин сыворотки крови является источником железа (профилактика анемии), а лактоферрин оказывает противоопухолевую активность.
При денатурации молочных белков все или почти все свойства глобулярных белков теряются, снижается объем BCAA и других незаменимых аминокислот. Именно поэтому применительно к сывороточным концентратам и изолятам для повышения питательной ценности рациона предпочтительнее нативный белок, сохраняющий исходно высокое качество.
