Что такое название веществ
Названия химических соединений
Химическое соединение — это молекула, в составе которой находится более одного элемента. Оно образуется в том случае, когда элементы соединяются друг с другом при помощи особой прочной связи. Такое соединение является новым веществом.
По какому принципу химические соединения получают свои названия? Происходит это в соответствии с определенными правилами, принятыми и понятными во всем мире. Название вещества состоит из наименований всех элементов этого соединения и указания на строение молекулы.
Основной принцип присвоения названий
Если в состав вещества входит только один элемент, то наименование в большинстве случаев совпадает с названием соответствующего элемента. Например: Fe — железо, Na — натрий, Si — кремний.
А сейчас давай разберемся, как называют молекулы, в состав которых входят два элемента. Название такого вещества состоит из двух слов.
Одно из них — это название того элемента, который стоит в формуле первым. Для того чтобы получить второе слово, мы используем название второго элемента, но добавляем к нему суффикс «-ид».
Например: CI — хлор — хлорид, Br — бром — бромид.
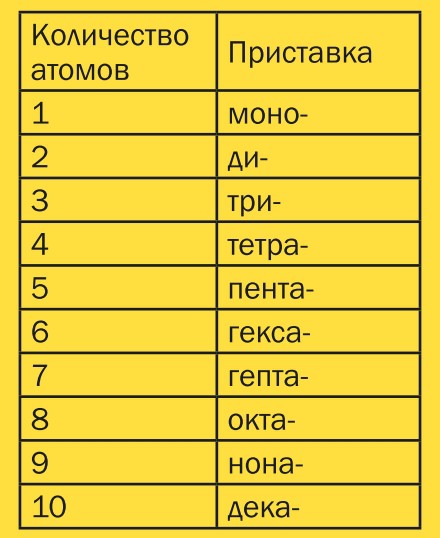
Если в молекуле больше одного атома какого-либо элемента, то химики используют так называемые числовые приставки, которые указывают количество атомов в молекуле.
Например: ССI4 — тетрахлорид углерода, РСI3 — трихлорид фосфора, СO2 — диоксид углерода.
Как определяется порядок элементов в формуле?
Если в вещество входят два элемента, какой из них должен стоять на первом месте?
Когда в состав химического соединения входят металл и неметалл, то металл ставится на первое место.
Если же соединение состоит из двух неметаллов, то первым в формуле становится элемент, который находится в таблице периодических элементов Менделеева левее. Например:
Запомни: как правило, при составлении наименований химических соединений используются названия элементов на русском языке, но для некоторых элементов применяются их латинские наименования, например О — кислород (оке, оксиген) — оксид, S — сера (сульф) — сульфид и др.
Например: NaCI — хлорид натрия, MgS — сульфид магния.
Что такое название веществ
8.1. Что такое химическая номенклатура
| Химическая номенклатура – свод правил, позволяющих однозначно составить ту, или иную формулу или название любого химического вещества, зная его состав и строение. |
| Систематическое название вещества – название вещества, составленное по номенклатурным правилам и отражающее состав, а иногда и строение данного вещества. |
Для многих веществ кроме систематических используются и традиционные, так называемые тривиальные названия. При своем возникновении эти названия отражали определенные свойства веществ, способы получения или содержали название того, из чего данное вещество было выделено. Сравните систематические и тривиальные названия веществ, приведенных в таблице 25.
К тривиальным относятся и все названия минералов (природных веществ, составляющих горные породы), например: кварц (SiO2); каменная соль, или галит (NaCl); цинковая обманка, или сфалерит (ZnS); магнитный железняк, или магнетит (Fe3O4); пиролюзит (MnO2); плавиковый шпат, или флюорит (CaF2) и многие другие.
Систематическое название
Тривиальное название
Карбонат калия К2СО3. Техническое (тривиальное) название – поташ. По строению, свойствам и применению карбонат калия очень похож на карбонат натрия. Ранее его получали из золы растений, да и сама зола использовалась при стирке. Сейчас большая часть карбоната калия получается в качестве побочного продукта при производстве глинозема (Al2O3), используемого для производства алюминия.
Из-за гигроскопичности поташ применяют в качестве осушающего средства. Используют его и в производстве стекла, пигментов, жидкого мыла. Кроме этого, карбонат калия – удобный реактив для получения других соединений калия.
Названия большинства простых веществ совпадают с названиями соответствующих элементов. Только все аллотропные модификации углерода имеют свои особые названия: алмаз, графит, карбин и другие. Кроме этого имеет свое особое название одна из аллотропных модификаций кислорода – озон.
Простейшая формула простого немолекулярного вещества состоит только из символа соответствующего элемента, например: Na – натрий, Fe – железо, Si – кремний.
Аллотропные модификации обозначают, используя буквенные индексы или буквы греческого алфавита:
В молекулярных формулах молекулярных простых веществ индекс, как вы знаете, показывает число атомов в молекуле вещества:
H2 – водород; O2 – кислород; Cl2 – хлор; O3 – озон.
В соответствии с номенклатурными правилами систематическое название такого вещества должно содержать приставку, показывающую число атомов в молекуле:
H2 – диводород;
O3 – трикислород;
P4 – тетрафосфор;
S8 – октасера и т. д., но в настоящее время это правило еще не стало общеупотребительным.
| Озон O3 – светло-синий газ с характерным запахом, в жидком состоянии – темно-голубой, в твердом – темно-фиолетовый. Это вторая аллотропная модификация кислорода. Озон значительно лучше растворим в воде, чем кислород. О3 малоустойчив и даже при комнатной температуре медленно превращается в кислород. Очень реакционноспособен, разрушает органические вещества, реагирует со многими металлами, в том числе с золотом и платиной. Почувствовать запах озона можно во время грозы, так как в природе озон образуется в результате воздействия молний и ультрафиолетового излучения на атмосферный кислород.Над Землей существует озоновый слой, расположенный на высоте около 40 км, который задерживает основную часть губительного для всего живого ультрафиолетового излучения Солнца. Озон обладает отбеливающими и дезинфицирующими свойствами. В некоторых странах он используется для дезинфекции воды. В медицинских учреждениях для дезинфекции помещений используют озон, получаемый в специальных приборах – озонаторах. |
В соответствии с общим правилом в формуле бинарного вещества на первое место ставится символ элемента с меньшей электроотрицательностью атомов, а на второе – с большей, например: NaF, BaCl2, CO2, OF2 (а не FNa, Cl2Ba, O2C или F2O!).
Так как значения электроотрицательности для атомов разных элементов постоянно уточняются, обычно пользуются двумя практическими правилами:
1. Если бинарное соединения представляет собой соединение элемента, образующего металл, с элементом, образующим неметалл, то на первое место (слева) всегда ставится символ элемента, образующего металл.
2. Если оба элемента, входящие в состав соединения – элементы, образующие неметаллы, то их символы располагают в следующей последовательности:
B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
Примечание: следует помнить, что место азота в этом практическом ряду не соответствует его электроотрицательности; в соответствии с общим правилом его следовало бы поместить между хлором и кислородом.
Примеры: Al2O3, FeO, Na3P, PbCl2, Cr2S3, UO2 (по первому правилу);
BF3, CCl4, As2S3, NH3, SO3, I2O5, OF2 (по второму правилу).
Систематическое название бинарного соединения может быть дано двумя способами. Например, СО2 можно назвать диоксидом углерода – это название вам уже известно – и оксидом углерода(IV). Во втором названии в скобках указывается число Штока (степень окисления) углерода. Это делается для того, чтобы отличить это соединение от СО – оксида углерода(II).
Можно использовать и тот, и другой тип названия в зависимости от того, какой в данном случае более удобен.
Примеры (выделены более удобные названия):
| MnO | монооксид марганца | оксид марганца(II) |
| Mn2O3 | триоксид димарганца | оксид марганца(III) |
| MnO2 | диоксид марганца | оксид марганца(IV) |
| Mn2O7 | гептаоксид димарганца | оксид марганца(VII) |
| CuCl | монохлорид меди | хлорид меди(I) |
| CuCl2 | дихлорид меди | хлорид меди(II) |
| NaH | моногидрид натрия | гидрид натрия(I) |
| CaH2 | дигидрид кальция | гидрид кальция(II) |
| Cr2S3 | трисульфид дихрома | сульфид хрома(III) |
| CrO3 | триоксид хрома | оксид хрома(VI) |
Если атомы элемента, стоящего в формуле вещества на первом месте, проявляют только одну положительную степень окисления, то ни числовые приставки, ни обозначение этой степени окисления в названии вещества обычно не используются, например:
Na2O – оксид натрия; KCl – хлорид калия;
Cs2S – сульфид цезия; BaCl2 – хлорид бария;
BCl3 – хлорид бора; HCl – хлорид водорода (хлороводород);
Al2O3 – оксид алюминия; H2S – сульфид водорода (сероводород).
Как вы уже заметили, в формуле бинарного соединения на первом месте стоит символ катиона или атома с частичным положительным зарядом, а на втором – аниона или атома с частичным отрицательным зарядом. Точно также составляются формулы и более сложных веществ, но места атомов или простых ионов в них занимают группы атомов или сложные ионы.
В качестве примера рассмотрим соединение (NH4)2CO3. В нем на первом месте стоит формула сложного катиона (NH4 

В формуле самого сложного иона на первое место ставится символ центрального атома, то есть атома, с которым связаны остальные атомы (или группы атомов) этого иона, а в названии указывается степень окисления центрального атома.
Примеры систематических названий:
Na2SO4 тетраоксосульфат(VI) натрия(I),
K2SO3 триоксосульфат(IV) калия(II),
CaCO3 триоксокарбонат(IV) кальция(II),
(NH4)3PO4 тетраоксофосфат(V) аммония,
PH4Cl хлорид фосфония,
Mg(OH)2 гидроксид магния(II).
Такие названия точно отражают состав соединения, но очень громоздки. Поэтому вместо них обычно используют сокращенные (полусистематические) названия этих соединений:
Na2SO4 сульфат натрия,
K2SO3 сульфит калия,
CaCO3 карбонат кальция,
(NH4)3PO4 фосфат аммония,
Mg(OH)2 гидроксид магния.
Систематические названия кислот составляется так, как будто кислота – соль водорода:
H2SO4 тетраоксосульфат(VI) водорода,
H2CO3 триоксокарбонат(IV) водорода,
H2[SiF6] гексафторосиликат(IV) водорода.(О причинах применения квадратных скобок в формуле этого соединения вы узнаете позже)
Но для наиболее известных кислот номенклатурные правила допускают применение их тривиальных названий, которые вместе с названиями соответствующих анионов приведены в таблице 27.
Таблица 27. Названия некоторых кислот и их анионов
Название

 )n
)n


 )n
)n





В этой главе вы познакомились только с самыми основными правилами химической номенклатуры. С другими правилами вы будете знакомиться по мере необходимости.
Азотная кислота HNO3 Чистая безводная азотная кислота – бесцветная жидкость, на свету она разлагается с образованием бурого диоксида азота, который окрашивает кислоту в желтоватый цвет, интенсивность которого зависит от концентрации диоксида. При неосторожном обращении с кислотой и ее попадании на кожу образуется ожог, также имеющий характерный желтый цвет. С водой азотная кислота смешивается в любых отношениях. Принято различать концентрированную, разбавленную и очень разбавленную кислоты. Смесь азотной и соляной кислот называется » царской водкой» – эта смесь так активна, что способна реагировать с золотом. Да и сама по себе азотная кислота – один из самых разрушительных реагентов. В связи с ее высокой активностью, азотная кислота не встречается в природе в свободном состоянии, хотя небольшие ее количества образуются в атмосфере. Получают азотную кислоту в больших количествах из аммиака по довольно сложной технологии, а расходуют на производство минеральных удобрений. кроме того, это вещество используется практически во всех отраслях химической промышленности.


а) Fe(NO3)3, H2SeO4, Cr(OH)3, (NH4)3PO4;
б) Cr2(SO4)3, CrSO4, CrCl3, CrO3, Cr2S3;
в) Na2SO4, Na2SO3, Na2S;
г) KNO3, KNO2, K3N;
д) HBr, H3BO3, (H3O)2SO4, (H3O)3PO4;
е) KMnO4, K2S2O7, K3[AuCl6], K3[Al(OH)6].
2.Составьте формулы следующих веществ:
а) карбонат магния, нитрат свинца(II), нитрит лития;
б) гидроксид хрома(III), бромид алюминия, сульфид железа(II);
в) нитрат серебра, бромид фосфора(V), фосфат кальция.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Химические названия и формулы веществ

Символы и наименования химических элементов приведены в Периодической системе элементов Д.И. Менделеева. Элементы условно делят на металлы и неметаллы. К неметаллам относят все элементы VIIIА-группы (благородные газы) и VIIА-группы (галогены), элементы VIА-группы (кроме полония), элементы азот, фосфор, мышьяк (VА-группа); углерод, кремний (IVА-группа); бор (IIIА-группа), а также водород. Остальные элементы относят к металлам.
При составлении названий веществ обычно применяют русские наименования элементов, например, дикислород, дифторид ксенона, селенат калия. По традиции для некоторых элементов в производные термины вводят корни их латинских наименований:
Например: карбонат, манганат, оксид, сульфид, силикат.
Используются следующие числовые приставки:
Число электроположительных и электроотрицательных составляющих в названиях указывают числовыми приставками, приведенными выше (универсальный способ), либо степенями окисления (если они могут быть определены по формуле) с помощью римских цифр в круглых скобках (знак плюс опускается). В ряде случаев приводят заряд ионов (для сложных по составу катионов и анионов), используя арабские цифры с соответствующим знаком.
Для распространенных многоэлементных катионов и анионов применяют следующие специальные названия:
Для небольшого числа хорошо известных веществ также используют специальные названия:
1. Кислотные и основные гидроксиды. Соли
Гидроксиды делят на две противоположные по химическим свойствам группы: кислотные и основные гидроксиды.
Названия распространенных кислотных гидроксидов состоят из двух слов: собственного названия с окончанием «ая» и группового слова «кислота». Приведем формулы и собственные названия распространенных кислотных гидроксидов и их кислотных остатков (прочерк означает, что гидроксид не известен в свободном виде или в кислом водном растворе):
Менее распространенные кислотные гидроксиды называют по номенклатурным правилам для комплексных соединений, например:
Названия кислотных остатков используют при построении названий солей.
Важнейшим химическим свойством основных и кислотных гидроксидов является их взаимодействие их между собой с образованием солей (реакция солеобразования), например:
Кислые и основные соли могут быть превращены в средние соли взаимодействием с соответствующим основным и кислотным гидроксидом, например:
Встречаются также соли, содерхащие два разных катиона: их часто называют двойными солями, например:
2. Кислотные и оснόвные оксиды
Кислотные и основные оксиды сохраняют солеобразующие свойства соответствующих гидроксидов при взаимодействии с противоположными по свойствам гидроксидами или между собой:
3. Амфотерные оксиды и гидроксиды
Если указанные реакции протекают в водном растворе, то состав образующихся солей меняется, но присутствие алюминия в катионе и анионе остаётся:
Амфотерным оксидам не всегда соответствуют амфотерные гидроксиды, поскольку при попытке получения последних образуются гидратированные оксиды, например:
— полигидрат оксида олова(IV)
— полигидрат оксида золота(I)
— полигидрат оксида золота(III)
4. Бинарные соединения
Многоэлементные вещества, в формулах которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения, например CSO, IO2F3, SBrO2F, CrO(O2)2, PSI3, (CaTi)O3, (FeCu)S2, Hg(CN)2, (PF3)2O, VCl2(NH2). Так, CSO можно представить как соединение CS2, в котором один атом серы заменен на атом кислорода.
Названия бинарных соединений строятся по обычным номенклатурным правилам, например:
Для некоторых бинарных соединений используют специальные названия, список которых был приведен ранее.
| ||
Телефон для связи: 8 (985) 923-81-68 |