Что такое неэлектролиты в химии 9 класс
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Неэлектролиты и электролиты: характеристика и свойства
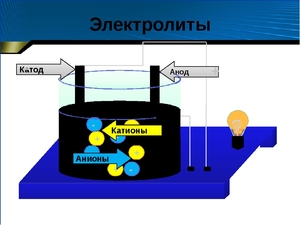
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
Неэлектролиты
Неэлектролиты находятся в растворе в виде неполярных или малополярных молекул.
Электролиты
Электролиты распадаются в растворе или расплаве на ионы, и именно наличие ионов способствует прохождению электрического тока. Процесс этот — распада на ионы — называют диссоциацией, а теория, описывающая данные процессы — теорией электролитической диссоциации. В растворе распад на ионы происходит по причине разрыва связей вещества, что является результатом взаимодействия с молекулами воды (то есть происходит гидратация электролита).
Ионы (атомы или их группы, обладающие отрицательным или положительным зарядом) под действием электрического тока начинают двигаться по направлению к одному из электродов, что и обуславливает электропроводимость.
Молекула электролита, способная диссоциировать на большее, чем два, количество ионов, будет диссоциировать постадийно. Примером может служить диссоциация многоосновной кислоты.
Подробнее познакомиться с теорией электролитической диссоциацией вы сможете, посмотрев это видео.
Степень диссоциации
Понятие, количественно характеризующее, насколько полно произошёл распад электролита на ионы, называют степенью диссоциации. Этот показатель рассчитывается как отношение количества продиссоциировавших молекул к общему числу молекул вещества в растворе и фактически показывает долю (процент) распавшихся на ионы молекул в общем количестве.
Следующие факторы могут влиять на степень электролитической диссоциации:
Температура
Зависимость от температуры достаточно сложна. Если распад на ионы экзотермический, то повышение температуры степень диссоциации будет уменьшать, а если эндотермический, повышение температуры приведёт к увеличению степени диссоциации. В целом же для каждого электролита есть определённые температурные условия, в которых он в максимальной степени будет распадаться на ионы.
Изменение показателя константы диссоциации (характеризует способность распадаться на ионы) для уксусной кислоты при изменении температуры можно привести в качестве примера:
максимальная ионизация раствора, как видно, наступает при 25 °C, а при температурах выше и ниже этого значения диссоциация происходит в меньшей степени.
Что такое степень диссоциации? Подробный ответ вы найдете в этом видео.
Природа растворителя и электролита
Стадия процесса диссоциации
Если молекула распадается на ионы постадийно, то каждая следующая стадия имеет примерно в 1000−10 000 раз меньший эффект, чем предыдущая.
Экспериментально определить степень диссоциации можно по электропроводности растворов, т. к. она прямо зависит от концентрации движущихся ионов. Истинное значение при этом получить нельзя, такое значение называют кажущимся. Оно меньше истинного, так как при движении к электродам ионы могут сталкиваться, что частично уменьшает их подвижность. При высокой концентрации может возникать притяжение между ионами, обусловленное электростатическими силами, они чаще сталкиваются, теряя свою подвижность, что влияет на показания электропроводности.
Например, в растворе соляной кислоты (1 моль/л) измерения покажут степень распада на ионы равной 0,78 (78%), но фактически раствор не будет содержать 22% недиссоциированных молекул, так как практически все молекулы диссоциированы.
Сильные и слабые проводники
По величине показателя степени диссоциации, выделяют электролиты сильные и слабые. К сильным условно относят вещества, значение степени диссоциации у которых больше 30%, если данный показатель ниже 5%, то к слабым, остальные считаются электролитами средней силы.
Сильные электролиты:
Видео
Из этого видео вы узнаете о свойствах электролитов.
Что такое неэлектролиты в химии 9 класс
Данный урок посвящен изучению темы «Электролитическая диссоциация». В процессе изучения этой темы Вы поймете суть некоторых удивительных фактов: почему растворы кислот, солей и щелочей проводят электрический ток; почему температура кипения раствора электролита выше по сравнению с раствором неэлектролита.
I. Понятие электролитическая диссоциация
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
Рис. 1. Схема распада на ионы хлорида натрия
Пронаблюдайте за следующим экспериментом: “Изучение электрической проводимости веществ”
II. Сущность процесса электролитической диссоциации. Теория ЭД
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современные положения теории электролитической диссоциации
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
2. В растворах и расплавах электролиты проводят электрический ток.
Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток
Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток
Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания
Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью
В растворах и расплавах образуются ионы
В растворах и расплавах не образуются ионы
III. Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1. Молекула воды полярна и представляет собой диполь
Растворение в воде веществ с ионной химической связью
(на примере хлорида натрия – поваренной соли)
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде (рис. 2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов.
Рис. 2. Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ; б – гидратация (окружение молекулами воды) ионов Na + и Сl –
Растворение в воде веществ с ковалентной сильнополярной химической связью
(на примере соляной кислоты)
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными (рис.3).
Рис. 3. Диссоциация молекул HCl на ионы в водном растворе
Основные положения:
Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении.
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным ( катионы ) или отрицательным ( анионы ) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам
Пример 1. Сравним свойства молекулярного водорода (состоит из двух нейтральных атомов водорода) со свойствами иона.
Пример 2. Сравним свойства атомарного и молекулярного хлора со свойствами иона.
+17Cl 0 1s 2 2s 2 2p 6 3s 2 3p 5
Атомы хлора имеют незавершённый внешний уровень, поэтому они химически очень активны, принимают электроны и восстанавливаются.
Именно поэтому газообразный хлор ядовит, при вдыхании его наступает отравление организма.
Ионы хлора имеют завершённый внешний уровень, поэтому они химически неактивны, находятся в устойчивом электронном состоянии.
Ионы хлора входят в состав поваренной соли, употребление в пищу которой не вызывает отравления организма.
1. Ионы отличаются от атомов и молекул по строению и свойствам;
2. Общий и характерный признак ионов – наличие электрических зарядов;
3. Растворы и расплавы электролитов проводят электрический ток из-за наличия в них ионов.
IV. Тренажеры
ЦОРы
Памятка (электролиты и неэлектролиты)
Урок химии в 9 классе «Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах»
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах.
Учитель химии Ранжурова М.В.
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
Рис. 1. Схема распада на ионы хлорида натрия
II. Сущность процесса электролитической диссоциации. Теория ЭД
Современные положения теории электролитической диссоциации
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток
Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток
Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания
Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью
В растворах и расплавах образуются ионы
В растворах и расплавах не образуются ионы
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А — в общем виде записывается так: КА ↔ K + + A —
III. Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н 2 О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1. Молекула воды полярна и представляет собой диполь
Растворение в воде веществ с ионной химической связью
(на примере хлорида натрия – поваренной соли)
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде (рис. 2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов.
Рис. 2. Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ; б – гидратация (окружение молекулами воды) ионов Na + и Сl –
Растворение в воде веществ с ковалентной сильнополярной химической связью
(на примере соляной кислоты)
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными (рис.3).
Рис. 3. Диссоциация молекул HCl на ионы в водном растворе
Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении.
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным ( катионы ) или отрицательным ( анионы ) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам
Пример 1. Сравним свойства молекулярного водорода (состоит из двух нейтральных атомов водорода) со свойствами иона.
Пример 2. Сравним свойства атомарного и молекулярного хлора со свойствами иона.
Cl 0 1s 2 2s 2 2p 6 3s 2 3p 5
Атомы хлора имеют незавершённый внешний уровень, поэтому они химически очень активны, принимают электроны и восстанавливаются.
Именно поэтому газообразный хлор ядовит, при вдыхании его наступает отравление организма.
Ионы хлора имеют завершённый внешний уровень, поэтому они химически неактивны, находятся в устойчивом электронном состоянии.
Ионы хлора входят в состав поваренной соли, употребление в пищу которой не вызывает отравления организма.
1. Ионы отличаются от атомов и молекул по строению и свойствам;
2. Общий и характерный признак ионов – наличие электрических зарядов;
3. Растворы и расплавы электролитов проводят электрический ток из-за наличия в них ионов.
Урок «Электролиты и неэлектролиты» (9 класс)
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Урок 1. Электролиты и неэлектролиты
Цель: дать понятие об электролитах и неэлектролитах.
ü ознакомить с понятием «электропроводность»;
ü ознакомить с понятиями «ион», «катион», «анион»;
ü формировать представления о классификации веществ на электролиты и неэлектролиты по их способности проводить электрический ток в водном растворе или в расплаве;
ü продолжить развитие умений анализировать, синтезировать, обобщать и делать выводы.
Тип: усвоения новых знаний.
Учебно-методическое обеспечение: учебное пособие; рабочая тетрадь; прибор для демонстрации опытов с электрическим током; растворы электролитов и неэлектролитов; кристаллические вещества для проведения демонстрации 1.
1. Организационный момент
Учитель приветствует учащихся, создает благоприятную обстановку начала урока.
2. Проверка домашнего задания
Учащимся предлагается выполнить самостоятельную работу.
1) Установите соответствие между формулами веществ и их названиями:
2) Составьте все возможные уравнения реакций между веществами AgNO3, NaOH, H2SO4, Hg, Na2SO4, Fe и раствором хлорида меди(II).
3)Определите химический элемент, если известно, что он располагается во IIA-группе и 2-м периоде. Составьте электронную схему атома и укажите число электронов, недостающих до завершения внешнего электронного слоя. Составьте химическую формулу гидроксида данного элемента. Укажите характер свойств гидроксида.
4) Для засолки огурцов необходим раствор хлорида натрия (w (NaCl) = 3 %). Шеф-повару потребовался такой раствор массой 3 кг. Примесями в поваренной соли можно пренебречь.
а) Запишите формулу для вычисления массовой доли растворенного вещества в растворе.
б) Найдите массу соли (г) и объем воды (см 3 ), необходимые для приготовления указанного раствора.
Учитель предлагает обсудить ситуацию:
— Дождливый день. На остановке люди складывают зонтики и заходят в салон троллейбуса. Один из них поставил ногу на ступеньку и тут же отпрянул: «Ой, током бьет!» Как ток добрался до пассажира?
В процессе обсуждения объявляется тема урока.
4. Актуализация знаний и умений учащихся
1. Учитель проводит фронтальную беседу по вопросам:
· Какие существовали теории, объясняющие процесс растворения?
· К каким процессам (химическим или физическим) относят процессы растворения?
Дайте определение растворов с точки зрения химии.
5. Изучение нового материала и первичный контроль
1. Демонстрируется электропроводность различных веществ: кристаллической NaCl, раствора NaCl, раствора сахарозы, спирта. Учитель предлагает сформулировать понятие «электропроводность».
2. Даются понятия «ион», «катион», «анион».
3. В результате обсуждения составляется схема и даются определения электролитам, неэлектролитам.
4. Учитель называет основные положения, которые учащиеся должны запомнить на этом этапе урока:
— Электролиты — это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы — это атомы или группы атомов, обладающие положительным (катионы) или отрицательным (анионы) зарядом.
7. Обобщение и систематизация изученного
1. Учащимся предлагается выполнить задания и ответить на вопросы.
1) Запишите в два столбца электролиты и неэлектролиты:
2) Какие вещества называются электролитами и неэлектролитами?
3) Назовите по два вещества, которые являются электролитами и неэлектролитами.
4) Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам: KCl, O2, HNO3, CuO.
5) Из перечня веществ выпишите формулы электролитов (воспользуйтесь таблицей растворимости):
8. Информация о домашнем задании
9. Подведение итогов
На доске нарисована окружность с секторами, обозначающими уровень усвоения материала. Учащимся предлагается оценить знания, полученные на уроке, поставив точку в соответствующем секторе.
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.