Что такое негибридные орбитали
Изучение биоорганической химии. Обзор
Одним из самых сложных предметов на первом курсе медицинского университета считается биоорганическая химия. Так сложилось, что химию школьники, мягко говоря, недолюбливают. Если с неорганической химией в 8 и 9 классах худо-бедно удавалось справляться, то когда в старших классах появляется органика – начинается сущий ад для учеников.
Биоорганическая химия – это продолжение органической химии. В начале вы повторите и усложните материал органической химии. Затем вы подробно остановитесь на органических веществах, встречающихся в живых организмах.
С чего начинается изучение биоорганической химии
Прежде, чем изучать биоорганическую химию вам придется ознакомиться с такими понятиями, как гибридизация, σ-связь, π-связь и сопряжение. Эти понятия относятся скорее к строению молекул, правда в нашем случае органических молекул.
Гибридизация
Теория гибридизации позволяет нам лучше представлять, какую форму имеют молекулы в пространстве. Существует 3 вида гибридизации атома углерода: sp3, sp2 и sp-гибридизация. В первом случае гибридизуются все орбитали углерода, во втором только 3, в третьем только 2 орбитали.
Негибридные орбитали показаны зеленым цветом.
σ-связь, π-связь
σ-связь образуется при перекрывании гибридных орбиталей, π-связь при перекрывании негибридных орбиталей.
Сопряжение
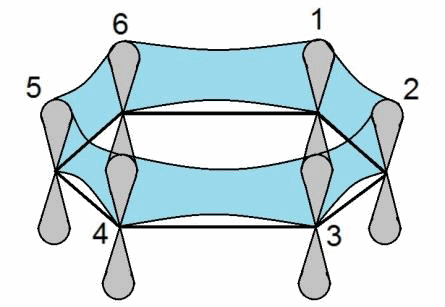
Сопряжение – это объединение нескольких негибридных орбиталей в одну. Как, например, в молекуле бензола.
Индуктивный и мезомерный эффект
Индуктивный эффект – переход электронной плотности по σ-связям, мезомерный эффект – переход электронной плотности по π-связям. Электронная плотность всегда перетекает от менее электроотрицательного атома к более электроотрицательному.
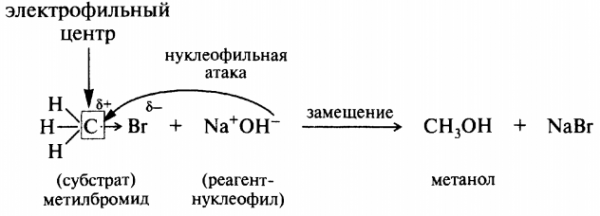
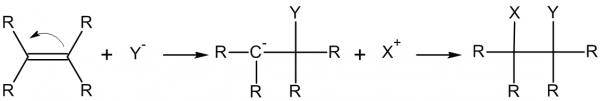
Одним из самых распространенных типов реакций является реакция нуклеофильного присоединения и нуклеофильного замещения.
Нуклеофил – атом с избытком электронной плотности.
Электрофил – атом с недостатком электронной плотности.
Они и будут соединяться между собой.
Пример реакции нуклеофильного замещения:
Реакция нуклеофильного присоединения в общем виде:
Эти понятия помогут вам лучше понимать то, как проходят реакции в органической химии. Любая химическая реакция – это перенос внешних электронов от одной молекулы к другой. Эти понятия всего лишь показывают общие закономерности этого принципа.
Предположим, мы поняли основные законы биоорганической химии. Что дальше?
Дальше вас начнут знакомить с основными классами органических веществ. Традиционно знакомство начинается с углеводородов – самых простых органических веществ, состоящих только из углерода и водорода.
Всегда помните главное правило органической химии – углерод образует 4 связи.
Итак, алканы — органические вещества, состоящие из углерода и водорода, содержат только одинарные связи. В отличии от алкенов – углеводородов с двойной связью, диенов – углеводородов с двумя двойными связями и алкинов – УВ с тройной связью.
Арены же немного другая история, эти углеводороды отличаются от всех остальных так как имеют в молекуле сопряженное бензольное кольцо. И несмотря на то что имеют кратные связи, по свойства близки к алканам, также довольно инертны, поскольку сопряженная система очень устойчива и не стремится к разрушению.
Кислородсодержащие органические вещества
К ним относятся спирты, карбонильные и карбоксильные соединения. 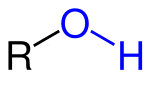
Общий вид спиртов. R – углеводородный радкикал.
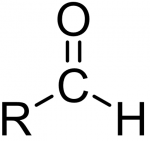
Общий вид альдегидов. Кетоны отличаются тем, что вместо Н у них еще один еще один R.
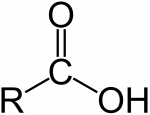
Карбоновые кислоты.
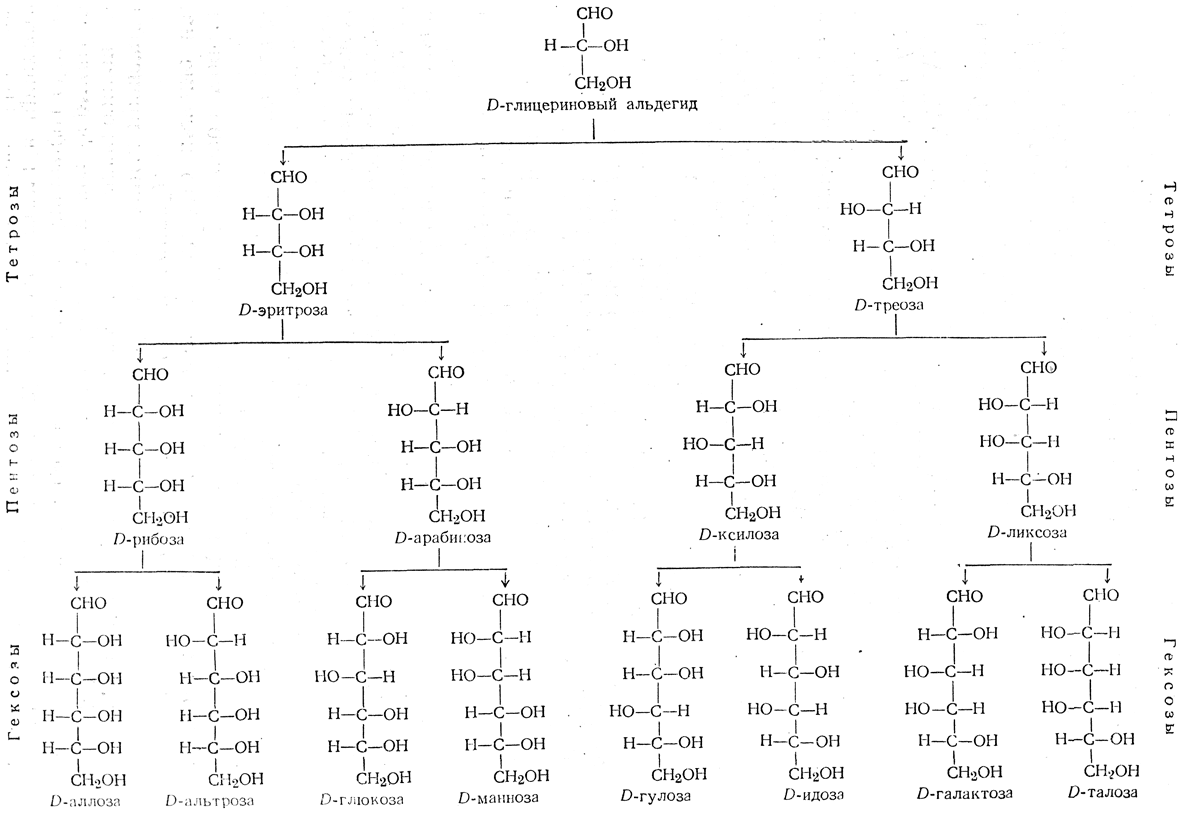
Очень большой раздел будет посвящен углеводам, вы узнаете все разнообразие представителей этого класса и то, чем все они отличаются.
Азотсодержащие органические вещества
Из азотсодержащих веществ вам встретятся уже известные амины и аминокислоты. Единственное, что вы будете изучать гетероциклы, изучение которых в полной мере не входит в школьную программу.
После изучения и повторения основных классов, вы узнаете из чего построена молекула РНК и ДНК, как происходит синтез белка и много другого интересного. Эти знания пригодятся вам для изучения биохимии.
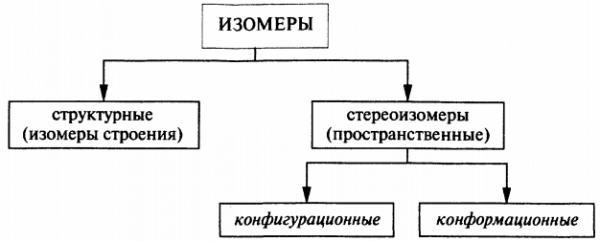
Стереоизомерия
Давайте подробно разберемся с пространственной изомерией, вызывающей самые большие сложности в понимании биоорганики.
Со структурными изомерами вас познакомили еще в школе, а вот стереоизомеры это что то новенькое.
Начнем с кофигурационных
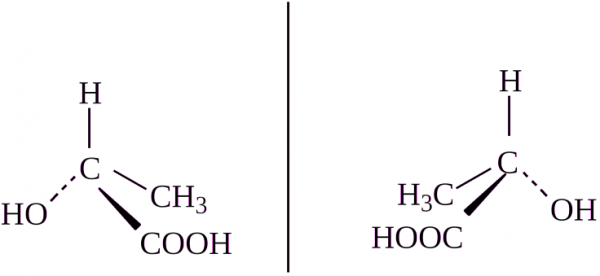
Во первых, углерод, имеющий 4 различных заместителя называется хиральным и может иметь изомеры. Например:
Это и называется конфигурационной изомерией, перед вами два изомера.
Не прогуливайте лекции и вы будете знать какой из них D, а какой L и как это определить.
Конформационные изомеры
В этих изомерах строение молекул одинаковое, да и все атомы углерода имеют одинаковую конфигурацию, но вот в пространстве они расположены по разному.
Взгляните: 
Вещества не совместятся при наложении, как бы мы не пытались. У изомеров разная конформация.
Посещайте лекции и семинары, во время выполняйте домашние работы и изучение биоорганической химии будет гладким.
Гибридизация атомных орбиталей
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
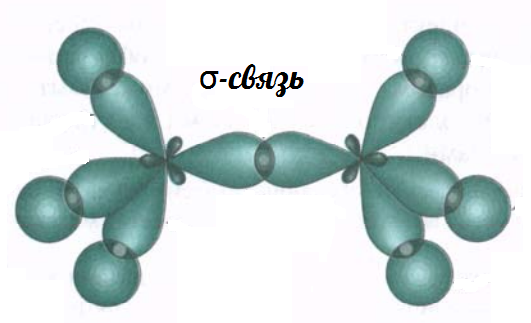
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
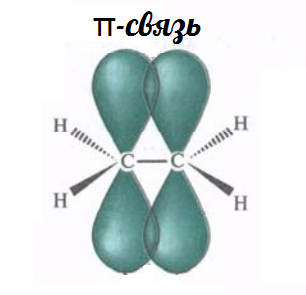
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 

В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
Изображение с портала orgchem.ru
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Что такое негибридные орбитали
Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях. Казалось бы, и связи в молекуле по прочности должны быть неравноценными. Однако опыт показывает, что они равнозначны. Это явление объясняется представлением о гибридизации атомных орбиталей, введённым американским химиком Л. Полингом.
Одинаковая прочность связей объясняется гибридизацией валентных (внешних) орбиталей, то есть смешением их и выравниванием по форме и энергии. При этом число гибридных орбиталей равно числу исходных.
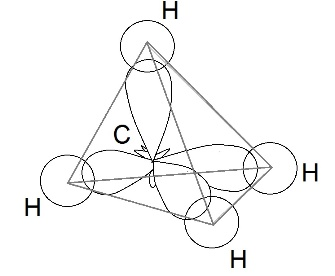 |
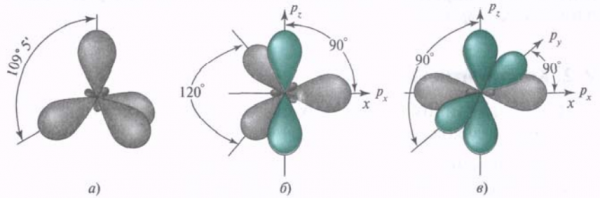
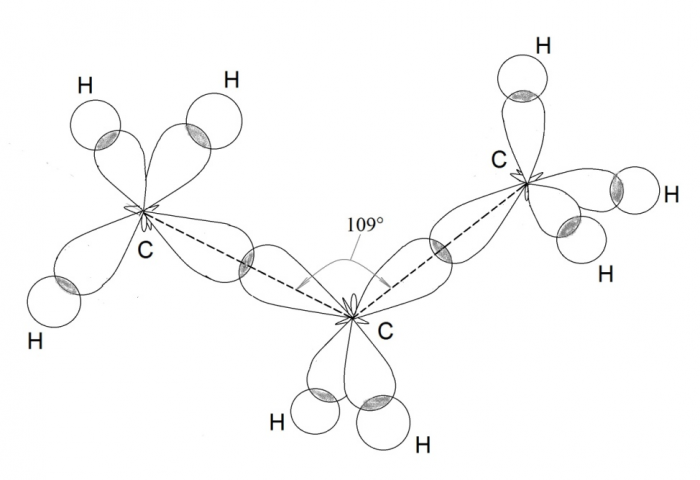
Четыре совершенно одинаковые sp 3 –гибридные орбитали атома углерода расположены под углом 109 о 28′ друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода. На рисунке видно, что гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра.
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями других атомов по сравнению с перекрыванием «обычных» s- и р-орбиталей и приводит к образованию более прочных связей.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры атомов, называется σ (сигма) – связью.
Так как гибридные электронные орбитали направлены к вершинам тетраэдра, то при образовании молекулы пропана С3Н8 направление химической связи между вторым и третьим атомами углерода не может совпадать с направлением связи между первым и вторым атомами углерода. Образуется угол 109 о 28′. Такие же углы существуют между четвертым, пятым и другими атомами углерода. Углеродная цепь принимает зигзагообразную форму:
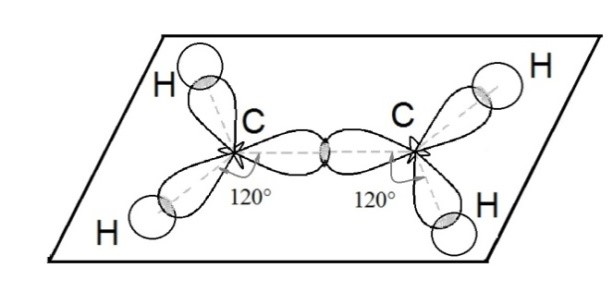
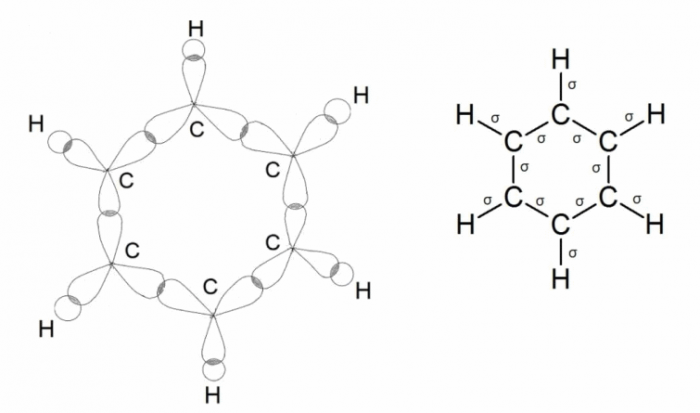
Ещё один вид гибридизации осуществляется в соединениях углерода ряда этилена. В этом случае происходит гибридизация одной s- и двух р-орбиталей углерода (sp 2 –гибридизация). При этом образуются три одинаковые sp 2 –гибридные орбитали, расположенные под углом 120 о друг к другу. Таким образом каждый атом углерода имеет по три гибридных электронных облака и по одному негибридному р-облаку. Гибридные электронные облака взаимно перекрываются и образуют между атомами углерода σ –связь:
Ковалентная связь, возникающая при перекрывании орбиталей по обе стороны линии, связывающей центры атомов, называется π (пи) – связью.
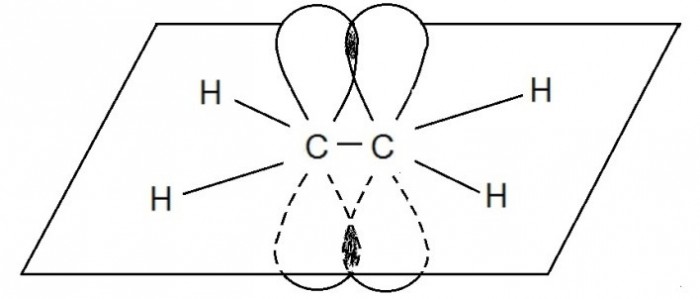
Негибридные р-электронные орбитали атомов углерода расположены перпендикулярно плоскости направления σ-связей, они также перекрываются друг с другом, образуя единую систему π-связей:
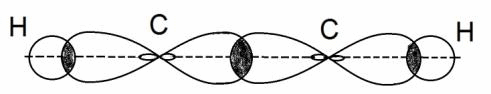
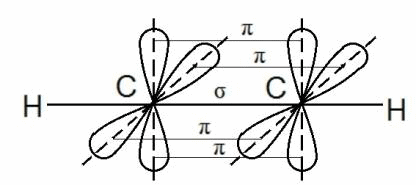
Но в молекуле ацетилена в каждом из атомов углерода содержится ещё по два p-электрона, которые не принимают участие в образование σ – связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов выступают из плоскости в перпендикулярном к ней направлении. При этом происходит некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ – связей. В итоге в молекуле ацетилена образуются ещё две ковалентные углерод-углеродные π-связи:
Под воздействием реагентов π-связь легко разрывается, она значительно слабее, чем σ–связь. π –связь образуется не только между атомами углерода, но и в случае образования двойных и тройных связей между углеродом и кислородом, углеродом и азотом.
Что такое негибридные орбитали
Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях. Казалось бы, и связи в молекуле по прочности должны быть неравноценными. Однако опыт показывает, что они равнозначны. Это явление объясняется представлением о гибридизации атомных орбиталей, введённым американским химиком Л. Полингом.
Одинаковая прочность связей объясняется гибридизацией валентных (внешних) орбиталей, то есть смешением их и выравниванием по форме и энергии. При этом число гибридных орбиталей равно числу исходных.
 |
Четыре совершенно одинаковые sp 3 –гибридные орбитали атома углерода расположены под углом 109 о 28′ друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода. На рисунке видно, что гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра.
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями других атомов по сравнению с перекрыванием «обычных» s- и р-орбиталей и приводит к образованию более прочных связей.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры атомов, называется σ (сигма) – связью.
Так как гибридные электронные орбитали направлены к вершинам тетраэдра, то при образовании молекулы пропана С3Н8 направление химической связи между вторым и третьим атомами углерода не может совпадать с направлением связи между первым и вторым атомами углерода. Образуется угол 109 о 28′. Такие же углы существуют между четвертым, пятым и другими атомами углерода. Углеродная цепь принимает зигзагообразную форму:
Ещё один вид гибридизации осуществляется в соединениях углерода ряда этилена. В этом случае происходит гибридизация одной s- и двух р-орбиталей углерода (sp 2 –гибридизация). При этом образуются три одинаковые sp 2 –гибридные орбитали, расположенные под углом 120 о друг к другу. Таким образом каждый атом углерода имеет по три гибридных электронных облака и по одному негибридному р-облаку. Гибридные электронные облака взаимно перекрываются и образуют между атомами углерода σ –связь:
Ковалентная связь, возникающая при перекрывании орбиталей по обе стороны линии, связывающей центры атомов, называется π (пи) – связью.
Негибридные р-электронные орбитали атомов углерода расположены перпендикулярно плоскости направления σ-связей, они также перекрываются друг с другом, образуя единую систему π-связей:
Но в молекуле ацетилена в каждом из атомов углерода содержится ещё по два p-электрона, которые не принимают участие в образование σ – связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов выступают из плоскости в перпендикулярном к ней направлении. При этом происходит некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ – связей. В итоге в молекуле ацетилена образуются ещё две ковалентные углерод-углеродные π-связи:
Под воздействием реагентов π-связь легко разрывается, она значительно слабее, чем σ–связь. π –связь образуется не только между атомами углерода, но и в случае образования двойных и тройных связей между углеродом и кислородом, углеродом и азотом.