Что такое нейтральная среда
Диссоциация воды. Водородный показатель. Среды водных растворов электролитов
Вода — слабый амфотерный электролит.
Уравнение ионизации воды с учетом гидратации ионов водорода Н + таково:
Без учета гидратации ионов Н + уравнение диссоциации воды имеет вид:
Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды (KH2O).
KH2O — величина постоянная, и при температуре 25 о С
В водных растворах различают три типа сред: нейтральную, щелочную и кислую.
Нейтральная среда — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов:
Кислая среда — это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов:
Щелочная среда — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
Для характеристики сред растворов удобно использовать так называемый водородный показатель рН (пэ-аш).
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора.
Существуют различные методы измерения рН. Качественно характер среды водных растворов электролитов определяют с помощью индикаторов.
Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды растворов, т. е. рН раствора.
На практике применяют индикаторы лакмус, метиловый оранжевый (метилоранж) и фенолфталеин. Они изменяют свою окраску в малом интервале рН: лакмус — в интервале рН от 5,0 до 8,0; метилоранж — от 3,1 до 4,4 и фенолфталеин — от 8,2 до 10,0.
Изменение цвета индикаторов показано на схеме:
Заштрихованные области показывают интервал изменения окраски индикатора.

Кроме указанных выше индикаторов, применяют также универсальный индикатор, который можно использовать для приблизительного определения рН в широком интервале от 0 до 14.
Величина рН имеет большое значение в химических и биологических процессах, так как в зависимости от характера среды эти процессы могут протекать с разными скоростями и в разных направлениях.
Поэтому определение рН растворов очень важно в медицине, науке, технике, сельском хозяйстве. Изменение рН крови или желудочного сока является диагностическим тестом в медицине. Отклонения рН от нормальных, величин даже на 0,01 единицы свидетельствуют о патологических процессах в организме. Постоянство концентраций ионов водорода Н + является одной из важных констант внутренней среды живых организмов.
Так, при нормальной кислотности желудочный сок имеет рН 1,7; рН крови человека равен 7,4; слюны — 6,9. Каждый фермент функционирует при определенном значении рН: каталаза крови при рН 7 пепсин желудочного сока — при рН 1,5—2; и т. д.
Теоретические основы
Вода является средой, в которой растворяются органические и неорганические химические вещества, и обладает способностью распадаться на ионы. Одна молекула отдает свой протон другой, поэтому в воде постоянно находится некоторое количество положительно заряженных ионов водорода H и отрицательно заряженных гидроксид-ионов OH. Этот процесс называется электролитической диссоциацией.
Говоря об ионе водорода, делается упрощение, так как на самом деле положительно заряженный ион в воде — это ион гидроксония H3O. Он образуется из целой молекулы воды и протона, оторванного от другой молекулы. Чем больше таких ионов в воде, тем больше и ее кислотность.
Ионы очень подвижны и постоянно переходят от одной молекулы к другой. Таким образом, процесс распада и процесс соединения в новую молекулу идут постоянно и уравновешивают друг друга, т. е. диссоциация воды находится в равновесии.
С. Сёренсен руководил химико-физиологической лабораторией при пивоваренном заводе Carlsberg, где разработал шкалу для измерения показателя pH. На ее основе были созданы специальные приборы: pH-метры, которые применяются для измерения кислотности растворов и жидкостей в промышленности, и ацидогастрометры для диагностики желудочно-кишечных заболеваний в медицине.
Важно не путать pH с понятиями кислотности и щелочности. Главное различие заключается в том, что pH — это показатель не количества, а активности.
Он отражает степень кислотности или щелочности среды, а не количественное содержание в воде химических веществ. В разбавленных растворах мера активности эквивалентна концентрации, поэтому при определенном допущении один термин заменяют другим.
Влияние pH на свойства среды
При попадании в воду многих химических соединений происходит их гидролиз. Растворяемое вещество распадается на катионы и анионы, которые могут соединяться с ионами, получившимися в результате диссоциации воды. При этом получается смещение равновесия диссоциации воды. Показатель pH определяет, в какую сторону оно произошло. Если pH 7 — щелочная.
Показатель pH влияет на протекание химических реакций как на производстве, так и в природе и является универсальным показателем состояния среды. С помощью его контроля производят все виды горючего, краски, удобрения, средства личной гигиены и косметику. В пищевой промышленности проверяется качество изготовления напитков, молокопродуктов, изделий из злаков. Все живые обитатели природных почв и вод могут жить только при определенных значениях водородного показателя, от него же зависит и урожайность многих растений, поэтому ведется наблюдение за pH в почвоведении и земледелии, особенно в гидропонике.
При этом обычно необходимо поддерживать постоянное значение pH в течение длительного времени. Для этого используют так называемые буферные растворы. Они представляют собой смеси слабого основания и его соли или слабой кислоты и ее соли, в которых мера активности ионов водорода постоянна и устойчива.
Измерение водородного показателя
Формулы для расчета pH зависят от того, к какому классу относится химическое вещество, входящее в исследуемый раствор, и приведены в специальных справочниках. Более точное значение получают другими методами. Цели и условия проведения исследований определяют, как будет измеряться водородный показатель.
Индикаторные способы
Приблизительно оценить меру активности ионов водорода можно с помощью кислотно-основных индикаторов. Такие вещества обычно относятся к органическим соединениям и имеют свойство изменять свой цвет в разных средах:
Изменение происходит для каждого индикатора в своём диапазоне кислотности, обычно составляющем 1—2 единицы. При этом методе результат можно получить быстрый и наглядный при небольших затратах, но недостаточно точный, с большой погрешностью при исследовании очень слабых растворов, окрашенных или мутных вод. Используется, когда нужно найти предварительное определение pH.
Более широкий диапазон и выше точность у универсального индикатора. Он соединяет в себе несколько индикаторов и градуируется в соответствии со значениями pH от единицы до десяти. Соответствие значения водородного показателя и цвета:
Аналитический объемный метод
Кислотно-основное титрирование — метод определения водородного показателя среды с помощью так называемых титрантов. В основном для этого используются сильные кислоты (серная, соляная) и сильные щелочи (едкий калий, каустическая сода).
Раствор-титрант добавляют в исследуемую жидкость по каплям. При этом они вступают в химическую реакцию. Когда она завершается, наступает точка эквивалентности, т. е. момент отчетливого изменения окраски исследуемого раствора. По установленному в результате опыта объему титранта, необходимому для получения точки эквивалентности, и известному значению его концентрации можно рассчитать pH с высокой точностью.
Измерительный прибор pH-метр
Ионометрический метод, при котором кислотный показатель можно измерить с помощью специализированного прибора — pH-метра, является наиболее точным (до сотых от единицы pH), удобным и имеет широкий диапазон измерения. PH-метр представляет собой милливольтметр, способный измерять разность потенциалов со стеклянных электродов. У него также есть система пересчета напряжения в pH.
В исследуемый раствор погружают индикаторный электрод и электрод сравнения, замыкая таким образом гальваническую цепь. Величина электродвижущей силы в ней зависит от активности ионов H+ в растворе, т. е. является функцией только его pH. Индикаторный электрод состоит из стеклянной трубки, заполненной специальной суспензией в растворе соляной кислоты, и погруженной в нее серебряной проволоки.
Полезный сигнал возникает на границе соприкосновения раствора и индикаторного электрода и передается через металлический проводник на вход pH-метра. Таким способом можно измерять pH любых жидкостей, в том числе непрозрачных и цветных.
Специализированный прибор, применяемый в медицине для исследований pH жидкостей желудочно-кишечного тракта, называется ацидогастрометром. Включает в себя регистрирующий блок и один или несколько зондов. Для измерения уровня pH таких биологических жидкостей, как слюна и моча, применяются электронные pH-метры.
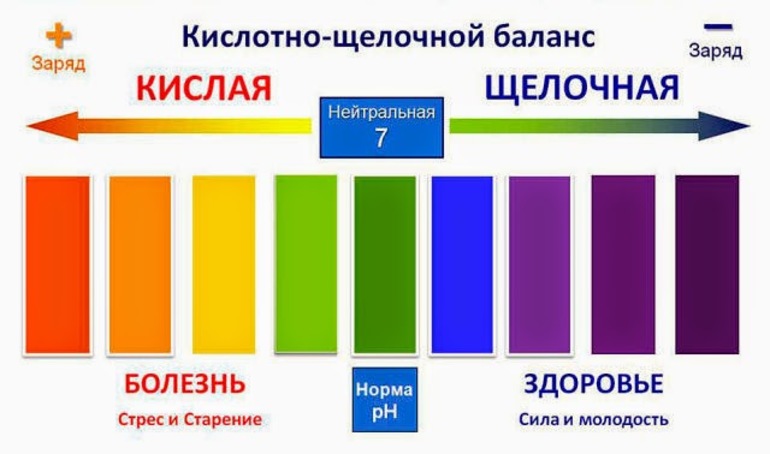
Кислотно-щелочной баланс человека
Организмом человека вырабатываются разные жидкости, каждая из которых должна иметь определенное значение pH. Отклонение в ту или иную сторону может привести к развитию множества серьезных заболеваний. Вовремя обнаруженные изменения можно исправить, если повысить или понизить кислотность потребляемых продуктов и питьевой воды. Механизм регулирования пропорционального соотношения кислот и щелочей в клеточных и межклеточных жидкостях называют кислотно-щелочным балансом (равновесием). По значению pH можно определить, в каком состоянии находятся многие органы человека.
На pH почек и печени оказывают влияние не только метаболические процессы в самом организме, но также пища и вода. Излишнюю кислотность потребленных продуктов организм выводит через мочу. Низкий уровень pH мочи говорит о том, что почки работают на пределе. Когда излишняя кислота не может быть выведена из организма естественным путем, она скапливается в подкожной жировой прослойке, имеющей кислотный pH. Это приводит к излишнему весу. В борьбе с этим явлением помогает щелочная вода, снижая нагрузку на почки.
В желудке среда резко кислая, в момент пищеварения pH равен 1,8−3. Вопреки распространненому мнению, причиной таких неприятных симптомов, как изжога и дискомфорт в желудке, является пониженная, а не повышенная кислотность желудочного сока. Нормальный уровень pH создает благоприятные условия для развития правильных бактерий и запускает механизм переваривания пищи, а болезнетворные микроорганизмы и гельминты расщепляются пищеварительными ферментами.
pH крови организм поддерживает в постоянном состоянии на уровне 7,4—7,45. Малейшее отклонение его от нормы может привести к тяжелым последствиям для человека. При понижении pH ниже 7,35 возникает ацидоз. При превышении нормы — алкалоз. Это не самостоятельные заболевания, они свидетельствуют о нарушениях в работе легких, почек, печении. Такие состояния сопровождаются очень опасными для здоровья симптомами, приводящими иногда даже к коме. По мнению врачей, ацидоз переносится легче алкалоза.
Кровеносные сосуды питают слюнные железы, поэтому за уровнем pH крови можно следить по pH слюны. Поддержание кислотно-щелочного баланса в кровеносной системе — это важнейшая функция организма человека. Внешние факторы не оказывают влияния на pH крови, он регулируется только внутренними механизмами тела человека:
Таким образом, хотя кислотный показатель крови совершенно не подвержен внешнему влиянию, механизмы его поддержания на нужном уровне имеют зависимость от того, чем человек питается и какую воду пьет. Мясо и молоко повышают общую кислотность организма, а зелень и зеленые овощи лучше всего нейтрализуют ее. Кислотность и щелочность различных пищевых продуктов можно узнать из специальных таблиц. Оптимальное значение pH для воды находится в пределах от 6 до 9.
Придерживаясь принципов правильного питания для поддержания кислотно-щелочного равновесия в своем организме, человек надолго сохранит молодость, красоту и здоровье.
Cреда водных растворов веществ. Индикаторы
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Среда водных растворов
[ Н + ] = [ ОН – ]
[ Н + ] > [ ОН – ]
[ Н + ] ОН – ]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
Растворы солей
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Fe 3+ + HOH ↔ FeOH 2+ + H +
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.